新型冠状病毒感染的临床及胸部 CT 表现初探
2021-01-18刘含秋
詹 艺 刘含秋 李 克

表1 9 例 SARS-CoV-2 感染确诊病例的临床及胸部 CT 表现汇总
自2019 年12 月以来,湖北省及全国其他地区仍至全球陆续出现2019 新型冠状病毒感染引起的肺炎病例。国家疾病预防控制中心已宣布将该病纳入国家“乙类”传染病,采取“甲类”传染病防控措施。2020 年2 月11 日,国际病毒分类委员会冠状病毒研究小组将其命名为严重急性呼吸综合征冠 状 病 毒2(severe acute respiratory syndrome coronavirus2,SARS-CoV-2)。同日世界卫生组织也宣布,由这一病毒导致的疾病正式名称为 corona virus disease-19(COVID-19)。
本病为新发传染病,对其致病机制尚有待进一步深入研究。临床诊断效能受到样本取材部位及质量、不同厂家核酸检测效能等多方面影响,具有一定的假阴性率[1]。在一组51 例的研究中发现,通过CT 诊断COVID-19 的敏感性(98%)高于通过一次核酸检测的敏感性(71%)[2]。因此,胸部CT 检查在COVID-19 诊断中具有重要价值,认识其影像特点,有助于早期发现及评估病情严重程度,指导临床治疗。截至 2020 年2 月11 日24 时,我院共计确诊SARS-CoV-2 感染9 例,本文回顾性分析和总结这些确诊患者的临床资料和胸部CT 影像学表现,以增强临床或影像科医师对该病的认识。
方 法
回顾性分析我院确诊为SARS-CoV-2 感染患者的临床及胸部CT 资料。胸部CT 扫描检查方法,采用GE Discovery 能谱CT 进行扫描;患者采取仰卧位,扫描范围从胸廓入口至双侧肋弓下缘;扫描参数:100kV,200~300mA,采用高分辨 HRCT 扫描技术,层厚2.5mm,层距2.5mm。
结 果
本研究共收集9 例经上海市疾病控制中心通过核酸检测确诊为SARS-CoV-2 感染病例。其中,男性2 例、女性7 例,年龄(46.33±14.4)岁;各病例流行病学史(湖北疫区逗留或居住史,或与疫区患者密切接触史)均阳性;临床上首发症状均为干咳和(或)发热,患者在首发症状出现后(4.78±2.64)天前往我院就诊行胸部CT 检查;其中1 例男性患者,既往患糖尿病20 年,余病例均无基础疾病(表 1)。
本组病例影像学表现呈多个肺叶受累(7/9,77.8%), 其中5 个肺叶均受累共4 例(4/9,44.4%),下肺多见受累(8/9,88.9%),两肺差异性分布少见(2/9,22.2%),其中1 例为孤立性
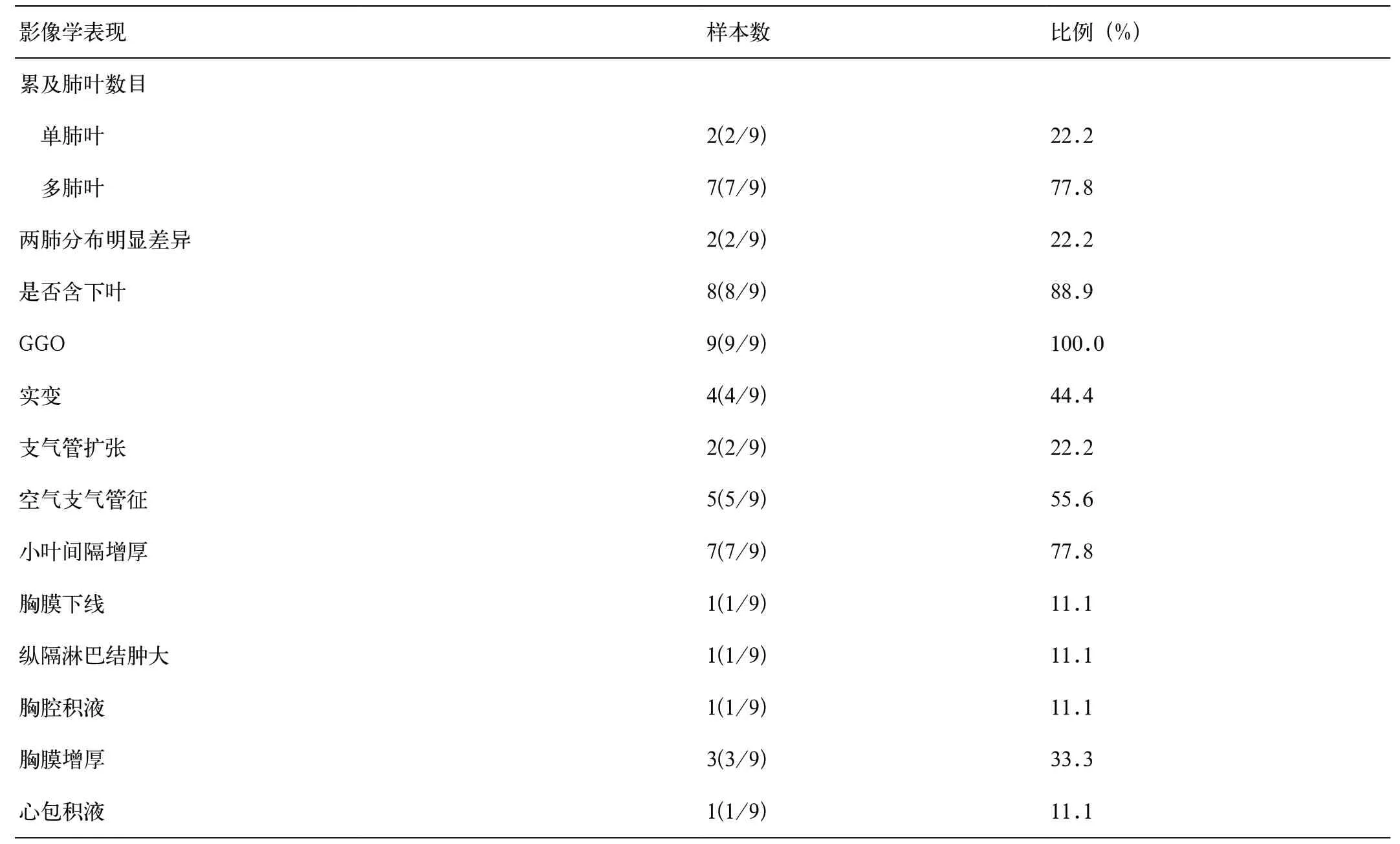
表2 SARS-CoV-2 感染确诊病例的胸部 CT 特征

图1 男性,65 岁,糖尿病史 20 年,武汉探亲史。首发症状干咳,无明显发热。患者4 天后就诊,白细胞计数 6.29×109,淋巴细胞百分比 14.7%,甲乙流筛查(-)。后经核酸检测确诊为 SARS-CoV-2 感染。胸部 CT 示两肺见多发斑片状磨玻璃密度影,胸膜下分布为著,部分可见实变,周围见少许条索影,病灶内可见空气支气管征,支气管可见轻度扩张;另见胸膜下线形成;两侧胸腔少量积液,心包少量积液。
分别采用 16 和 64 排扫描仪(由美国 GE Lightspeed16、GE Light Optima CT680 和 德 国西门子公司生产)行高分辨 CT 扫描,所有患者均取仰卧位,双臂上举,头先进,扫描前均训练患者呼吸, 在吸气末屏气扫描。扫描范围包括肺尖至肺磨玻璃病变。各病例均表现出肺内磨玻璃病变,胸膜下为著(9/9,100%),部分病例伴有实变(4/8,44.4%),小叶间隔增厚较常见(7/9,77.8%),大部分可见空气支气管征(5/9,55.6%),部分可见胸膜增厚(3/9,33.3),支气管扩张较少见(2/9,22.2%);仅1 例出现纵隔淋巴结肿大(1/9,11.1%);另有1 例患者出现胸膜下线、两侧胸腔少量积液,心包少量积液(1/9,11.1%)(表2,图1)。
讨 论
COVID-19 为新发传染病,临床诊断时,其流行病学史极其重要。本组所有病例的流行病学史均阳性;患者的首发症状均为呼吸道症状,表现为干咳,伴或不伴发热。最新文献报道,COVID-19 确诊病例中仅43.1%(473/1099)的患者表现出发热,而干咳出现的比例较高,约 67.7%(744/1099)[3]。既往病毒性肺炎(如流感病毒等)可表现为细支气管上皮受累引发的细支气管炎,累及肺间质和肺泡引起肺泡内炎性渗出以及肺间质内炎细胞浸润,严重病例可出现透明膜[4]。近期尸检研究显示,COVID-19 患者两肺呈弥漫性肺泡损伤伴细胞纤维黏液性渗出,肺泡上皮脱落,肺透明膜形成,肺水肿;间质内以淋巴细胞为主的单核细胞炎性浸润,而在肺泡腔以多核巨细胞和非典型增大的肺泡细胞[5]。虽然尸检病例为危重症感染死于呼吸衰竭,但病理结果显示该患者肺内病变部位主要为肺泡和肺间质性病变,未见明确支气管病变。最新发布的诊疗指南显示,COVID-19 也可出现肺内支气管黏膜部分上皮脱落,并在腔内形成黏液以及黏液栓[6]。本组病例主要表现为GGO、实变以及间质性病变,未见明显小叶中心性结节形成。因此,本组病例更加倾向于肺泡以及肺间质病变而无典型的细支气管炎表现。但现有研究有限,本组病例数过少,有待进一步研究。
近期临床影像学报道,COVID-19 早期病变较局限,呈斑片状、亚段或节段性纯磨玻璃影,伴或不伴小叶间隔增厚,边界清晰,胸膜下分布为著[7],这和我们观察的结果基本一致。本组病例多符合文献中早期病变特点;9 例患者出现首发症状后,平均(4.78±2.64)天行胸部CT 检查,发病时间短,临床症状多较轻,其主要的胸部CT 表现为:胸膜下显著的磨玻璃病变,局部伴有实变,小叶间隔增厚。本组中1 例病例表现为单发胸膜下磨玻璃密度影,较文献报道局限,但有典型的临床病史和流行病学史,因此对于早期SARS-CoV-2 感染影像学不典型的病例,结合临床资料及流行病学史十分关键。
此外,本组新型冠状病毒感染病例中,发现1 例肺内病变伴有两侧胸腔少量积液及心包少量积液。Song 等[8]研究发现,SARS-CoV-2 感染可出现胸腔积液(8%),较本组病例略低(11.1%),但本组样本数少,需进一步研究。本组中的该患者既往有 20 年糖尿病史,其两侧胸腔及心包少量积液可能与其基础疾病相关。因此,我们推测患有基础疾病的SARS-CoV-2 感染者,可能较易出现胸腔积液或心包积液,但需进一步研究证实。
SARS-CoV-2 病毒感染引起的肺部病变,与既往我国出现大流行的病毒性肺炎具有一定的相似性。H7N9 病毒感染引起的肺炎主要表现为两肺多发病变,磨玻璃病变为著,伴部分实变,病变分布以一侧为著;同时可见小叶中心性结节,支气管扩张;可见多发间质性病变,包括小叶间隔增厚、网格影、胸膜下线形成;胸腔积液较常见,纵隔淋巴结增大[9]。对比本组SARS-CoV-2 染者胸部CT,其两肺分布较H7N9 较均匀,未见明显小叶中心性结节形成,胸腔积液较少见,纵隔淋巴结增大较少见。H1N1 感染的轻症病例显示,病灶较为局限,多为单肺叶累及,可表现为细支气管炎、小叶中心性结节[10];而本组病例中,除两例病变局限于单肺叶病变,余病例均为多发病变,累及多个肺叶,同时没有小叶中心性结节形成,胸腔积液较为少见。严重急性呼吸综合征(severe acute respiratory syndrome,SARS)患者急性期时,主要表现为两肺胸膜下磨玻璃病变伴或不伴有实变;磨玻璃病变内常伴有小叶间隔及小叶内间质光滑样增厚;在发病后第二周,部分病变可出现磨玻璃病变伴“网格影”,且在第四周达到高峰;大部分患者在发病后第四周出现间质纤维化改变,伴有支气管扩张、变形[11]。同时,Franquet[12]认为,空洞、钙化、网格影或结节影、淋巴结肿大、胸腔积液等均不是SARS 的典型表现。本组病例显示,SARS-CoV-2感染引起的肺炎表现与SARS 具有一定相似性,但较SARS 表现更为局限,磨玻璃病变为著,病灶更为局限。其中,有两例病例表现出支气管扩张,一例出现胸膜下线,但较SARS 出现的早,可能与SARSCoV-2 感染可更早的引起间质纤维化发生。但是,鉴于本组病例暂无后续复查随访,因此其肺内变化趋势有待进一步随访分析其影像学表现。
综上所述,SARS-CoV-2 感染患者与常见的其他病毒性肺炎具有一定相似性,主要表现为两肺胸膜下分布的多发磨玻璃病变,左右肺分布无明显差异,下叶受累多见;部分病灶可伴有实变、小叶间隔增厚;纵隔淋巴结肿大较少见;胸腔积液或与基础疾病相关。部分SARS-CoV-2 感染的早期病例,其影像学表现不典型。因此,需结合临床资料、流行病学史,有助于明确诊断。此外,本组病例较少,且缺少这些患者临床和影像学的动态变化,尚需进一步扩大样本量及随访研究。
