根系分泌物对砷酸还原菌TS28活性及土壤中酶活性的影响
2021-01-18徐富凯刘亦博李美璇封保根陈薇薇
郭 平,徐富凯,刘亦博,李美璇,封保根,3,陈薇薇
(1. 吉林大学 新能源与环境学院,地下水资源与环境教育部重点实验室,长春 130012;2. 吉林省水资源与水环境重点实验室,长春 130021;3. 中国长江三峡集团有限公司 流域枢纽运行管理中心,湖北 宜昌 443000)
随着工业化和城镇化的快速推进, 我国现在面临严重的土壤污染问题, 而重金属污染是土壤污染中最重要的一方面[1],其中砷(As)是最常见的重金属污染物之一[2]. 近年来, As污染土壤的植物与微生物联合修复, 因其具有生态友好性、 修复面积大以及成本低等优点已成为土壤污染修复领域的研究热点. 因此, 揭示其修复机制具有实际意义.
无机砷酸盐[As(Ⅴ)]和亚砷酸盐[As(Ⅲ)]是土壤中分布最广的As化合物[3]. 将As(Ⅴ)还原为As(Ⅲ)可提高As的生物有效性, 有效促进植物对As的吸收富集[4]. 因此,研究人员将能还原As(Ⅴ)的外源砷酸还原菌(ARB)与As超积累植物或As富集植物联合修复As污染土壤, 结果表明,外源砷酸还原菌可提高As超积累植物或者As富集植物对土壤As的修复效果[5-8]. 植物根系分泌物是根际环境中的重要物质, 其成分包括有机酸、 氨基酸、 糖类等[9]. 由于植物根系分泌物能影响土著根际细菌以及部分外源降解菌的存活[10-11],因此,在As污染土壤的植物-微生物修复中, 外源ARB的存活也应受根系分泌物的影响. 但目前关于根系分泌物对外源ARB存活影响的信息较少, 而且在根系分泌物存在的情形下, ARB对As(Ⅴ)还原能力的影响仍未知. 此外, 酶活性可反映土壤肥力和土壤环境, 对植物-微生物修复的效果也有重要影响. 目前关于外源ARB对土壤酶活性影响的研究文献报道较少. 根系分泌物存在下ARB的存活特征及其对As(Ⅴ)还原能力和土壤酶活性的影响是研究植物与外源ARB联合修复As污染土壤的重要机制.
基于此, 本文以砷酸还原菌(Stenotrophomonassp.TS28)以及油菜、 小麦和小白菜产生的根系分泌物为实验对象, 研究根系分泌物对As污染土壤中砷酸还原菌TS28存活、 As还原能力的影响以及土壤酶活性的变化规律,为植物与微生物联合修复As污染土壤提供理论支持.
1 材料与方法
1.1 供试土壤的采集与制备
实验土壤取自吉林省某处农田未受As污染的表层(0~20 cm)黑土(记为NAs), 自然风干、 粉碎过2 mm筛网后储藏备用. 实验土壤的基本理化性质列于表1. 在实验土壤中加入砷酸钠溶液, 得到50 mg/kg的As污染土壤(记为As), 自然老化3个月, 风干, 粉碎过2 mm筛网后储藏备用.

表1 供试土壤的基本理化性质Table 1 Basic physical-chemical characteristics of test soils
1.2 根系分泌物的提取
油菜、 小麦和小白菜种子购自吉林省农科院种子站, 表面消毒后在潮湿条件下萌发. 按文献[12-14]方法从土壤中取出试管苗收集根系分泌物. 将收集的根系分泌物过0.45 μm滤膜, 过滤灭菌, 于-4 ℃储存. 用总有机碳分析仪(TOC-5050A型, 日本岛津公司)测定过滤后根系分泌物的质量浓度(以总有机碳质量浓度标定), 油菜、 小麦和小白菜根系分泌物的质量浓度分别为39.16,30.57,27.98 mg/L. 根据油菜根系分泌物的质量浓度确定本文中根系分泌物的研究质量浓度为39.16 mg/L[15].
1.3 菌株的标记与培养
选择实验菌株为具有As还原能力的细菌Stenotrophomonassp.TS28(由华中农业大学王革娇教授惠赠). 将保存在-70 ℃的细菌接种到3 mL LB液体培养基(酵母膏5 g/L, 胰蛋白胨10 g/L, 氯化钠5 g/L)中, 先在28 ℃, 250 r/min条件下培养25 h, 再在LB固体培养基中用0.1 g/L的利福平标记细菌[16]. 结果表明, 实验土壤中除TS28外的细菌不能在含0.1 g/L利福平的LB固体培养基上培养, 即计算的菌落形成单位(CFU)均来源于标记的TS28. 同时, 标记菌的生长曲线和对As(Ⅴ)的还原能力保持不变. 将标记细菌接种到液体培养基中, 用去离子水稀释, 制得接种剂(107CFU/mL, OD600nm=1).
1.4 细菌存活和As还原
分别将100 g的NAs和As土添加到塑料盆中, 每盆土壤按107CFU/g浓度接种, 标记为TS28, 实验期间每盆土壤接种1次. 接种结束后, 为模拟根系分泌物的持续释放, 每天添加根系分泌物至质量浓度为39.16 mg/kg, 共持续10 d. 将塑料盆转移到25 ℃、 相对湿度为70%的恒温培养箱中. 每24 h称取2份2 g土壤样品, 将1份土壤样品与5.0 mL,w=0.1%的蛋白胨缓冲液充分混合, 涡旋20 s, 2次,用含有利福平的LB培养基进行涂板和菌落计数. 从另一份土壤样品中提取As(Ⅲ)和As(Ⅴ), 用高效液相色谱-氢化物发生-原子荧光光谱法 (HPLC-HG-AFS, AFS-2202E型,北京海光仪器有限公司)分析测定[17]. 每种处理重复3次.
1.5 土壤酶活性测定
测定处理1,4,8 d土壤中酶的活性. 用靛酚蓝比色法测定脲酶活性[18]; 用磷酸苯二钠比色法测定酸性磷酸酶活性[19]; 用3,5-二硝基水杨酸比色法测定蔗糖酶活性[20]; 用对硝基苯磷酸二钠法测定脱氢酶活性[19].
1.6 统计分析
细菌存活数量的下降率可表示细菌在一段时间内的存活状态变化, 通过计算TS28存活数量的下降率分析其在培养时间内的存活能力. 下降率(η)的计算公式为
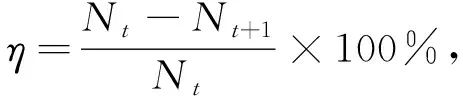
(1)
式中Nt为第t天的菌数,Nt+1为第(t+1)天的菌数.

lg(Nt/N0)=-(t/δ)p,
(2)
式中:t为培养时间(d);N0和Nt分别为0时刻和t时刻时的种群密度(CFU/mL);δ为细菌数第一次下降10倍所需时间;p为形状参数,p<1生存曲线上凸,p>1生存曲线下凹,p=1表示线性生存曲线.
用SPSS软件IBM SPSS Statistics 22.0处理数据, 所有图形均用Origin 2019软件绘制.
2 结果与讨论
2.1 根系分泌物对As污染土壤中TS28存活的影响
图1为As污染土壤中添加油菜、 小麦以及小白菜根系分泌物对砷酸还原菌TS28存活数量的影响. 由图1可见, 无论是否存在As污染, 砷酸还原菌TS28的存活量均随时间延长呈下降趋势. 与对照土壤相比, As污染土壤中TS28的存活数量随时间延长下降更快, 且二者呈显著差异(P<0.05). 在第7天的As污染土壤中,TS28的存活量相比对照土壤降低了38.64%,与文献[21-22]结果相似, 表明土壤中的As抑制了TS28的存活. 这是因为As(Ⅴ)作为一种磷酸盐类似物, 可取代影响三磷酸腺苷(ATP)合成的无机磷, 从而干扰能量的产生、 碳代谢以及核酸合成, 进而抑制了细菌的存活, 导致细菌数量显著下降[23].
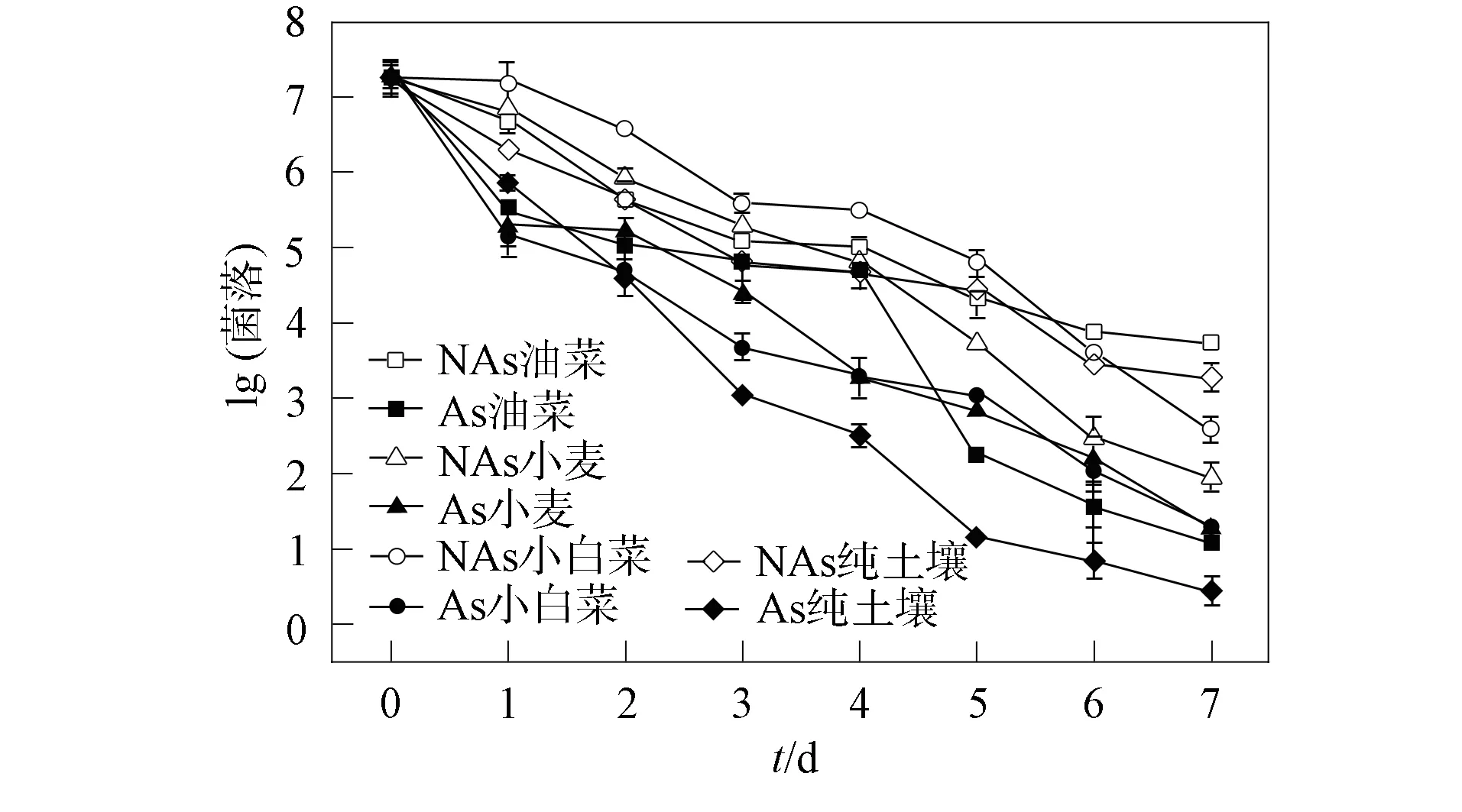
图1 根系分泌物存在下As污染 土壤中TS28的存活曲线Fig.1 Survival curves of TS28 in As contaminated soil in presence of root exudates
不同处理方法下As污染土壤中TS28的生存曲线拟合参数列于表2. 由表2可见, 添加不同根系分泌物后As污染土壤中TS28的δ=0.39~1.31. 表明在As污染土壤中添加不同根系分泌物导致TS28存活量降低一个数量级所用的时间不同, 可见不同根系分泌物对TS28存活的影响不同. 在根系分泌物存在下,TS28的p=0.60~1.06, 与As污染土壤存在差别. 表明添加根系分泌物后, As污染土壤中TS28存活曲线形状发生了较大改变. 添加根系分泌物后,TS28的存活时间为5.88~6.16 d, 均高于As污染土壤. 表明3种根系分泌物均可延长TS28的存活时间, 且3种根系分泌物对TS28存活时间的延长效果相差较小.
由表2和图1可见, 添加植物根系分泌物可刺激TS28的活性, 显著提高TS28在As污染土壤中的存活数量并延长其存活时间. 在第7天的As污染土壤中, 添加油菜、 小麦以及小白菜根系分泌物的TS28存活量分别是未添加根系分泌物的246.41%,285.74%,286.17%, 存活时间分别延长了29.23%,34.95%,35.38%. 主要是因为植物根系分泌物中含有大量的有机成分, 可为细菌提供必要和丰富的营养[24], 从而提高了TS28数量. 由于初始细菌数会影响细菌存活率[25], 因此TS28存活数量的下降率可用于评估细菌存活能力随培养时间的变化. 经计算, 在As污染土壤中添加油菜、 小麦和小白菜根系分泌物后, TS28的平均下降率分别为3.08%,3.00%,3.00%, 均低于不含根系分泌物As污染土壤中4.49%的下降率,且小白菜和小麦的根系分泌物比油菜的根系分泌物对TS28的活性有更强的促进作用.

表2 不同处理方法下As污染土壤中TS28的生存曲线拟合参数Table 2 Survival curve fitting parameters of TS28 in As contaminated soil under different treatments
2.2 根系分泌物对As污染土壤中As(Ⅴ)还原的影响
在As污染土壤中, 3种植物根系分泌物对TS28还原As(Ⅴ)的影响如图2所示. 由图2可见,在未添加TS28和根系分泌物的情形下, 土壤中的As(Ⅴ)在10 d内未被还原, 表明As污染土壤中的物质和微生物不能还原As(Ⅴ). 在添加TS28的As污染土壤中, As(Ⅲ)在土壤中的积累量随时间的延长呈先增加后逐渐趋于稳定的趋势. 前4 d, As(Ⅲ)的积累量达 8.84 mg/kg, 10 d内As(Ⅲ)的总积累量达10.03 mg/kg, 前4 d的还原量占总还原量的88.14%, 表明TS28可有效还原As(Ⅴ), 且As(Ⅴ)的还原主要发生在实验前期. 这是由于实验前期土壤中的TS28存活数量较大, 土壤中营养物质较多, 因此TS28对As(Ⅴ)的还原能力较强.
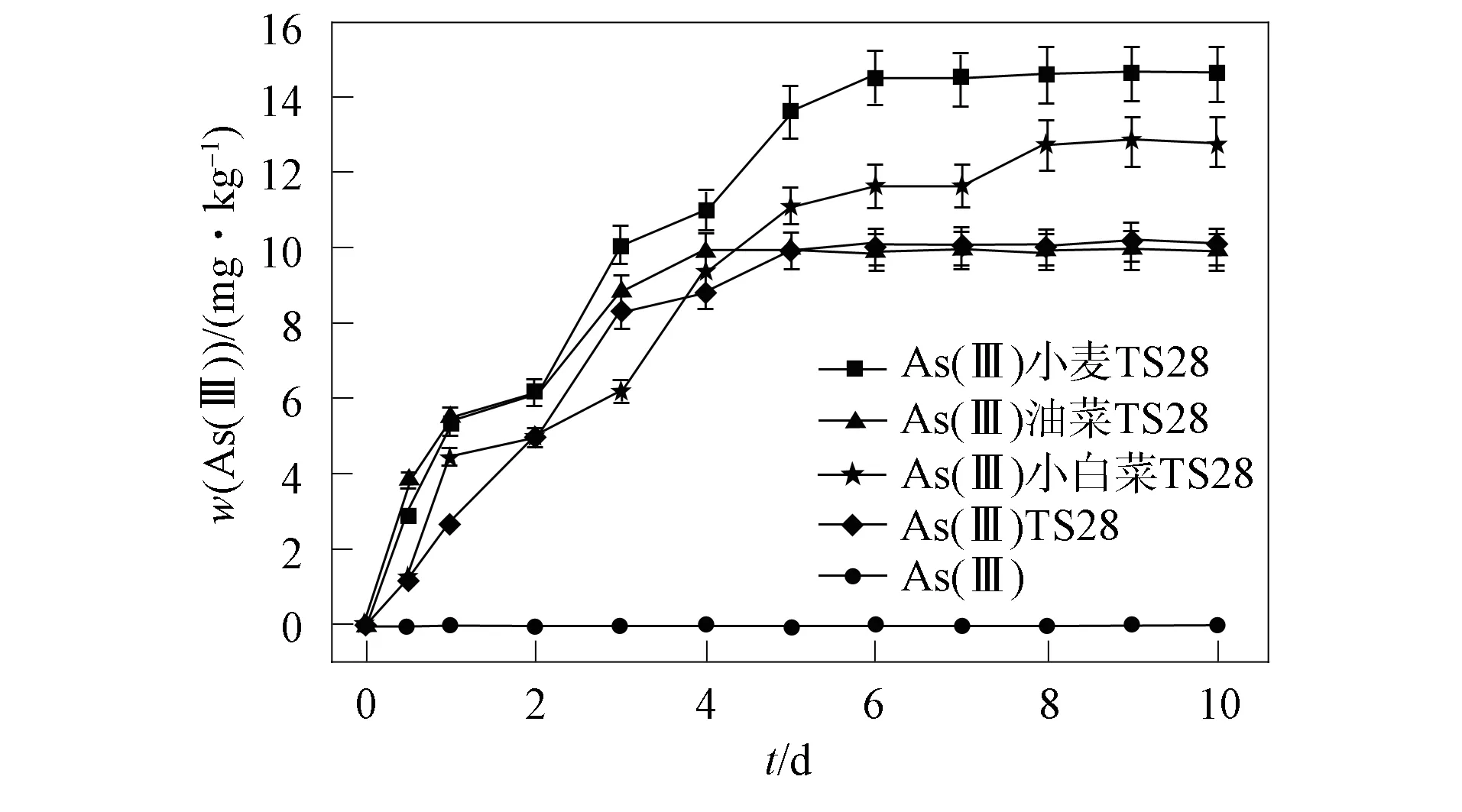
图2 根系分泌物存在下TS28对As(Ⅴ)还原的影响Fig.2 Effects of TS28 on As(Ⅴ) reduction in presence of root exudates
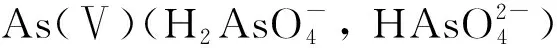
2.3 根系分泌物对As污染土壤中酶活性的影响
土壤酶是土壤中最活跃的有机成分之一, 代表土壤物质旺盛的能量代谢, 是与土壤肥力和生态环境质量相关的重要生物学指标[28]. 根系分泌物和TS28对土壤中酶活性的影响如图3所示. 由图3可见, 与未受As污染土壤相比, 无论是否添加TS28或根系分泌物, As污染土壤中的脲酶、 脱氢酶、 磷酸酶和蔗糖酶的活性均随时间延长而迅速下降, 表明As降低了土壤酶活性. 在仅含As污染土壤的处理组中,8 d内4种土壤酶活性分别下降67.42%,36.58%,32.62%,39.43%. 这可能是由于As与酶-底物复合物相互作用[29], 使酶蛋白变性或与蛋白活性基团相互作用降低了酶活性所致.

a. As纯土壤; b. As+TS28; c. As+小白菜; d. As+小麦; e. As+油菜; f. As+TS28+小白菜; g. As+TS28+小麦; h. As+TS28+油菜; i. NAs纯土壤; j. NAS+TS28; k. NAs+小白菜; l. NAs+小麦; m. NAs+油菜; n. NAs+TS28+小白菜; o. NAs+TS28+小麦; p. NAs+TS28+油菜. 图3 根系分泌物和TS28对土壤中酶活性的影响Fig.3 Effects of root exudates and TS28 on enzyme activities in soil
TS28处理使土壤中蔗糖酶和脱氢酶活性下降, 相比于As土壤组, 土壤中蔗糖酶和脱氢酶活性在第8天分别下降27.67%,13.23%, 对其他土壤酶活性影响较小. 生物体内的大多数氧化还原反应是由氧化还原酶(如脱氢酶)催化的. 添加TS28削弱了可能产生脱氢酶和蔗糖酶的细菌的存活优势, 从而抑制了这两种酶的活性. 此外, TS28对As(Ⅲ)的积累可能增强了As对微生物的毒害作用, 进而抑制了这两种酶的活性.
根系分泌物可缓解TS28和As对土壤酶的抑制, 增强酶活性. 与TS28处理组相比, 含有根系分泌物和TS28处理组的脲酶、 酸性磷酸酶、 蔗糖酶和脱氢酶的活性明显升高,其中油菜根系分泌物增强土壤酶活性的效果最好. 这主要是由于脲酶、 酸性磷酸酶和蔗糖酶是参与土壤中碳、 氮、 磷养分转化的几种主要酶[29], 而含有这些营养素的根系分泌物可诱导微生物更多地产生和释放这3种酶. 同时, 在土壤中对As胁迫耐性较强的细菌可能具有更强的利用碳、 氮、 磷养分的酶系统, 根系分泌物可刺激这些细菌分泌更多的酶抵抗胁迫. 此外, 由于脱氢酶在生物体内的能量供应中起重要作用, 因此, 根系分泌物可诱导生成脱氢酶的细菌产生更多的脱氢酶以抵抗As的胁迫. 根系分泌物中的有机碳可提高酶的抗分解能力和稳定性[9], 这可能也是根系分泌物提高脱氢酶活性的原因.
综上, 根系分泌物、 TS28和As对土壤酶活性的影响因酶的类型不同而不同. 土壤中酶的活性是土壤微生物、 pH、 有机质、 营养元素、 重金属等多种因素综合作用的结果.
3 结 论
1) 油菜、 小麦和小白菜的根系分泌物改变了TS28的存活模式, 可促进TS28的活性,其中小白菜根系分泌物对TS28活性有更强的促进作用.
2) 3种根系分泌物对TS28还原As(Ⅴ)能力的影响不同: 油菜根系分泌物前期促进了TS28对As(Ⅴ)的还原; 小麦和小白菜的根系分泌物在整个实验期间均不同程度地促进了As(Ⅴ)的还原; 3种根系分泌物中, 小麦根系分泌物的促进作用更强.
3) TS28降低了As污染土壤中蔗糖酶和脱氢酶的活性, 而对脲酶和磷酸酶活性几乎无影响; 添加根系分泌物提高了含TS28的As污染土壤中4种酶的活性, 其中油菜根系分泌物的促进效果最好.
