不同激素配比下杨树组培体系对比
2021-01-18王星斗王升级黄娟娟郭聪慧韩有志
王星斗,王升级,黄娟娟,樊 艳,郭聪慧,韩有志
(山西农业大学林学院,山西太谷030801)
杨树(Populus L.)属于杨柳科(Salicaceae)杨属(Populus)植物,是世界范围分布最广、适应性最强的树种之一,其被广泛应用于生态保护及工业用材等领域[1]。自 2004 年毛果杨(Populus trichoarpa)的全基因组序列被发表以来,杨树便成为研究林木分子育种的模式植物[2],而杨树的组织培养是杨树分子育种的重要前提。目前,越来越多的学者开始以杨树为研究材料进行转录因子等分子方面的研究,对转基因杨树在抗旱、抗盐碱和抗病虫害方面作出了很多贡献[3-6],使杨树组织培养环节在转基因前期显得尤为重要。
自20 世纪60 年代以来,杨树组织培养体系得到了迅速发展。1964 年,国外学者MAHTE[7]以三倍体美洲山杨(Populus tremuloides)茎段为外植体,通过愈伤组织诱导,获得了根和茎,但未获得完整的植株再生体系。1968 年,WOLTER[8]同样以三倍体美洲山杨为试验材料,在培养基中加入植物生长素,成功诱导出根。20 世纪70 年代,我国学者开始对杨树进行组织培养研究,1979 年,李春启等[9]以山新杨(Populus davidiana×Populus bollena)枝上的腋芽作为外植体,通过初代培养、继代培养及生根培养,最终获得了完整的植株,并被移栽到土壤中成活。2010 年,杨林娜等[10]以白杨新杂种I-101×84K杨为材料,通过优化腋芽最佳增殖培养基、最佳生根培养基,建立了其高效的再生体系。2015 年,马宁[11]以新疆杨(Populus bolleana Lauche)等 4 个品种作材料,建立了高效的再生体系。2019 年,孙红英等[12]以中红杨(Populus×euramericana 'zhonghong')组培苗的叶片为试验材料,分化不定芽,获得了完整的植株。至今,我国的杨树组织培养技术已经达到了一定的水平,很多学者建立了不同派系和不同树种的离体再生体系,为我国杨树组织培养及分子水平的研究奠定了一定的基础。然而,不同气候条件及地理区域导致不同激素配比条件下,杨树的组织培养体系存在较大差异。
为获得最适合山西省气候条件的杨树组织培养体系,本研究通过对比分析7 种杨树愈伤组织诱导培养基及6 种生根培养体系,旨在筛选出最适合愈伤组织诱导及根系组织分化的条件,为山西省乃至黄土高原地区杨树快繁及其分子育种提供理论依据与技术支撑。
1 材料和方法
1.1 试验材料
试验以生长状况良好的 84K 杨(Populus abla×Populus glandulosa)为材料。剪取山西农业大学林学院苗圃中生长状况良好的1 年生84K 杨枝条,用软毛毛刷在流动的自来水中刷干净枝条,以去除附着在外植体表面的浮尘和部分细菌,然后用洗衣粉水浸泡30 min[13],流水冲洗1 h[14];在超净工作台中用75%的酒精浸泡消毒20 s,用0.1%的升汞消毒5 min,用无菌水清洗5~6 次(以外植体无升汞残留为止);用无菌滤纸将水吸干,获得无菌外植体材料。将获得的外植体材料取带腋芽的茎段置于MS 培养基中接种扩繁,获得组培苗。
1.2 试验方法
1.2.1 培养基配制 生根组织诱导培养基分别以1/2 MS(蔗糖,20 g/L)和 MS(蔗糖,30 g/L)为基本培养基,加入不同配比激素,琼脂7.5 g/L,调节pH 值至5.8~6.0,煮沸,分装后在高压蒸汽灭菌锅中121 ℃灭菌30 min。生根培养基对比分析A~F 共6 种激素配比(表1),愈伤组织诱导培养基对比分析A~G 共 7 种激素配比(表 2)。
1.2.2 愈伤组织诱导试验 取4~6 周苗龄的组培苗,于超净工作台中除顶芽外剪切第3~6 片叶片,去掉叶片的尖端和叶柄,在主叶脉用无菌手术刀划长为1~2 cm 的创口,将叶片接种于愈伤组织诱导培养基上(表 2),置于(24±1)℃、光暗周期 16 h/8 h、光照强度2 000 lx[15]的温室内培养。每组愈伤组织试验设4 个重复,每个重复接种5 片叶片。
1.2.3 生根培养试验 取4~6 周苗龄1.1 获得的组培苗,于超净工作台中将其顶芽接种于生根培养基中(表 1),置于温度为(24±1)℃、光周期为 16 h/8 h(光/暗)、光照强度为2 000 lx 的温室内培养。每组生根试验设置5 个重复,每个重复接种2 株幼苗。
1.2.4 炼苗试验 生根培养40 d,将组培苗取出,在流水下洗净根部附着的培养基[16],去掉除顶端2~3 片外所有叶片,进行水培,设置水培时间分别为 5、7、10、15、20 d;之后将幼苗移栽至无菌土壤基质中,观察其生长情况。
1.3 测定项目及方法
1.3.1 生长指标测定 生根培养40 d 后,将植株从培养瓶中取出,在流水下轻柔地洗净根部附着的培养基,测定植株株高和主根长。将植株根、茎、叶分别收集至恒温干燥箱中,于105 ℃杀青15 min,85 ℃持续烘干至恒质量,测定生物量。
1.3.2 淀粉和可溶性糖含量的测定 将植株根、茎、叶混合,在研钵中研磨至无明显大颗粒物,过0.149 mm 筛2 次,使所有材料充分粉碎混合,使用硫酸蒽酮比色法测定植株淀粉含量和可溶性糖含量[17-18]。
1.4 数据统计
所有数据均平行测定3 次,采用Photo Shop CS6 软件制图;采用IBM SPSS Statistics 25 软件进行分析,显著性分析采用ANOVA(邓肯氏)多重差异分析方法(P<0.05)。
2 结果与分析
2.1 愈伤组织诱导情况分析

表3 不同激素浓度处理诱导愈伤组织生长情况分析
84K 杨叶片不同激素浓度培养基愈伤组织诱导情况显示,A1 组培养基接种叶片卷曲严重,愈伤组织呈现赤红色,分化程度较高,不定芽叶缘呈红色,不定芽数最少;B1 组培养基接种叶片发黄,间白披绿,愈伤组织呈现淡红色,不定芽叶尖呈红色,其不定芽数偏少;C1 组培养基接种叶片卷曲呈现鲜绿色,愈伤组织呈红褐色,不定芽嫩绿,且不定芽出芽数偏多;D1 组培养基接种叶片呈黄绿色,愈伤组织呈淡黄色,不定芽泛红,不定芽叶尖呈红色,其不定芽出芽数较少;E1 组培养基接种叶片呈绿色,且高度分化,愈伤组织呈红褐色,不定芽叶尖泛红,其不定芽出芽数较多;F1 组培养基接种叶片呈黄绿色,叶缘泛红,愈伤组织呈褐色,不定芽叶尖发红,其不定芽出芽数最高;G1 组培养基(MS 对照组)接种叶片黄绿发白,无愈伤组织诱导,叶片均被诱导生根(表3)。
2.2 生根培养情况分析
2.2.1 诱导生根情况 生根诱导培养7 d 结果表明(表4),A 组培养基生根数最少;B 组培养基生根数最多;C、D、E、F 各组生根数之间差异不明显。
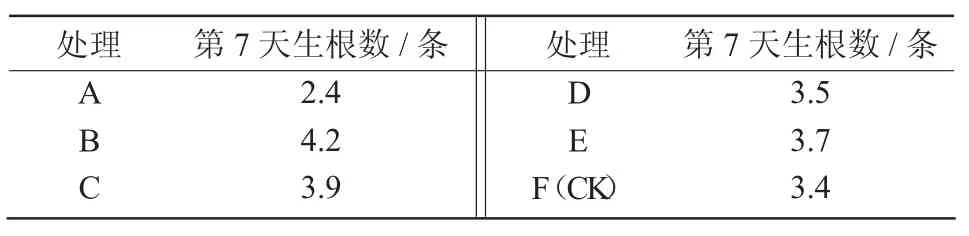
表4 不同激素浓度处理诱导生根情况分析
生根诱导培养15 d,A 组培养基生根较快,主根粗壮但数量不多,幼苗叶片膨大,植株开始拔高生长;B 组培养基一级根较多但细,侧根等二级根数量很少,呈放射状分布,叶片膨大但无A 组明显,植株拔高生长;C 组培养基主根生长缓慢但粗壮,在主根周围开始萌生侧根,植株未拔高生长;D 组培养基根系生长情况与C 组相似,培养15 d 根系生长最慢,但主根粗壮;E 组培养基根系生长情况均衡良好,培养15 d 植株生长较好,根系生长情况较均衡;F组培养基(对照组)生根较快但是根系瘦弱,主根细长,培养 15 d 植株较 C、D 组高,幼苗瘦弱(图 1)。

2.2.2 生长指标分析 生根培养40 d 后,对比分析不同激素配比植株生长情况可知,E 组培养基的株高最大,为 10.34 cm,D 组最小,为 8.50 cm,但各组间差异并不显著;A 组培养基处理的主根最长,为 24.04 cm,显著大于 C、D、E、F 组处理(表 5)。
生长情况分析结果表明,A 组植株生长情况较好,侧根较多且延长根生长较快,植株较为粗壮;B组植株根系较为健壮,而且延长根居多;C 组植株粗壮矮小,根系发达且呈放射状分布,推测其生长可能受到了高浓度生长激素的抑制;D 组植株与C组类似,根系较为发达且呈放射状生长;E 组各方面生长情况比较均衡,叶片翠绿膨大,而且植株高、通直,根系较为粗壮;F 组(CK)植株较高而且笔直,通体瘦弱,叶片枯黄,根较长且纤细,生长情况不佳(图 2)。

表5 不同激素处理40 d 苗龄生长量和根长分析 cm
2.2.3 生物量分析 生物量分析结果表明(表6),A 组的根、茎、叶平均干质量在所有诱导生根处理中较为良好,而且平均叶干质量较高,说明A 组激素浓度在促进根部生长的同时,也促进了地上部茎叶的生长;B 组叶平均干质量最高,茎平均干质量较高,情况与A 组类似;C 组根平均干质量较高,茎、叶平均干质量在各组中最高,可见,虽然C 组生长缓慢,但是生物量积累的量比较高;D 组根平均干质量最高,但茎、叶平均干质量最低,说明D 组地下部分的生长情况较地上部分要好;E 组植株生长情况一般,根、茎、叶平均干质量都略小于A 组;F组(CK)植株通体瘦弱,根部生长不健壮,植株整体情况最差。
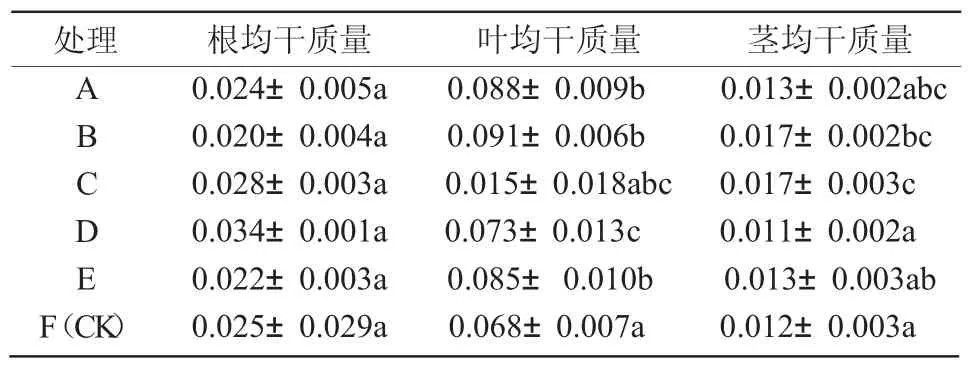
表6 不同激素浓度处理40 d 苗龄根、茎、叶干质量分析 g
2.2.4 不同激素浓度处理植株可溶性糖和淀粉含量分析 从表7 可以看出,A 组的可溶性糖含量最高,可知其进行光合作用在各组中较强,可能是由于A 组生长情况良好,平均叶面积较大,其体内叶绿素含量较多,所以糖的合成量较大,且A 组淀粉含量较高,说明其细胞质基质中的Pi(磷酸基团)浓度较低,使淀粉在叶绿体中大量积累,该组激素配比最适合84K 杨生根诱导;B 组可溶性糖含量较低,且淀粉含量也较低,说明其体内叶绿素含量较低,多数有机物被消耗用于其他生理途径;C 组淀粉和可溶性糖含量与B 组类似,但其根系较为茂盛,其光合产生的能量全部用来供给根、茎、叶的发育;D 组可溶性糖含量在各组中最低,淀粉含量最高,说明其生长过程中干物质的量积累大于生长发育,植株健壮;E 组可溶性糖和淀粉含量均略低于A 组,说明生长发育情况较 A 组略差;F 组(CK)可溶性糖含量略高,但淀粉含量在各组中最低,且植株瘦弱,叶片发黄,植株生长发育情况最差。
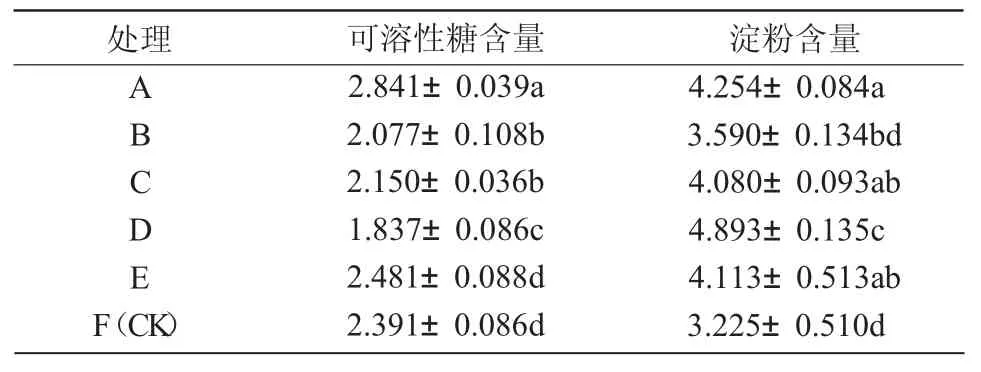
表7 不同激素浓度处理40 d 苗龄可溶性糖和淀粉含量分析 %
2.3 炼苗情况分析

表8 不同水培时间处理植株生长情况分析
炼苗试验结果显示(表8),水培5 d 后移栽至土壤基质中的植株生长情况差,由于水培时间太短,植株没有适应外界环境条件且未生出新的根系,过早地接触基质使植株难以适应,影响其存活;水培7 d 后,植株根部有新生一级根长出,移栽至土壤基质后植株生长状况不佳,说明植株根部发育不够健全;水培10 d 后,植株生长情况良好,新的根系开始生长,有利于植株适应新的环境,移栽至土壤基质后植株生长状况较好、生长速度较快;水培15 d 后,植株根部发育良好,有大量的二级根生成,且移栽至土壤基质后生长速度最快,植株叶片鲜绿,长势最好;水培20 d 后,有大量新的一、二级根生成,但是植株茎部开始木质化,叶片变老,移栽至土壤基质后植株生长较15 d 慢。因此,可以推测炼苗最适水培时间为(15±1)d;之后将植株移栽至草炭∶蛭石∶珍珠岩=1∶1∶1 的基质中培养[19],待植株高度生长至30~50 cm 后便可移栽到苗圃中。
3 结论与讨论
在植物组织培养过程中,适当的植物生长调节剂对于培养植株的优良性状以及相关的遗传转化很有必要。杨树组织培养基中常用的生长素有2,4-D、NAA、IAA、IBA,能促进细胞伸长和分裂,常用于幼苗生根,与细胞分裂素配合用于不定芽诱导和增殖培养。6-BA、KT、TDZ 等细胞分裂素能够促进细胞分裂分化,常用作诱导腋芽及不定芽的形成。除生长素与细胞分裂素外,其他植物生长调节物质对植物生长也有一定的影响,如赤霉素和脱落酸等。不同配比植物生长调节剂,对于植株不同部位的生长会有不同的促进或抑制作用,可根据不同培养需求配置植物生长调节剂的含量[20]。
近年来,关于杨树组织培养体系建立及优化的研究较多,但是不同气候条件及地理区域条件下,杨树组织培养体系存在较大差异。山西省位于黄土高原地区,全省气候冬季较长且寒冷干燥,夏季炎热雨水集中,春季气候多变且风沙较多,秋季短暂且昼夜温差大。为筛选最适合山西省气候条件的杨树组织培养体系,本试验对比分析了7 种杨树愈伤组织诱导培养体系及6 种生根培养体系,结果表明,最适84K杨叶片诱导愈伤组织的培养基为MS+0.05 mg/L NAA+0.08 mg/L TDZ,愈伤组织的生长较慢,一般接种到诱导培养基上7 d 才开始长出愈伤组织。通过多次试验发现,一般出现愈伤的部位都在叶片创口处的叶脉上,因此,若想得到较多的愈伤组织,对叶片的多创口进行处理是必要的。通过愈伤组织诱导产生腋芽,将其接种到生根诱导培养基中诱导其生根,可以进一步得到优质的植株。在植物组织培养过程中,培养环境也会在一定条件下影响植物组织的形态和发育[21]。本研究通过试验得出,在植物叶片的愈伤组织诱导过程中所产生的褐化大多是由于在用接种器械对叶片做切割和创口处理时,过多地破坏了叶面的细胞,因此,在处理叶片时应小心处理。最适84K 杨的生根诱导培养基为1/2 MS+0.1 mg/L IBA+0.01 mg/L NAA。玻璃化苗是由植物在组织培养过程中水分摄入过多引起的,可以通过控制外界的环境条件包括通风处理、适当提高培养室温度、加强光照、调节培养基pH、适当提高培养基中凝固剂含量以及适当提高蔗糖浓度等来降低植物在组织培养过程中产生的玻璃化苗现象[22]。此外,组织培养过程中特别需要注意外植体和接种器械的灭菌消毒以及无菌规范操作,只有保证规范操作和器械消毒,才能使后续的植物组织培养试验顺利进行。
在炼苗过程中需要注意,水培过程中须保证环境空气湿度在60%~70%,这样的环境更有利于幼苗发育和生根;且生根移栽的过程中使用无菌基质幼苗成活率较高,若基质不进行灭菌处理,会有害虫大量繁殖,影响植株正常生长发育。另外,有研究表明[23],在炼苗过程中水培培养基中加入适量植物激素更有利于植物幼苗的生长发育。
