雨生红球藻对菲律宾蛤仔肥满度和多酚氧化酶的影响
2021-01-17李翔宇吴琳窦勇黄莹翟胜利周文礼
李翔宇 吴琳 窦勇 黄莹 翟胜利 周文礼

摘 要:为研究饲料中添加雨生红球藻对菲律宾蛤仔生长特性的影响,根据饵料中雨生红球藻与螺旋藻的比例设置5个梯度处理,分别为1∶9,3∶7,5∶5,7∶3,9∶1,投喂菲律宾蛤仔两周,监测各处理菲律宾蛤仔的肥满度及肝脏中多酚氧化酶(PPO)活性。结果表明,雨生红球藻与螺旋藻为5∶5的处理菲律宾蛤仔肥满度显著高于其他处理(P<0.05),而9∶1的处理显著低于其他处理(P< 0.05);雨生红球藻与螺旋藻为5∶5的处理菲律宾蛤仔PPO活性最高,其次是7:3的处理,二者显著高于1∶9的处理(P<0.05)。综合而言,菲律宾蛤仔的饵料中添加适量雨生红球藻粉有助于其生长及免疫性能提高,饵料中其与螺旋藻的比例5∶5为宜。
关键词:菲律宾蛤仔;雨生红球藻;肥满度;多酚氧化酶
中图分类号:S963.22 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2021.12.005
Effects of Haematococcus Pluvialis on Plumpness and Polyphenol Oxidase of Philippine Clam
LI Xiangyu1, WU Lin1, DOU Yong1, HUANG Ying1, ZHAI Shengli1, ZHOU Wenli1
(1.Tianjin Key Laboratory for Aquaculture Ecdogy and Cultivation Fisheries College,Tianjin Agricultural University, Tianjin 300384, China;2.Tianjin Modern Chenhui Technology Group,Tianjin 301802,China)
Abstract: In order to study the effects of Haematococcus pluvialis on the growth characteristics of Philippine clam, the experiment set 5 gradient treatments basing on the proportion of Haematococcus pluvialis and Spirulina in the diet, which included 1∶9, 3∶7, 5∶5, 7∶3, and 9∶1. The Philippine clam was fed with the different treatment diets for two weeks, the plumpness and polyphenol oxidase (PPO) activity in liver of Philippine clam were monitored. The results showed that the clam's plumpness was significant higher than the other treatments when the ratio of Haematococcus pluvialis to Spirulina was 5∶5(P<0.05), and the Philippine clam's plumpness was significant lower than the other treatments when the ratio of Haematococcus pluvialis to Spirulina was 9∶1 (P<0.05). The PPO activity of Philippine clam were highest when the ratio of Haematococcus pluvialis to Spirulina was 5∶5, followed by the treatment of 7∶3, which the two treatments were significantly higher than the other treatment(P<0.05). In conclusion, adding appropriate amount of Haematococcus pluvialis in the diet of Philippine clam could approve the growth and specific immunity of Philippine clam, which the optimum ratio of Haematococcus pluvialis to Spirulina in the diet should be 5∶5.
Key words: Ruditapes philippinarum;Haematococcus pluviali;Plumpness;polyphenol oxidase
收稿日期:2021-08-04
基金項目:天津市企业科技特派员项目(20YDTPJC01470); 天津市水产生态及养殖重点实验室开放基金项目(TJAE201805);自然资源部海洋生态动力学重点实验室开放基金项目(MED202013);天津市宝坻区农业科技计划重大项目(201810);天津市科技局生态环境治理重大专项(18ZXSZSF00080); 天津市农业科技成果转化与推广项目(202001010)
作者简介:李翔宇(1996—),男,山西大同人,在读硕士生,主要从事生物饵料开发与应用方面研究。
通讯作者简介:窦勇(1985—),男,山东淄博人,讲师,博士,主要从事微藻生理生态方面研究。
菲律宾蛤仔(Ruditapes philippinarum)属于软体动物门双壳纲,营养价值高,肉质鲜美,含有许多人体必需的微量元素[1]。菲律宾蛤仔作为我国主要的海洋经济贝类之一,经济价值高,生长迅速,繁殖周期短,适应性较强,适合人工高密度养殖[2]。
我国是世界第一渔业大国,由于水产养殖的集约化发展,水生动物疾病多发。病害发作已成为制约菲律宾蛤仔产业的重要因素[3]。目前主要通过在水产动物的饲料中直接添加可食用的添加剂,以此来改善水产动物发育周期,提高抗病能力。虾青素(Astaxanthin)作为一种生物活性物质和天然色素,近年来受到了极大的关注,其最大的市场是作为饲料添加剂,应用到鱼虾蟹等水生动物的饲料中[4]。虾青素着色效果良好,可以进入生物体并贮存在生物体组织中,使得某些动物的肌肉组织和皮肤呈现出光鲜亮丽的颜色(如红鳝鱼、锦鲤等),因此天然虾青素被我国农业部指定为水产动物的唯一着色剂[5]。同时,虾青素在预防和治疗鱼类,虾和蟹等的疾病中也起着重要作用,一方面可以提高动物的免疫力和动物的存活率,对动物良性的生长、繁殖与存活具有重要的作用,另外,相关研究表明在饲料中添加不同剂量的虾青素可以明显提高动物细胞中抗氧化酶如过氧化物酶和超氧化物歧化酶的生物活性,起到较好的抗氧化作用[6]。
雨生红球藻(Haematococcus pluvialis)是一种富含虾青素的单细胞藻,是大自然中天然虾青素含量最高的生物,被公认为获取天然虾青素最佳生物来源,可作为抗氧化剂和着色剂食用,亦可作为蛋白质替代品,对水生动物的生长发育有积极的影响。郭春雨[7]研究表明,饲料中添加虾青素可以提高河蟹生长存活率,抗氧化能力和免疫性能,促进卵黄蛋白积累;也有研究表明,在饲料中添加少量的雨生红球藻可以改善虹鳟鱼的生长指数和免疫系统[8]。张宝龙等[9]研究中发现,饲料中添加一定量的雨生红球藻可以显著促进红草金鱼的生长和免疫;还有研究结果表明,雨生红球藻还可以改善七彩神仙鱼的生长率和增重率[10]。同时,在龙晓文等[11]研究中,饲料中添加雨生红球藻粉可以提高中华绒螯蟹的性腺粗蛋白和肌肉总多不饱和脂肪酸以及头胸甲中类胡萝卜素的含量。由此可见,在饲料中添加雨生红球藻对水生动物的生长发育和免疫中起重要作用。
本试验以菲律宾蛤仔为研究对象,研究饵料中添加不同量雨生红球藻对菲律宾蛤仔的生长特性、肥满度和肝脏中抗氧化酶PPO活性的影响,以及添加适量的雨生红球藻对菲律宾蛤仔的肥满度和多酚氧化酶的影响,旨在更加精确地探讨添加雨生红球藻的最适剂量,为菲律宾蛤仔的繁育和养殖提供参考。
1 材料和方法
1.1 试验材料与设备
1.1.1 试验试剂 多酚氧化酶(PPO)试剂盒购于南京建成生物工程研究所。
1.1.2 试验蛤仔及养殖条件 菲律宾蛤仔(R. philippinarum)选自天津市大神堂南部浅海区域,挑选无破损的个体,平均壳长(3.7±0.15) cm。用海水冲洗干净,在实验室养殖槽(490 mm×320 mm×145 mm)中暂养24 h。饲养期间,盐度2.5%,温度(20±0.5) ℃,养殖期间连续曝气,光照周期为12 h/12 h,期间换水1次,适应后进行分组试验。
1.1.3 试验饵料 雨生红球藻粉虾青素含量为5%。
1.2 试验方法
1.2.1 饵料的制备 按照雨生红球藻:螺旋藻=1∶9,3∶7,5∶5,7∶3,9∶1的比例进行分组混合,对照组只投喂螺旋藻粉,每次投喂总量为0.03 g。
1.2.2 分组养殖 选出780粒蛤仔进行分组,每个养殖水槽中放养130粒。每天换水两次(9:00和21:00),投喂饵料2次(8:00和20:00)。每隔3 d测定一次菲律宾蛤仔的壳长、壳宽、壳高、软体湿质量和组织中的PPO活力值。
1.3 测定指标
1.3.1 生长指标的测定 用游标卡尺(精确到0.01 mm)测量菲律宾蛤仔的壳长、壳宽、壳高等生态学数据,然后用电子天平(精确到0.1 g)称质量。
1.3.2 肥满度的测定 取其中25个进行生长指标的测量,将表面游离的水分用吸水纸吸干,用剪刀剪开贝壳,用镊子将软体部取出,然后用吸水纸吸干表面游离水分并称质量,置于80 ℃的恒温干燥箱中烘干12 h以上至恒质量,称质量。
肥满度[12]=[WFM/(L×W×H)]×105
1.3.3 PPO活性的测定 取3粒蛤仔的肝脏,称量,按照质量(g)与体积(mL)比为1∶5加入提取液,冰浴匀浆,转速8 000 r·min-1,离心10 min,依照试剂盒说明测定PPO活性。
PPO活力(U·g-1鲜质量)=×××÷反应时间(min)
1.4 数据处理与分析
试验数据采用平均值±标准差表示,使用SPSS 25.0进行单因素方差分析,Duncan法进行多重比较,显著性水平设为P<0.05。
2 结果与分析
2.1 肥满度
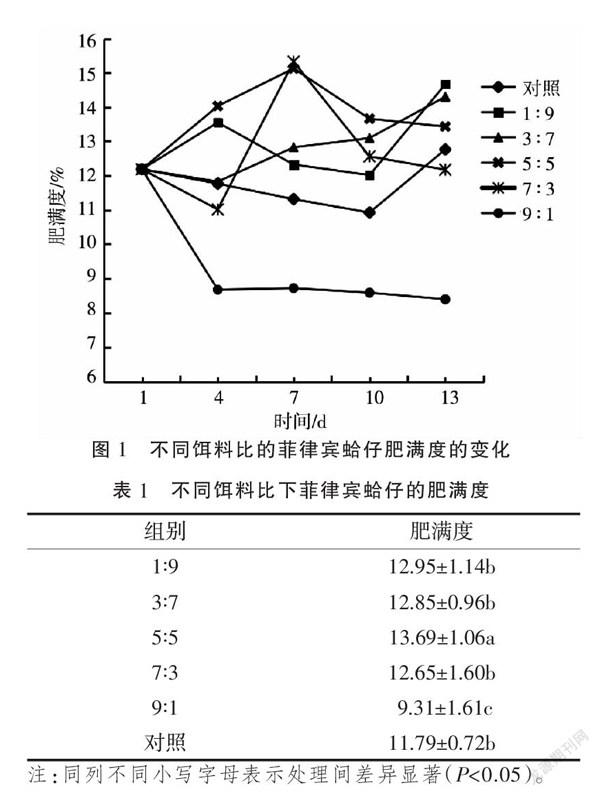
由图1可知,随着养殖天数增加,雨生红球藻与螺旋藻比5∶5处理菲律宾哈仔肥满度呈先增加后降低的趋势且4~13 d肥滿度均高于1 d,1∶9处理肥满度呈升-降-升的趋势,其中4,13 d肥满度高于1 d,3∶7处理肥满度呈先略有下降后持续增加的趋势,其中7~13 d肥满度均高于1 d,7∶3处理肥满度呈降-升-降的趋势,其中7 d肥满度高于1 d,9∶1处理肥满度呈持续下降的趋势,对照组肥满度呈先下降后上升的趋势,其中13 d肥满度高于1 d。将图1中5次取样肥满度作为重复,对各处理数据进行方差分析,结果(表1)表明,雨生红球藻与螺旋藻比例为9∶1的菲律宾蛤仔的肥满度显著小于其它组别,而雨生红球藻与螺旋藻比例为5∶5的肥满度显著高于其他组。由此可见,适宜雨生红球藻与螺旋藻配比的饵料有助于菲律宾哈仔肥满度的增加,以5∶5效果最佳。2.2 PPO活力
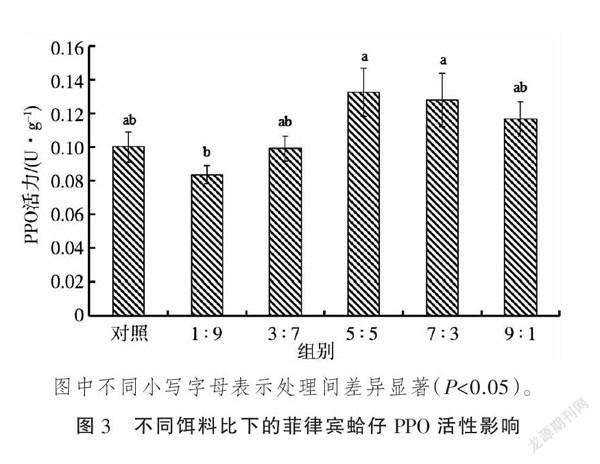
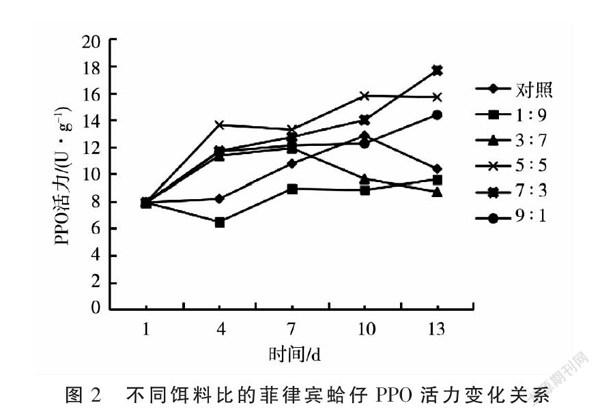
由图2可知,随着养殖天数的增加,雨生红球藻与螺旋藻比为5∶5,7∶3,9∶1处理的菲律宾蛤仔PPO活力均呈增加趋势,对照和3:7处理PPO活力呈先升高后降低的趋势且4~13 d PPO活力均高于1 d,1∶9处理PPO活力呈先降低后升高的趋势。将图2中5次取样PPO活性作为重复,对各处理数据进行方差分析,结果(图3)表明,雨生红球藻与螺旋藻比为1∶9的菲律宾蛤仔PPO活力值最低,显著低于雨生红球藻与螺旋藻比为5∶5和7∶3的处理,后二者之间差异不显著。由此可见,适宜雨生红球藻与螺旋藻配比的饵料有助于提高于菲律宾蛤仔PPO活力,其中以5∶5和7∶3效果较好。
3 结论与讨论
贝类常用肥满度(肥满指数)来衡量肉质的肥瘦程度,肥满度也成为条件指数(Index of condition)[12]。相关研究[13-15]表明,肥满度与养殖密度、繁殖期、水温有着极为密切的关系。本研究中,在菲律宾蛤仔饵料中添加雨生红球藻藻粉,对于菲律宾蛤仔肥满度具有显著影响,其添加量过高或过低均不利于菲律宾哈仔肥满度的增加,其中以二者配比5∶5最佳。雨生红球藻对菲律宾哈仔肥满度的影响可能与其含有虾青素有关。虾青素作为饲料添加剂,对许多水生动物的生长有重要影响[16-18]。黄璞仪等[10]研究表明,虾青素对彩色神仙鱼的增重率和生长率有显着影响。
在一些哺乳动物上的结果也表明,虾青素在机体营养和健康方面具有积极的调控作用[19-20]。虾青素除了本身就具有抗氧化作用外,也对机体的抗氧化酶系统有重要的调节作用[21-23],以提高水生动物对环境胁迫的适应性。龙晓文等[11]研究中发现饲料中添加虾青素可显著提高中华绒螯蟹的CAT活性。韩星星等[24]研究发现,大黄鱼肝脏T-SOD活性随着虾青素添加水平的加大而显著上升。多酚氧化酶(Polyphenol oxidaes)是大多数贝类先天免疫防御系统中的重要酶[25]。有研究表明,无脊椎动物中黑色素的含量与免疫能力有关[26-27]。双壳软体动物中PPO可以被诱导,这种激活过程通常是由病原体模式识别受体(PRR)触发的[28]。近年来,有报道显示南美白对虾的PPO活性[29-31]已被研究用于抑制南美白对虾的变黑。也有研究表明,用弧菌刺激菲律宾蛤后,其血淋巴多酚氧化酶活性也显着提高[32-33]。本研究中,在菲律宾蛤仔的饵料中适当添加雨生红球藻藻粉对菲律宾蛤仔的PPO活性有一定影响,其添加量过高或过低均不利于菲律宾蛤仔PPO活性的增加,其中当雨生红球藻与螺旋藻比为5∶5的菲律宾蛤仔PPO活力值最高,其次是7∶3处理。
综合雨生红球藻添加比例对菲律宾蛤仔肥满度和PPO活性的影响,以饵料中雨生红球藻与螺旋藻的比例为5∶5为宜,菲律宾蛤仔的肥满度与PPO活性均可达到最高值。但考虑到本试验饲喂周期(2周)相对较短,未来可以进一步加长投喂时间,在现有的投喂基础上,进一步设计投喂梯度,以便更加精确地探讨添加雨生红球藻的最适剂量。
参考文献:
[1] 徐津, 李连军, 杨最素, 等. 菲律宾蛤仔提取物及生物活性的研究进展[J]. 浙江海洋学院学报, 2013, 32(4): 357-360.
[2] CHIESA S, MARZANO F N, MINERVINI G, et al. The invasive Manila clam Ruditapes philippinarum(Adams and Reeve, 1850) in Northern Adriatic Sea: Population genetics assessed by an integrated molecular approach[J]. Fisheries Research,2011,110(2):259-267.
[3] 费来华, 邵雁群. 栉孔扇贝不同组织SOD, CAT和MPO活力的比较分析[J].海洋湖沼通报, 2008(3): 128-132.
[4] 肖素荣, 李京东. 虾青素的特性及应用前景[J]. 中国食物与营养, 2011, 17(5): 33-35.
[5] 中华人民共和國农业部.中华人民共和国农业部公告:第318号[EB/OL]. (2003-12-09)[2021-08-02]. https://www.doc88.com/p-9631902468703.html?r=1
[6] 陈峰, 姜悦. 微藻生物技术[M]. 北京: 中国轻工业出版社, 1999.
[7] 郭春雨. 虾青素对中华绒螯蟹的影响及作用机理[D]. 保定: 河北大学, 2011.
[8] SHEIKHZADEH N, TAYEFI-NASRABADI H, OUSHANI A K, et al. Effects of Haematococcus pluvialis supplementation on antioxidant system and metabolism in rainbow trout (Oncorhynchus mykiss)[J]. Fish Physiology and Biochemistry, 2012, 38(2): 413-419.
[9] 张宝龙, 曲木, 窦艳君, 等. 饲料中不同着色剂对红草金鱼生长、体色及免疫力的影响[J]. 饲料研究, 2017(13): 36-44.
[10] 黄璞袆, 贾铭宇, 刘涛, 等. 虾青素对七彩神仙鱼生长和形体的影响[J]. 吉林农业C版, 2011(3): 93-94.
[11] 龙晓文, 赵磊, 麻楠, 等. 饲料中添加雨生红球藻粉对中华绒螯蟹成体雄蟹生化组成的影响[J]. 动物学杂志, 2018, 53(2): 278-291.
[12] 张福绥, 何义朝, 刘祥生, 等. 胶州湾贻贝肥满度的研究[M]//贝类学论文集, 北京: 科学出版社, 1986: 80-88.
[13] 孙虎山, 王宜艳. 芝罘湾长竹蛏肥满度的研究[J]. 海洋湖沼通报, 1995, 16(3): 63-68.
[14] 李永仁, 刘利华, 陈丽梅, 等. 天津海域菲律宾蛤仔肥满规律研究[J]. 天津农业科学, 2015, 21(2): 14-16, 39.
[15] 王宜艳, 孙虎山, 王为纲, 等. 养马岛紫彩血蛤肥满度的研究[J]. 海洋通报, 1997, 16(6): 27-30.
[16] PAN C H, CHIEN Y H, CHENG J H. Effects of light re-gime, algae in water, and dietary astaxanthin on pigmentation, growth, and survival of black tiger prawn Penaeus monodon post-larvae[J]. Zoological Studies, 2001, 40(4): 371-382.
[17] MENASVETA P, WORAWATTANAMATEEKUL W, LATSCHA Y, et al. Correction of tiger prawn (Penaeus monodon Fabricus) coloration by astaxanthin[J]. Aquacultural Engineering, 1993, 12(4): 203-213.
[18] LEE S H, MIN D B. Effects, quenching mechanisms, and kinetics of carotenoids in chlorophyll-sensitized photooxidation of soybean oil[J]. Journal of Agricultural and Food Chemistry, 1990, 38(8): 1630-1634.
[19] VARADY K A, WANG Y, JONES P J. Role of policosanols in the prevention and treatment of cardiovascular disease[J]. Nutrition Reviews, 2003, 61(11): 376-383.
[20] 王吉桥, 樊莹莹, 徐振祥, 等. 饲料中β胡萝卜素和虾青素添加量对仿刺参幼参生长及抗氧化能力的影响[J]. 大连海洋大学学报, 2012, 27(3): 215-220.
[21] BERTRAM J S, VINE A L. Cancer prevention by retinoids and carotenoids: independent action on a common target[J]. Biochimica et Biophysica Acta-Molecular Basis of Disease, 2005, 1740(2): 170-178.
[22] KUMLU M, FLETCHER D J, FISHER C M. Larval pigmentation, survival and growth of Penaeus indicus fed the nematode Panagrellus redivivus enriched with astaxanthin and various lipids[J]. Aquaculture Nutrition, 1998, 4(3): 193-200.
[23] SUGUMARAN M. Roles of the insect cuticle in host defence reactions[J]. New Directions in Invertebrates Immunology, 1996(84): 355-374.
[24] 韩星星, 王秋荣, 叶坤, 等. 叶黄素和虾青素对大黄鱼体色及抗氧化能力的影响[J]. 渔业研究, 2018, 40(2): 104-110.
[25] LUNA-ACOSTA A, BREITWIESER M, RENAULT T, et al. Recent findings on phenoloxidases in bivalves[J]. Marine Pollution Bulletin, 2017, 122(1/2): 5-16.
[26] ROLFF J, SIVA-JOTHY MT. Invertebrate ecological immunology[J]. Science, 2003, 301(5632): 472-475.
[27] SÖDERHÄLL K, CERENIUS L. Role of the prophenoloxidase-activating system in invertebrate immunity[J]. Current Opinion in Immunology, 1998, 10(1): 23-28.
[28] ALADAILEH S, NAIR S V, RAFTOS D A. Induction of phenoloxidase and other immunological activities in Sydney rock oysters challenged with microbial pathogen-associate molecular patterns[J]. Fish & Shellfish Immunology, 2007, 23(6): 1196-1208.
[29] 段秀霞, 施文正, 邱偉强, 等. 南美白对虾多酚氧化酶的提取及其性质研究[J]. 广东农业科学, 2017, 44(3): 136-142.
[30] 孙江萍, 赵莉, 俞文英, 等. 酸性电解水对南美白对虾中多酚氧化酶活性的影响[J]. 食品科学, 2018, 39(9): 7-12.
[31] 周雅琪, 黄佳茵, 陈美玉, 等. 亚牛磺酸对南美白对虾多酚氧化酶活性及酶构象的影响[J]. 食品科学, 2021, 42(4): 100-106.
[32] RICHARD G, LE BRIS C, GUÉRARD F, et al. Immune responses of phenoloxidase and superoxide dismutase in the Manila clam Venerupis philippinarum challenged with Vibrio tapetis-part II: combined effect of temperature and two V. tapetis strains[J]. Fish & Shellfish Immunology, 2015, 44(1): 79-87.
[33] LE BRIS C, RICHARD G, PAILLARD C, et al. Immune responses of phenoloxidase and superoxide dismutase in the Manila clam Venerupis philippinarum challenged with Vibrio tapetis-Part I: Spatio-temporal evolution of enzymes' activities post-infection[J]. Fish & Shellfish Immunology, 2015, 42(1): 16-24.
