蒙古沙冬青根际土壤细菌群落组成及多样性与生态因子相关性研究
2021-01-16王文晓李小伟黄文广杨君珑
王文晓,李小伟,*黄文广,杨君珑
1 宁夏大学农学院, 银川 750021
2 宁夏草原工作站, 银川 750021
荒漠的生存条件极端恶劣,却拥有丰富的微生物资源[1]。由于荒漠生态系统特殊的环境,土壤微生物学特性方面的研究备受研究方法的限制[2]。有关土壤微生物群落多样性的研究主要集中在草地[3]、森林[4]、湿地[5]等生态系统,对荒漠生境土壤微生物群落多样性的研究相对较少。近年来,随着测序技术的不断发展,荒漠土壤微生物生态学研究逐渐开展起来,研究区域涵盖中国西北地区[6],其中根际微生物的生物多样性、植物-土壤-根际微生物间的互作、根际微生物的群落结构和功能调控等成为研究的热点[7- 8]。根际土壤细菌是土壤微生物主要的组成部分,参与多种生化反应,在土壤有机物分解、腐殖质形成、养分转化与吸收等过程中扮演着重要角色,其特性是表征土壤基质变化的敏感指标。因此,根际土壤细菌群落组成和变化成为土壤生态学的热点研究方向之一[9]。
沙冬青(Ammopiptanthusmongolicus)隶属豆科沙冬青属,为亚洲中部荒漠特有种[10],为古地中海第三纪孑遗植物,是国家三级濒危保护植物,主要分布在宁夏中北部、内蒙古西部及甘肃中东部等荒漠地区[11],多生长在沙丘、河滩沙地、砂砾土生境,是荒漠优势种之一,也是西北荒漠生境中唯一常绿阔叶灌木,具有地上部冠幅大、分枝多、抗逆性强等生物学特性,在水土保持和防治荒漠化方面作用显著,是西北荒漠优良的防风固沙树种之一[12]。近年来,对沙冬青的研究主要集中在生理生态[13]、抗逆生理[14]、群落区系组成与结构特征[15]、迁地保护及濒危原因[16]等方面,但有关沙冬青根际土壤微生物群落方面的报道很少,现有的研究是基于传统的计数法和生物化学方法[17],研究的尺度仅限于一个或少数几个样地[18]。新一代高通量测序技术被广泛应用于微生物群落结构和物种组成分析,为大尺度和深层次的土壤微生物群落结构分析提供了保障[19]。因此,探明沙冬青根际细菌群落多样性以及影响因素,对揭示沙冬青适应极端干旱环境的机理,稳定和改善荒漠生态系统有重要意义。本研究采用高通量测序技术,拟对荒漠生境中沙冬青根际土壤细菌群落多样性与生态因子的关系进行分析。
2 材料与方法
2.1 研究区概况
本研究区域为104°47′42.72″—107°9′2.52″E,36°16′35.76″—41°46′36.84″N,海拔范围在1023—1883 m之间。主要包括宁夏中北部地区,内蒙古西部的戈壁荒漠及甘肃中条山附近,该区属温带大陆性气候,年平均气温在6.76—11.21℃之间,年均降雨量在105—389 mm之间,年均蒸发量大于2000 mm,该区土壤基质主要为沙质、砾质和黏土质土壤,此类土壤保水保肥能力弱,土壤贫瘠。本研究依据沙冬青自然分布情况选择了26个典型群落作为样地,基本涵盖了沙冬青的分布范围(图1),沙冬青样地的植物群落特征详见表1。
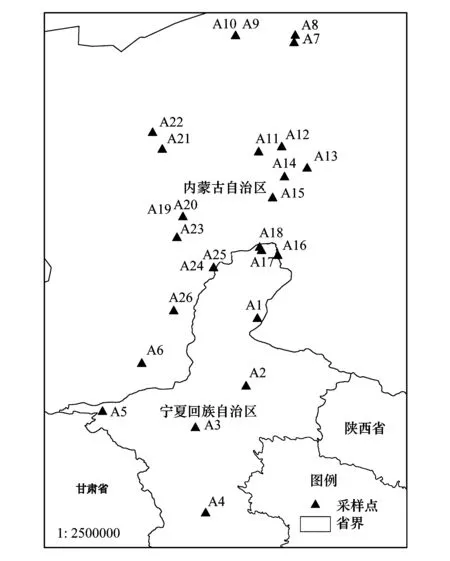
图1 蒙古沙冬青采样点分布图Fig.1 Distribution of sampling plots for A.mongolicusA1—A26:蒙古沙冬青群落样地 Community plots for A.mongolicus
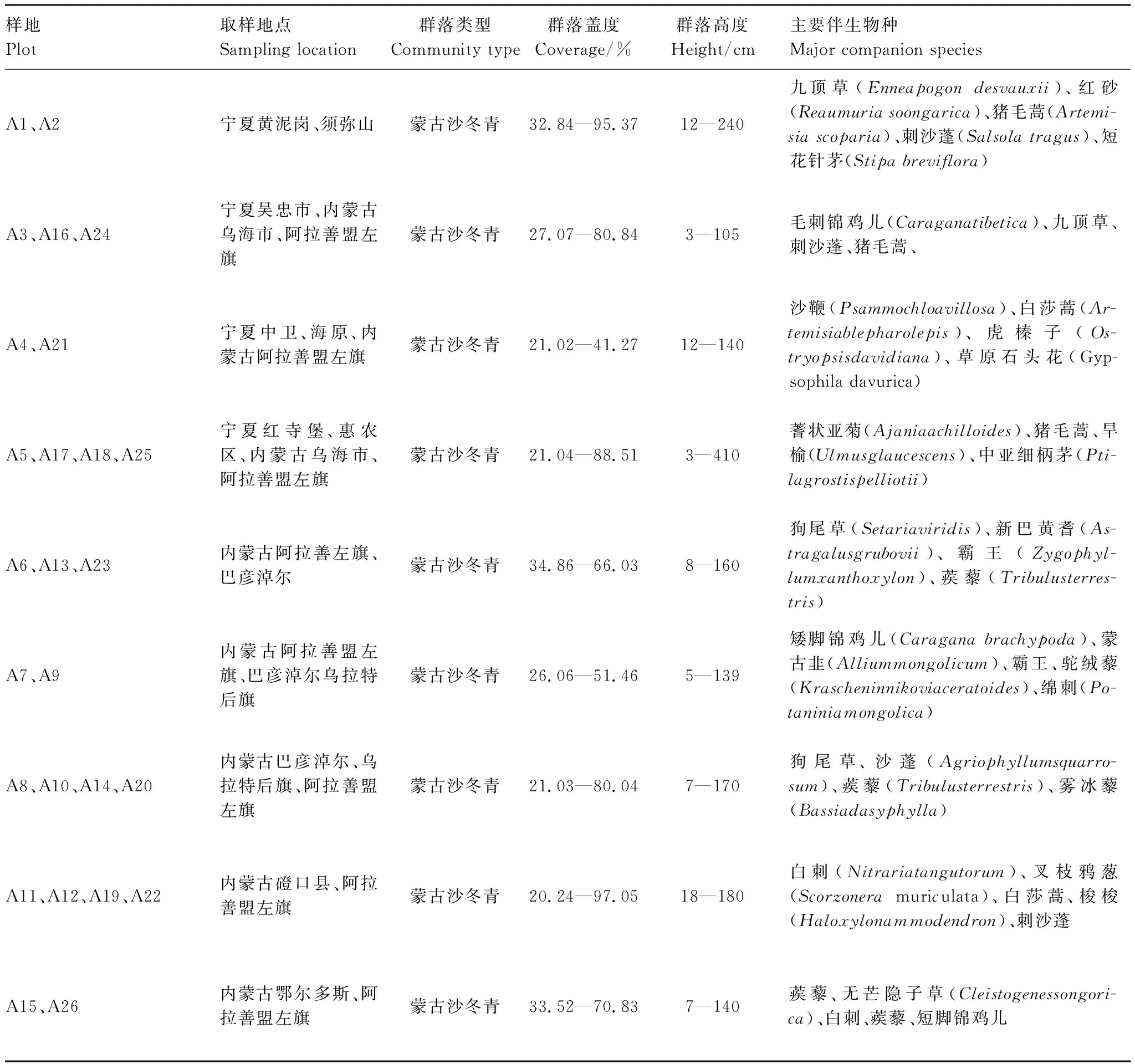
表1 蒙古沙冬青采样点群落特征Table 1 Community characteristics of A.mongolicus sampling sites
2.2 研究方法
2.2.1土壤取样
2018年8月,在沙冬青分布区内选择了26个具有代表性的样地,每个样地使用手持全球定位系统(Global position system,GPS)测定经度、纬度和海拔,随机设置3个10 m×10 m的样方,样方相隔200 m左右,在每个样方中选择三株长势相近的沙冬青,采集其根际土壤,混合,共取得78份土壤样品。取样步骤:用铁锹去除沙冬青根部周围枯落物和土壤,在距离地表0—30 cm的地方,待根部露出后收集附着在根表面5 mm以内的土壤置于无菌的50 mL离心管中,将同一样方中的3株沙冬青根际土壤混匀,编号后置于液氮罐中立即带回实验室,部分用于高通量测序,部分自然风干、过筛,用于土壤理化性质的测定。
2.2.2土壤理化性质
土壤理化性质的测定均按照《土壤农化分析》[20]进行测定:土壤pH的测定采用电位测定法(水土比为5∶1);土壤全氮用全自动凯氏定氮仪测定;土壤全磷和速效磷用流速分析仪测定;有机质用重铬酸钾氧化—外加热法测定;碱解氮用碱解扩散法测定。
2.2.3气候数据
气候数据来自世界气候数据网站(http://www.woridclim.org/),该库提供了全球1 km×1 km分辨率近50年的月平均气温和降水数据[21]。气候数据包括年均降雨量、年均温、太阳辐射。
2.2.4土壤微生物总DNA的提取、PCR扩增及测序
将采集的土壤样品送到北京百迈客生物科技有限公司进行Illumina MiSeq高通量测序。使用Mobio土壤强力提取试剂盒(PowerSoil® DNA Isolation Kit)操作步骤提取样品细菌
16S rRNA基因。对细菌16S rRNA基因(V3+V4)区域引物[22]:5′-ACTCCTACGGGAGGCAGCA- 3′和5′-GGACTACHVGGGTWTCTAAT- 3′进行PCR扩增。PCR反应体系:基因组DNA40—60 ng/5 uL,*Vn F(10 μmol/L) 1.5 μL,*Vn R(10 μM) 1.5 μL,KOD FX Neo(TOYOBO) 1 μL,KOD FX Neo Buf(2X) 25 μL,2dNTP 10 μL,ddH2O补至总体系50 μL。PCR反应条件:95℃ 5 min;95℃ 15 min,50℃ 1 min,72℃ 1 min,15个循环;72℃ 7 min。扩增结果进行1.8%的琼脂糖凝胶,120 V 40 min电泳后,切目的片段,并回收。PCR扩增后并对其产物进行纯化、定量和均一化形成测序文库,建好的文库先进行文库质检,质检合格的文库用Illumina HiSeq 2500进行双向测序。对原始数据使用FLASH软件进行拼接,将拼接得到的序列使用Trimmomatic软件进行质量过滤,并使用UCHIME软件去除嵌合体,得到高质量的Tags序列(有效序列数)[23];在相似性97%的水平上使用USEARCH软件对序列进行聚类,以测序所有序列数的0.005%作为阈值过滤操作分类单元(Operational Taxonomic Units,OTUs),对OTUs代表序列进行物种注释,细菌OTUs的序列用RDP Classifier的方法与Silva的数据库(http://www.arb-silva.de)进行物种注释分析(设定置信度阈值为0.8)[24],最后对各样品的全部数据进行均一化处理。
2.2.5数据处理
使用SPSS18.0软件对均值、标准误进行计算,采用Pearson相关系数对各个指标进行了相关性分析。采用CANOCO 5.0进行蒙特卡罗检验和冗余分析(Redundancy analysis,RDA)分析了生态因子对细菌多样性的影响。
3 结果与分析
3.1 蒙古沙冬青根际土壤细菌群落组成分析
通过对沙冬青26个样地78个样本高通量测序共检测到细菌15门、43纲、68目、123科和185属。图2和图3分别展示了沙冬青各样地门(Phylum)和纲(Class)分类水平的细菌群落结构。从图2可知,沙冬青根际土壤中检测到的主要门有:蓝菌门(Cyanobacteria)、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)、软壁菌门(Tenericutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、螺旋体菌门(Saccharibacteria)、疣微菌门(Verrucomicrobia)和放线菌门(Actinobacteria)。蓝菌门、变形杆菌门、放线菌门(相对丰度>2%)是土壤中占主导地位的微生物,约占到了所有微生物总数的70%—80%以上。蓝菌门的变化范围为28.90%—74.62%,均值为65.74%;变形杆菌门的变化范围为28.90%—40.26%,均值为21.72%;放线菌门的变化范围为2.38%—14.95%,均值为6.28%。各优势菌门在不同样地的分布均有明显差异,大多数物种已分类明确,样地中仅有少量未分类命名物种。

图2 蒙古沙冬青土壤样品主要细菌种类在门水平上的相对丰度Fig.2 Relative abundance of major bacterial species in the soil samples of A. mongolicus
通过纲分类层次(图3) 的统计表明:样品中优势菌纲(相对丰度>2%)主要有α-变形菌纲(Alphaproteobacteria)、放线菌纲(Actinobacteria)、γ-变形菌纲(Gammaproteobacteria)。Α-变形菌纲的变化范围为10.96%—28.36%,均值为17.48%;放线菌纲的变化范围为1.65%—10.21%,均值为4.76%;γ-变形菌纲的变化范围为0.70%—7.18%,均值为3.28%。样品中分类层次不明确和未分类命名的物种较少,说明大多数已分类明确。在菌纲水平上,已分类清晰和准确命名的细菌群落在不同样地的分布差异不明显。
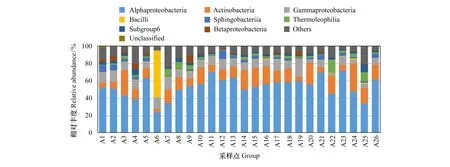
图3 蒙古沙冬青土壤样品主要细菌种类在纲水平上的相对丰度Fig.3 Relative abundance of major bacterial species in the soil samples of A. mongolicus
3.2 蒙古沙冬青根际土壤细菌多样性分析
对78个样品在97%的相似水平下进行高通量测序,共得到有效序列条数为5539824,对有效序列条数进行聚类共获得OTU样品数为30671,各样本OTU覆盖率(Coverage)均高于99.89%,该指数反映本次测序结果代表了样本中微生物的真实情况(表2)。从稀释曲线的结果(图4)可以看出,细菌的稀释曲线随着测序条数的加大均基本趋于平缓,则表明样品序列充分,能够代表物种的多样性,可以进行多样性数据分析。

图4 蒙古沙冬青根际土壤样本细菌多样性稀释曲线Fig.4 Rarefaction curve of bacterial diversity in rhizosphere soil of A. mongolicus
表2所示为蒙古沙冬青根际细菌多样性指数。Alpha多样性反映的是单个样品物种多样性,有多种衡量指标:Chao1指数、Ace指数、Shannon指数和Simpson指数。Chao1指数和Ace指数衡量土壤真菌群落物种数量的多少,指数越高说明样品细菌物种数量就越高,Shannon和Simpson指数反映土壤细菌群落物种多样性,Shannon指数值越大,Simpson指数值越小,说明样品的物种多样性越高。由表2可知,15个采样点的土壤样品Ace和Chao1 指数的变化范围分别为311.92—511.55、333.87—513.31;Shannon多样性指数变化范围在1.53—4.31之间,其数值相对较低,说明26个采样点的细菌多样性相对较低。

表2 蒙古沙冬青根际土壤细菌多样性一览表Table 2 The index of bacterial diversity in rhizosphere soil of A. mongolicus
3.3 蒙古沙冬青根际土壤细菌在门水平上与生态因子相关性分析
土壤细菌在门平上与水热及土壤理化因子Pearson相关分析发现(表3),大多数细菌在门水平上的丰度与纬度、海拔、年均降雨量、太阳辐射有显著相关性,如蓝细菌门与纬度极显著正相关,与年均降雨量极显著负相关,与太阳辐射显著正相关;变形杆菌门与纬度和年均降雨量显著负相关;放线菌门与海拔显著正相关;酸杆菌门与海拔显著正相关,与年均降雨量极显著正相关,与太阳辐射极显著负相关;拟杆菌门与纬度显著负相关,与年均降雨量极显著正相关;螺旋体菌门与纬度极显著负相关,与年均降雨量极显著正相关,与太阳辐射显著负相关;绿弯菌门与海拔极显著正相关,与年均降雨量显著正相关;疣微菌门与年均降雨量显著正相关。其中部分菌门与土壤理化性质有显著相关性。如放线菌门与降解氮显著正相关;拟杆菌门与含水率显著相关;厚壁菌门与全氮极显著正相关;绿弯菌门与降解氮显著正相关。
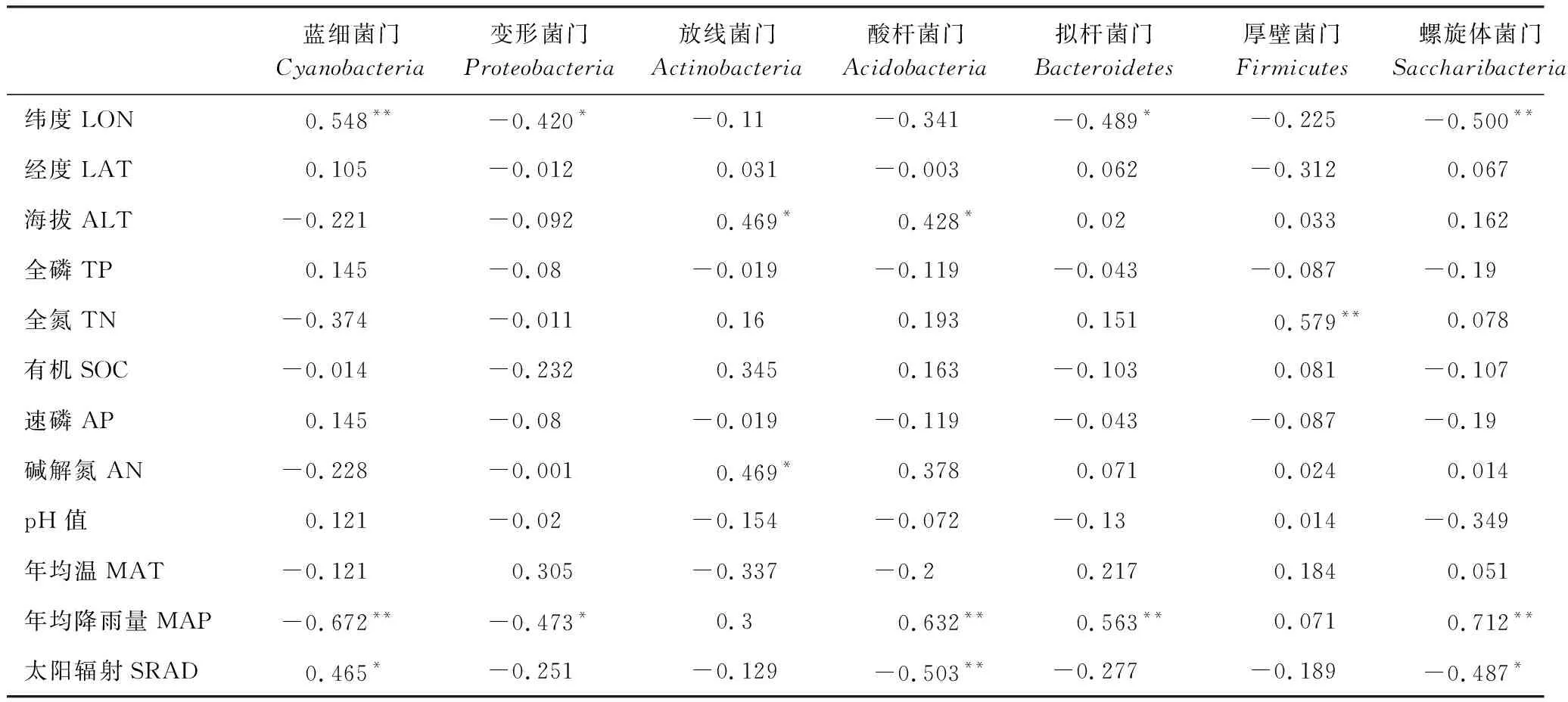
表3 蒙古沙冬青根际土壤细菌在门水平上与环境因子Pearson相关性分析Table 3 Correlation analysis of rhizosphere soil bacteria in A. mongolicus at the phylum level and environmental factors Pearson
3.4 生态因子对沙冬青根际土壤细菌多样性指数的影响
通过蒙特卡罗检验对沙冬青细菌多样性指数与环境因子进行分析,结果显示沙冬青根际细菌多样性指数与年均降雨量(F=12.8,P=0.002)、纬度(F=5.1,P=0.016)、太阳辐射(F=5,P=0.02)呈显著相关性,为主要的环境影响因子。而海拔(F=2.9,P=0.066)、碱解氮(F=2.7,P=0.066)、全氮(F=2.4,P=0.1)、年均温(F=0.7,P=0.432)、有机碳(F=0.4,P=0.614)、pH(F=0.3,P=0.646)、速磷(F=0.3,P=0.714)、全磷(F=0.3,P=0.672)、经度(F=0.1,P=0.982)对沙冬青根际细菌多样性的影响不显著。
沙冬青根际土壤细菌多样性指数与主要生态因子RDA排序表明(表4和图5):第一至第四主轴累计解释了沙冬青根际土壤细菌多样性指数52.69%的方差,其中第一主轴和第二主轴解释了沙冬青根际土壤细菌多样性指数45.41%和7.16%的方差。因此,沙冬青根际土壤细菌多样性指数在排序轴上的分布能够反映了细菌空间分布特征随生态因子的变化趋势。
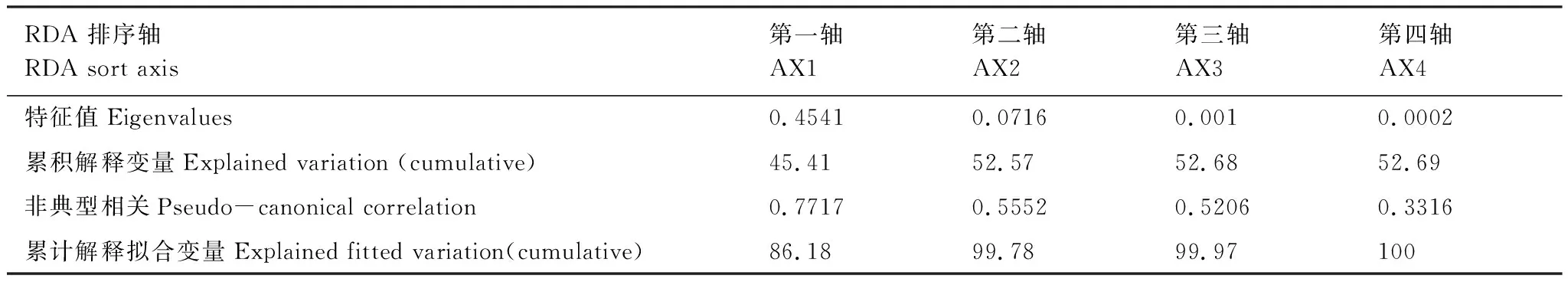
表4 蒙古沙冬青根际土壤细菌多样性指数与生态因子RDA排序Table 4 Bacterial diversity index and ecological factors RDA ranking in rhizosphere soil of A. mongolicus
RDA排序图反映了沙冬青根际细菌群落组成及多样性与生态因子之间的关系(图5)。箭头越长表示对沙冬青根际细菌群落多样性的解释量越大。箭头的之间的角度代表了变量之间的相关性。角度越小,相关性越大,反之则越小。其结果与相关性分析一致。
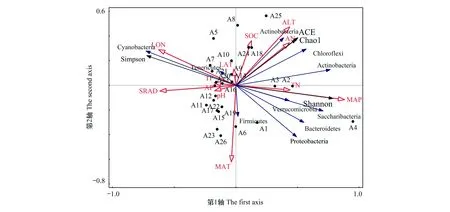
图5 蒙古沙冬青根际土壤细菌多样性与生态因子的RDA排序图Fig.5 RDA ranking of bacterial diversity and ecological factors in rhizosphere soil of A. mongolicusLON:纬度Latitude;LAT:经度Longitude;ALT:海拔Altitude;TP:全磷Total phosphorus;TN:全氮Total nitrogen;SOC:土壤有机质Soil organic matter;AP:速效磷Available phosphorus;AN:碱解氮Alkali-hydrolyzable nitrogen;pH:土壤pH值Soil pH;MAP:年均降雨量Average annual rainfall;MAT:年均温Annual average temperature;SRAD:太阳辐射Sun radiation
RDA分析表明,沙冬青根际细菌群落多样性与年均温、海拔、碱解氮存在正相关关系,与太阳辐射、纬度存在负相关关系,年均温、太阳辐射和纬度对沙冬青根际细菌群落多样性的影响较大。纬度和太阳辐射是影响蓝细菌门分布的主要因子;碱解氮是影响放线菌门分布的主要因子,年均温是影响酸杆菌门、拟杆菌门、螺旋体菌门、绿弯菌门、疣微菌门分布的主要因子,全氮是影响厚壁菌门分布的主要因子。生态因子的相关性,如有机质与碱解氮和全氮正相关,能够反映出不同样地土壤中的碳氮耦合对细菌多样性的影响。
4 讨论
4.1 蒙古沙冬青根际土壤细菌群落组成
大多数根际细菌对植物的生长是有利的,可以给植物提供营养,增强植物对营养元素的吸收,还可以保护植物免受病原菌的侵害[25- 26]。随着高通量测序技术在荒漠生态系统领域的广泛应用,对荒漠植物土壤细菌
群落结构的分布特点已有了基本的认识:荒漠植物根系土壤中主要的细菌群落组成基本相似,主要以变形菌门、放线菌门、厚壁菌门、酸杆菌门等为优势菌类[27- 29],这与本研究结果基本一致。沙冬青主要优势菌类为蓝细菌门、变形杆菌门、放线菌门,相对丰度和占总丰度的93.73%。蓝细菌门相对丰度与年均降雨量呈极显著负相关(P<0.01),有研究表明,蓝细菌是一种古老的自养型细菌,分布很广泛,种类繁多,有些种类在暗环境下也能生长,有些种类却可以利用光能固定碳,氮能力,营养要求极低,而且表现出一定的抗旱抗盐特性[32],对极端环境的适应性很强[30-31]。在荒漠贫瘠的土壤中,蓝细菌门作为沙冬青根际土壤细菌的第一大类群,能够为沙冬青富集生长必需元素提供更适宜生长的微环境,促进沙冬青的生长。变形菌门是一大类细菌群落,能够降解许多复杂的纤维素[33]与木质素[34],在很多细菌群落研究中都具有最高的相对丰度[35,30]。本研究中变形菌门相对丰度与年均降雨量呈极显著负相关(P<0.01),有研究发现放线菌门在土壤含水量较低的土壤中相对含量高[29],与本研究结果一致。在变形菌门中,α-变形菌和γ-变形菌是最重要的亚门,相对丰度范围分别为10.96%—28.36%、1.32%—7.18%。李新等[36]研究发现变形菌门是盐碱土壤的主要类群。本研究中,变形菌门是主要的次优势菌门,而该地区土壤呈弱碱性与李新等研究结果一致。放线菌门喜欢微碱性土壤,是干旱半干旱土壤中分布比较广泛的细菌类群,其相对丰度为6.28%。放线菌分枝状的菌丝体能够产生各种胞外水解酶,降解土壤中各种不溶性有机物质以供细胞代谢所需的各种营养,在自然界物质循环、土壤改良等方面都具有重要作用[17]。放线菌门是好气性微生物,土样含氧量较高的环境更适合放线菌门的生长[37]。其他菌门虽然在沙冬青根际土壤中都有分布,但相对丰度都比较低。许多研究发现pH是影响微生物群落的主要影响因素[38],这与本研究的结果不一致,可能是沙冬青分布区的pH变化范围比较小,所以对微生物群落的影响比较小。
4.2 蒙古沙冬青根际土壤细菌群落多样性与生态因子关系
在野外调查时发现,蒙古沙冬青多生长在沙丘、河滩沙地、砂砾土上,蒙古沙冬青分布地区根系表层累积了大量的凋落物,土壤微生物通过分解植物根系分泌物及凋落物对土壤理化性质与其自身多样性产生影响[39]。
一般认为,荒漠地区土壤微生物群落的组成和功能直接取决于生态因子[6],例如水分、土壤养分、太阳辐射、植被类型等。沙冬青群落生长于沙地生境,在长期干旱、风蚀条件下,不利于碳和氮积累,导致表层土壤养分贫瘠化,灌木的“肥岛”效应不明显,为其他荒漠植物种的入侵设置了障碍,沙冬青成了该生长区的灌木优势种[40]。pH、有机质含量、全氮、碱解氮、全磷、速磷[41]等土壤理化因子和经纬度、海拔、年均温、年均降雨量、太阳辐射等生态因子可能都影响沙冬青根际土壤细菌的空间分布格局。RDA分析表明:土壤理化因子和pH等对土壤细菌群落结构和多样性的影响并不显著,而纬度、年均降雨量、辐射对土壤细菌群落结构和多样性有显著性影响,这与贺学礼[18]有关沙冬青根际土壤微生物分布和土壤因子之间有显著相关性的结果有所不同。究其原因可能是选择的沙冬青都是野生的,不是人工种植的,人为的扰动很少,没有土壤营养元素的人为输入;另外,采样地纬度和海拔差异较大,具有明显的尺度效应,这些因素的共同作用,导致土壤营养元素对土壤细菌群落结构和多样性的影响不如气候因子影响显著。许多研究表明,水分对荒漠植物根际微生物多样性和生长影响较大。本研究中,年均降雨量即水分是影响沙冬青根际土壤细菌群落结构和多样性的最重要因子,这与前人研究的结果一致[42- 43]。沙冬青根际土壤细菌多样性与太阳辐射呈负相关,是因为荒漠生境中植物稀疏,地表裸露较多,太阳辐射量对光合微生物来说已远远超过其光合有效辐射[44],高强度太阳辐射降低了土壤微生物的存活率和多样性。
高通量测序技术作为二代测序方法,被大多数学者用来研究土壤微生物的生物地理学分布[38,45],探究土壤微生物是否像动物、植物那样随着纬度的差异而变化。Liu对东北黑土细菌群落的研究认为纬度是影响土壤微生物分布的重要因素[46],Zhang等对不同植被类型下北麓河多年冻土微生物的研究认为纬度不是影响土壤微生物的主要因素[47]。本研究中研究区域南北跨度比较大,纬度变化明显,因此纬度变化是影响沙冬青根际土壤细菌分布的主要因素。本研究探明了沙冬青土壤细菌的地理分布,为评估沙冬青在荒漠生态系统维持中的作用提供理论依据。
5 结论
(1)在97%的相似度水平下将有效序列进行聚类,获得的OTU进行分类学物种注释,26个样品获得细菌30671个OTU,蒙古沙冬青检测到细菌15门,43纲,68目,123科,185属。
(2)蒙古沙冬青根际土壤中的优势菌门为蓝菌门(Cyanobacteria)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)。主要的优势菌纲为主要有α-变形菌纲(Alphaproteobacteria)、放线菌纲(Actinobacteria)、γ-变形菌纲(Gammaproteobacteria)。
(3)78个样本测序覆盖率均高于99%,Alpha多样性指数的测序结果代表了沙冬青根际土壤细菌的真实情况,但细菌多样性相对较低。
(4)RDA分析显示:年均降雨量、纬度和太阳辐射是影响沙冬青根际细菌多样性的主要因子。
