甜叶菊RA苷合成关键基因SrUGT76G1对水分胁迫响应分析
2021-01-16
(江苏省中国科学院植物研究所/南京中山植物园,南京 210014)
0 引言
甜菊糖苷(Steviol glycosides,SGs)是富含于菊科多年生草本植物甜叶菊(Stevia rebaudianaBertoni)叶片中的多种四环二萜类化合物的总称。因其具有高甜度、低热量、预防和辅助治疗肥胖症、糖尿病、高血压和高血糖等优点,而被广泛应用于食品、饮料及医药等领域[1]。在目前发现的30余种糖苷组分中,蛇菊苷(Stevioside,STV)和莱包迪苷A(Rebaudioside A,RA苷)是甜叶菊叶片中糖苷的主要成分[2],占总糖苷的80%~95%。相比于STV苷,RA苷甜度更高、口感更接近蔗糖,因此,RA苷具有更广阔的市场前景[3-4]。
甜菊糖苷生物合成途径及其关键基因挖掘一直是国内外甜叶菊研究的热点之一。目前已证实甜菊糖苷的生物合成是以甜菊醇(Steviol)为苷元,以尿苷二磷酸葡萄糖(Uridinediphosphate glucose,UDPG)为主要糖基供体,再经一系列尿苷二磷酸葡萄糖基转移酶(Uridinediphosphate-dependent glycosyltransferases,UGTs)的催化作用,分别在甜菊醇四环二萜苷的C-13 和C-19 位连接不同种类和数目的糖基而生成各糖苷组分[4]。STV苷是由甜菊双糖苷在C-19位连接一个葡萄糖基转化形成,而RA 苷是在STV苷的基础上对其C-13位C-3′进行糖基化修饰而生成。在RA 苷合成过程中,SrUGT76G1 酶具有重要的催化作用[4,6]。GULERIA 等发现瞬时沉默SrUGT76G1基因导致甜菊糖苷含量下降56%~63%[7]。KIM 等通过农杆菌介导的方法在甜叶菊中过表达SrUGT76G1后发现,总糖苷含量并没有明显变化,然而RA 与STV的含量比例由0.3 显著上升为1.55,并且过表达SrUGT76G1不影响植株的生长发育过程[8]。本项目组前期对一超低RA 苷合成突变株的研究发现,该突变株糖苷合成异常是由于SrUGT76G1基因序列改变从而使相应酶功能丧失所导致的[9]。SrUGT76G1酶的催化作用决定了RA苷的含量以及STV 苷和RA苷之间的比例,因此提高SrUGT76G1的表达对于糖苷产量和品质的提高均具有重要意义。
植物次生代谢产物合成受多种因素调控,既包括外界环境因素(光照、水分、温度和矿质营养等),也包括内在激素的调控,它们通过促进或者抑制糖苷合成路径相关基因的表达进而影响甜叶菊叶片中糖苷合成[10]。前期研究表明,水分胁迫会影响RA 苷合成,但其分子作用机制尚未报道[11-12]。因此,本研究立足于RA 苷合成关键基因SrUGT76G1,通过荧光定量PCR、烟草瞬时转化及转基因拟南芥干旱处理后GUS 染色等手段明确其对水分胁迫的响应,并进一步分析SrUGT76G1启动子中存在的可能与水分胁迫相关的顺式作用元件。本研究为今后深入开展甜叶菊栽培的高效水分利用与管理措施提供理论支持,并为进一步鉴定SrUGT76G1上游响应水分胁迫的调控因子奠定基础。
1 材料与方法
1.1 试验材料与种植条件
试验所用的‘中山6号’甜叶菊植株保存于江苏省中国科学院植物研究所甜叶菊种质资源圃。用于瞬时转化的烟草植株和用于转基因的野生型哥伦比亚拟南芥植株分别种植于营养土∶蛭石=2∶1 和1∶1 的小方盆中,然后放置于光照培养箱中培养。光周期为16 h 光照/8 h 黑暗,昼夜温度为23 ℃/18 ℃,光照强度为80~100 μmol/(m2·s),植物材料定期浇水,正常管理。
1.2 试验方法
1.2.1 甜叶菊、烟草和拟南芥植株水分胁迫处理
取生长一致的两叶一心甜叶菊插穗扦插于营养土∶蛭石=1∶2的穴盘中,待生长至6片展开叶时从穴盘中移除,洗净根,并放于培养箱中清水培养2 d,培养条件与烟草和拟南芥植株种植条件相同。2 d后撤去清水,直接进行空气干旱处理,并于撤去水后0、1、4、8、12 h 时分别取植株叶片,速冻于液氮中,然后保存在-80 ℃冰箱以备后续RNA 提取。将携带pUGT76G1:GUS载体的农杆菌注入烟草叶片中,放置于培养箱中正常培养,并分别浇灌清水、15%和20% PEG(v/v)溶液,培养2 d 后取注射过的烟草叶片用于GUS 染色。将转化pUGT76G1:GUS的拟南芥T3代纯合株系播种于MS培养基上,生长2周后从培养基上小心取下,分别放置于含有0、200 mmol/L的甘露醇溶液中处理24 h,之后取出幼苗放于GUS染色液中进行染色。
1.2.2 RNA提取及基因定量
采用Trizol 试剂(TAKARA)进行甜叶菊和拟南芥总RNA 的提取,并通过PrimeScript 1st Strand cDNA Synthesis Kit 试剂盒(TAKARA,D6110A)进行mRNA 的反转录。根据SrUGT76G1和甜叶菊内参β-actin基因[13]的特异引物(引物序列见表1),通过SYBR Premix Ex Taq 试剂(TAKARA)在ABI7500荧光定量PCR 仪上对SrUGT76G1在不同水分胁迫时间点的表达量进行分析。相对表达量的计算采用2-ΔΔCT法[14]。

表1 研究所用的PCR 引物Table 1 PCR primers used in this study
1.2.3 烟草叶片瞬时转化
根据前期克隆得到的SrUGT76G1启动子序列设计加接头引物76G1-GUS-F/R(引物序列见表1),利用KOD 高保真酶(TAKARA)对目的序列进行扩增,通过Infusion 重组技术将胶回收后的目的片段插入到1305-GUS 载体中的EcoR1 和Nco1 酶切位点之间。构建的pSrUGT76G1:GUS载体通过热激转化法转入农杆菌感受态菌株EHA105,经菌液检测正确后注射入生长五周左右的烟草健康叶片中并对注射区域进行标注。
1.2.4 GUS染色
将进行水分胁迫处理过后的烟草叶片和拟南芥转基因幼苗放入GUS 染色液中(1 mg/mL X-Gluc、pH 7.0,1 mmol/L铁氰化钾,1 mmol/L 亚铁氰化钾,50 mmol/L磷酸钠缓冲液,0.1%Triton X-100,10 mmol/L EDTA、pH 8.0),用锡箔纸包裹后放置于37 ℃培养箱中。待组织着色后,用70%酒精进行多次脱色直至叶绿素完全褪去,然后放于纯酒精中长期保存并拍照记录。
1.2.5 拟南芥转基因及阳性苗筛选鉴定
利用花粉管通道法将含有pSrUGT76G1:GUS载体的EHA105农杆菌转化入野生型拟南芥植株,并用保鲜膜包裹以保持湿润。暗培养20~24 h 后打开保鲜膜,进行正常的管理直至收种[15]。收获的种子用酒精进行清洗灭菌后播种于MS+20 mg/L潮霉素的培养基上。2周左右后将生长正常的阳性苗移栽到营养土∶蛭石=1∶1 的培养基质中,并用保鲜膜覆盖1 周左右以保持湿润。取阳性苗叶片进行RNA 的提取及反转录,并根据GUS序列设计引物(引物序列见表1),选取RT-PCR检测为阳性的株系,继续培养直至纯合T3代。
1.2.6SrUGT76G1启动子中水分胁迫响应元件分析
将前期得到的SrUGT76G1启动子序列提交到PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)网站,根据预测结果分析可能与水分胁迫相关的顺式作用元件。
2 结果与分析

图1 水分胁迫条件下SrUGT76G1基因表达模式Fig.1 The relative expression level of SrUGT76G1 gene under water stress conditions
2.1 水分胁迫下SrUGT76G1的表达模式分析
为了明确SrUGT76G1基因对水分胁迫的响应模式,对空气干旱胁迫下SrUGT76G1的表达水平进行了定量分析。结果表明,随着水分胁迫时间的延长,SrUGT76G1的表达水平呈现为先升高后下降的趋势(图1)。因此,SrUGT76G1的表达水平可能受水分胁迫严重程度的影响,即在轻度胁迫情况下表达上调,而重度胁迫则会抑制其表达。
2.2 SrUGT76G1启动子转化烟草干旱处理后GUS染色情况
为了进一步明确SrUGT76G1基因对水分胁迫的响应,我们构建了pSrUGT76G1:GUS载体并等量注射入烟草叶片中,而后进行PEG 诱导的干旱处理。GUS 染色结果发现,对照水分处理情况下的烟草叶片能被轻度染色,表明烟草体内存在能够结合SrUGT76G1启动子的蛋白并启动GUS报告基因的表达。然而,与对照相比,PEG 处理下的GUS 染色程度显著增加,且20% PEG 处理作用要强于15%PEG(图2)。以上结果证明,一定程度的干旱胁迫能够增强SrUGT76G1启动子的转录活性,这与干旱胁迫条件下SrUGT76G1表达量的变化情况相一致。

图2 转化pSrUGT76G1:GUS 载体的烟草干旱处理后GUS染色情况Fig.2 GUS staining of tobacco leaves transformed with pSrUGT76G1:GUS construct after drought treatment
2.3 SrUGT76G1启动子转化拟南芥干旱处理后GUS染色情况
为了更为深入地探究SrUGT76G1基因对水分胁迫的响应,我们进一步将上述pSrUGT76G1:GUS载体通过花粉管通道法转化入拟南芥哥伦比亚型野生型植株中。在抗性筛选培养基上获得阳性苗后进一步利用RTPCR 方法对其进行检测,并获得多个阳性转基因株系(图3)。我们进一步选取阳性株系进行种植,进而得到多个T3代纯合株系。选用#1 T3代幼苗,待其生长至2周后放置于含有0 和200 mmol/L 甘露醇的水溶液中培养24 h。GUS染色结果表明,与对照相比,经甘露醇处理后的拟南芥幼苗染色程度明显加深(图4),与上述烟草中的结果相一致,进一步证实SrUGT76G1的转录活性确实可以受水分胁迫诱导。

图3 转基因拟南芥RT-PCR检测Fig.3 RT-PCR analysis detecting the GUS gene in WT and transgenic Arabidopsis
2.4 SrUGT76G1启动子中干旱胁迫响应元件分析
以上试验结果表明,水分胁迫能够诱导SrUGT76G1基因的表达。为了进一步探究其上游调控机制,将SrUGT76G1的启动子序列提交PlantCARE 网站以进行顺式作用元件的分析。预测结果表明,SrUGT76G1的启动子中包含有多个茉莉酸响应元件(CGTCA-motif、TGACG-motif、MYC 和Myc)及胁迫相关的MYB 类转录因子结合基序(图5),暗示这些转录因子可能在水分胁迫条件下调控SrUGT76G1基因的表达。因此,后续拟构建SrUGT76G1启动子不同区段的GUS 载体,结合瞬时表达及转基因拟南芥干旱处理后GUS 染色情况进一步缩小水分胁迫响应区段的启动子序列,并结合元件预测和酵母单杂等手段进一步明确其上游调控因子。
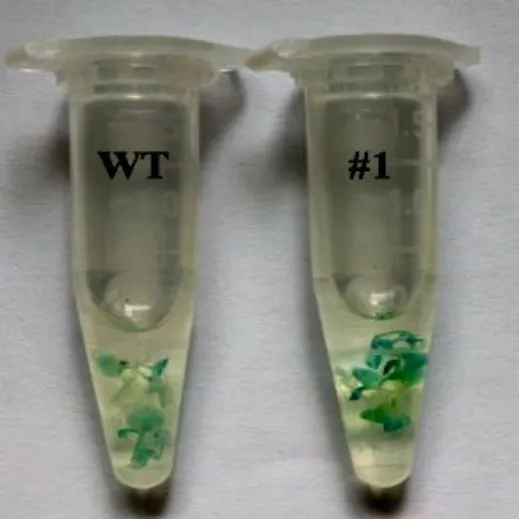
图4 pSrUGT76G1:GUS转基因拟南芥干旱处理后GUS染色情况Fig.4 GUS staining of pSrUGT76G1:GUS transgenic Arabidopsis after drought treatment

图5 SrUGT76G1启动子中干旱胁迫响应元件分析Fig.5 The drought-responsive elements analysis of SrUGT76G1 promoter
3 讨论
甜叶菊属浅根系植物,具有对水分胁迫十分敏感的生物学特性,因此在目前实际栽培过程中,多予以较高土壤相对含水量(约为80%)以保持水分的充足供给[16],而并没有依据有益于甜叶菊生长和糖苷合成与品质的实际水分需求进行灌溉,导致了大量水资源的浪费,且降低了干叶原料的品质。目前,在药用和香料植物中已多有报道称,适量减少水分供给(抑或适度水分胁迫)在一定程度上可促进次生代谢产物的生成,然而,甜叶菊中的相关研究甚少。
次生代谢产物合成与水分胁迫之间的关系较为复杂,并受胁迫程度、持续时间、胁迫方式及物种类型等影响[17]。目前,已有较多研究表明适度水分胁迫可以促进次生代谢产物的合成,这是由于水分胁迫会诱导干旱相关的代谢反应,例如气孔关闭及CO2摄入显著降低等,导致通过卡尔文循环固定CO2所需的还原当量消耗显著降低,从而形成较大的氧化胁迫和还原当量过剩,此时植物的代谢过程就会转向消耗还原当量的天然产物的合成过程[18]。BYTOF等发现,经过干燥处理后的咖啡豆中的γ-氨基丁酸含量相比于未处理的提高约10倍[19]。在轻度水分胁迫下黄芪根中多糖和皂苷两种次生代谢产物积累增加,使药材质量得到显著提高[20]。在甜叶菊中,YANG 等通过停止浇水直至甜叶菊植株萎蔫的方式进行干旱处理发现,RA 苷合成关键基因SrUGT76G1的表达水平显著下调[11]。然而,KARIMI等通过间隔3、6、9 和12 d灌溉的方法使土壤相对含水量分别维持在90%、75%、60%和45%,测量甜叶菊株高、干叶重和糖苷含量后发现,当土壤相对含水量为60%时,株高和干叶重量相比于90%和75%条件下虽略有下降,但是总糖苷和RA 苷含量却明显升高,而当相对含水量降至45%时,植株生长发育则会受到明显抑制,表明45%土壤相对含水量是供试甜叶菊品种的水分胁迫上限[12]。BEHROOZI 等在KARIMI等的试验基础上进一步发现,SrUGT76G1的表达量与RA 苷含量呈正相关,并且较90%和75%条件下有明显的提高[6,10]。而本研究中SrUGT76G1的表达量随着水分胁迫时间的延长呈现先升高后降低的趋势则可以部分解释以上结果的差异,即适度水分胁迫可以促进SrUGT76G1的表达而严重水分胁迫则抑制其表达。因此,本研究为今后提高甜叶菊栽培水分利用效率及提高RA 苷含量提供了重要的理论基础。
近年研究证实,SrUGT76G1在RD 和RM苷合成过程中也具有重要作用[21-22],该两种糖苷成分的口感更为优良,但其含量极少,只占干叶重的0.1%左右。因此,深入探究SrUGT76G1响应水分胁迫的上游调控因子,不仅可以解释适度水分胁迫促进RA 苷合成现象的分子机制,也为今后通过转基因手段提高甜叶菊中优质糖苷的含量提供宝贵基因资源。
4 结论
(1)一定程度的水分胁迫可以促进RA 苷合成关键基因SrUGT76G1的表达。
(2)适度水分胁迫可能通过结合SrUGT76G1启动子上的茉莉酸响应和MYB转录因子顺式作用元件来调控其表达。
