多效唑对热区土壤细菌和真菌的影响及网络互作分析
2021-01-15陈丽君周彦妤靳晓拓吴春蕊赵洪伟
陈丽君,周彦妤,靳晓拓,宋 禹,吴春蕊,赵洪伟*
(1.海南省植物保护总站,海南 海口 570100;2.海南省热带生态环境修复工程研究中心&海南省农林环境过程与生态调控重点实验室,海南大学生态与环境学院,海南 海口 570228)
多效唑(PBZ)是一种三唑类化合物,具有调节植物生长兼广谱杀菌作用[1]。多效唑通常通过喷施或者直接应用于土壤中,会对作物的生长和土壤微生物活性造成不同程度的影响[2-3]。细菌和真菌群落是土壤微生物中的重要功能群,它们可以通过不同方式来提高土壤养分利用效率[4]。细菌与真菌间的相互作用在土壤环境中十分重要[5],细菌和真菌之间的协同作用不仅利于土壤中有机污染物的生物降解,而且能提高植物抵御环境胁迫的能力[6-7]。以往的研究强调了多效唑的过量使用会对土壤微生物有一定负面影响[8-9],然而这些研究只关注于评估多效唑对细菌多样性和群落组成变化等的影响,常忽视微生物间的相互作用分析。但微生物各类群之间有一定的关联性,会形成复杂的相互作用网络。微生物网络分析可以揭示微生物群落的复杂性和群落成员之间的相互关系[10]。本文研究了多效唑对土壤细菌和真菌的影响,在此基础上,采用共现网络分析方法,分析了在不同时间下不同浓度多效唑处理对土壤细菌和真菌相互作用网络变化的影响,以评估其对土壤细菌和真菌的不利影响,以期为合理使用多效唑提供科学依据。
1 材料与方法
1.1 材料 95%多效唑原药,二甲基亚砜,分析级乙腈,土壤DNA 提取试剂盒,DNA胶回收试剂盒。本试验采用海南大学试验基地红壤土。
1.2 方法
1.2.1 试验设计 根据多效唑施用推荐用量(2~4mg/kg)和调研海南省三亚与乐东地区15个芒果园农民实际用量(20~50mg/kg),设置0、3和30mg/kg 3个处理浓度。施药前先用DMSO配置浓度为3和0.3mg/mL的多效唑母液。采集土壤并过40目筛后称取100g土壤于棕色小瓶内培养,取出20g土壤,D3处理组加入1.0mL 0.3mg/mL多效唑原药标准溶液,D30处理组加入1.0mL 3mg/mL多效唑原药标准溶液,空白组加入1.0mL的DMSO,立即混匀,随后倒入剩余土壤[11],反复混匀5min,使其对应的土壤中施药浓度为0、3、30mg/kg。称取各瓶的重量并记录,将土壤样品置于25℃的生化培养箱中培养。实验期间用恒重法给各土样补充蒸馏水以稳定保持土壤含水量为50%。于施药处理3d(T1)、10d(T2)、60d(T3)、150d(T4)的各采集2份土壤样品,一份用于多效唑原药残留量的测定,一份用于提取DNA用于土壤真菌和细菌高通量测序分析。
1.2.2 样品预处理 用天平称取施药处理3、10、60、150d的土样3g,每个样品3个重复,加入3mL蒸馏水、30mL乙腈,放入摇床室温振荡2~3h(rpm:230),振荡结束后静置3h,随后将上清液倒入比色管中,每份样品加入1g左右氯化钠,摇匀直至分层,取上层溶液15mL于棕色瓶进行氮吹,氮吹结束后加入色谱乙腈1mL定容,过0.22μm有机滤膜后上机检测。
1.2.3 高效液相色谱分析 使用安捷伦1260高效液相色谱仪(DAD检测器)测定;C18色谱柱(250mm×4.6mm,5μm);流动相为乙腈/水=55/45(V/V);流速1.0mL/min;多效唑原药检测波长:222nm;柱温30℃;进样量10.0μL[12]。
1.2.4 DNA提取和测序分析 土壤DNA的提取采用试剂盒(PowerSoil®DNA Isolation kit);土壤细菌PCR扩增引物:515F(GTGCCAGCMGCCGCG-GTAA)和907R(CCGTCAATTCMTTTRAGTTT),土壤真菌PCR扩增引物:ITS1F(CTTGGTCATTTAGAGGAAGTAA)'和引物ITS2R (GCTGCGTTCTTCATCGATGC)。PCR扩增引物设计、反应体系与反应条件参考文献进行[3,13]。样品DNA的PCR质量验证满足要求后,委托北京百迈克生物科技有限公司进行细菌16s rRNA测序分析和真菌ITS测序分析,测序平台为Illumina HiSeq2500,使用百迈克云平台进行数据分析。本研究的统计分析均采用 SPSS v16.0软件进行分析。
1.2.5 共现网络构建 运用R语言的‘psych’数据包[14]Corr.test计算样品相关性矩阵并执行检验不同菌群所有物种间的Pearson相关性系数,得到相关性系数矩阵和P值矩阵,确定物种间存在相互作用关系的阈值(ρ>0.8,P-Value<0.05),利用Gephi 0.9.2软件进行网络绘制和计算拓扑性质。
2 结果与分析
2.1 多效唑HPLC分析方法 用标准曲线法依次测定了不同浓度多效唑原药标准样品的峰面积。多效唑浓度与峰面积线性关系良好 (相关系数R≥0.999),回归方程为y = 253.85x-2.386 2,R2= 0.999 8,可满足多效唑检测分析要求以实现多效唑的定量分析。添加回收率试验表明,该方法添加多效唑0~3mg/kg(0、0.03、0.3、3mg/kg),回收率在96.38%~108.72%之间,变异系数在2.27%~3.14%之间,满足试验分析要求。
2.2 多效唑的降解 (表1)可知土壤中多效唑原药的残留量不断减少,多效唑原药的降解率随时间的延长而不断升高,在施药处理150d表现出最高降解率。

表1 土壤多效唑原药降解率
2.3 微生物群落组成 在门水平上,(图1A)可知T1~T3时期相对丰度>1%的细菌菌门中主要有变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)等,T4时期主要的优势细菌菌门是厚壁菌门(Firmicutes),CK组(36.42%)、D3处理组(16.99%)、D30处理组(25.54%)。T1~T3时期,与CK组相比,D30处理组中绿弯菌门(Chloroflexi)相对丰度分别增加7.6%、6.7%、7.2%,而酸杆菌门(Acidobacteria)相对丰度分别降低1.5%、7.0%、5.9%。T4时期,与CK组相比,D3处理组绿弯菌门(Chloroflexi)丰度降低5.3%,D3和D30处理组放线菌门(Actinobacteria)相对丰度分别降低37.58%、43.71%,芽单胞菌门(Gemmatimonadetes)相对丰度分别增加6.58%、10.60%。T4时期,拟杆菌门(Bacteroidetes)在CK、D3、D30 处理组中占相对丰度>1%的细菌菌门的11.59%、20.10%、29.60%,处理组相对丰度上升。(图1C)可知相对丰度>1%的土壤真菌菌门有子囊菌门(Ascomycota)、壶菌门(Chytridiomycota)、担子菌门(Basidiomycota)。与CK组相比,T1时期D3和D30处理组子囊菌门(Ascomycota)相对丰度分别增加9.63%、21.58%,T4时期分别降低33.80%、7.39%。T2时期D30处理组壶菌门(Chytridiomycota)较CK组相对丰度增加1.82倍,T4时期降低 68.74%。T4时期D3及D30处理组的担子菌门(Basidiomycota)相对丰度分别比CK组降低55.54%和12.90%。
在属水平上,(图1B)可知,相对丰度>1%的细菌菌属为假诺卡氏菌属(Sphingomonas)、芽孢杆菌属(Bacillus)、诺卡菌属(Nocardioides)等,T1时期,CK、D3、D30 处理组中的假诺卡氏菌属(Sphingomonas),占相对丰度>1%的细菌菌属的11.00%、10.87%、10.80%,T4时期仅占5.79%、6.06%、5.30%。(图1D)可知相对丰度>1%的真菌菌属有Spizellomyces属、镰刀菌属(Fusarium)、曲霉菌属(Aspergillus)等。T4时期,CK、D3、D30处理组中未分类菌属和其他菌属分别占相对丰度>1%的真菌菌属的86.04%、91.08%、92.84%。T4时期,曲霉属(Aspergillus)相对丰度分别为2.68%、0.78%、154%,镰刀菌属(Fusarium)相对丰度分别为5.80%、4.27%、2.76%,多效唑处理组曲霉属、镰刀菌属相对丰度均下降。在T3时期中,CK组的Spizellomyces属相对丰度为16.60%,D3处理组(13.68%)和D30处理组(15.42%)的相对丰度均低于CK组。多效唑处理组细菌和真菌群落物种相对丰度与CK组相比,发生明显变化,表明多效唑处理对土壤细菌和真菌群落的物种组成有一定影响。
2.4 α多样性和β多样性分析 α多样性是反映细菌和真菌群落多样性和丰富度的综合指标,比较样品的α多样性指数,(表2)和(表3)可知,T2时期D3处理和D30处理组Simpson指数相较于CK组分别显著降低了38.05%和24.77%,说明多效唑处理在一定程度上促进土壤细菌多样性增加。T4时期,与CK组相比,D3处理组土壤细菌Shannon指数显著下降9.14%,表明随着时间的延长,低浓度多效唑处理降低土壤细菌菌群多样性。不同浓度多效唑处理对土壤真菌的多样性影响不同,T2时期真菌菌群Shannon指数和Simpson指数没有显著区别,T4时期D3处理组土壤真菌Shannon指数显著增加22.75%,表明随着时间的延长,低浓度多效唑处理促进土壤真菌菌群多样性增加。
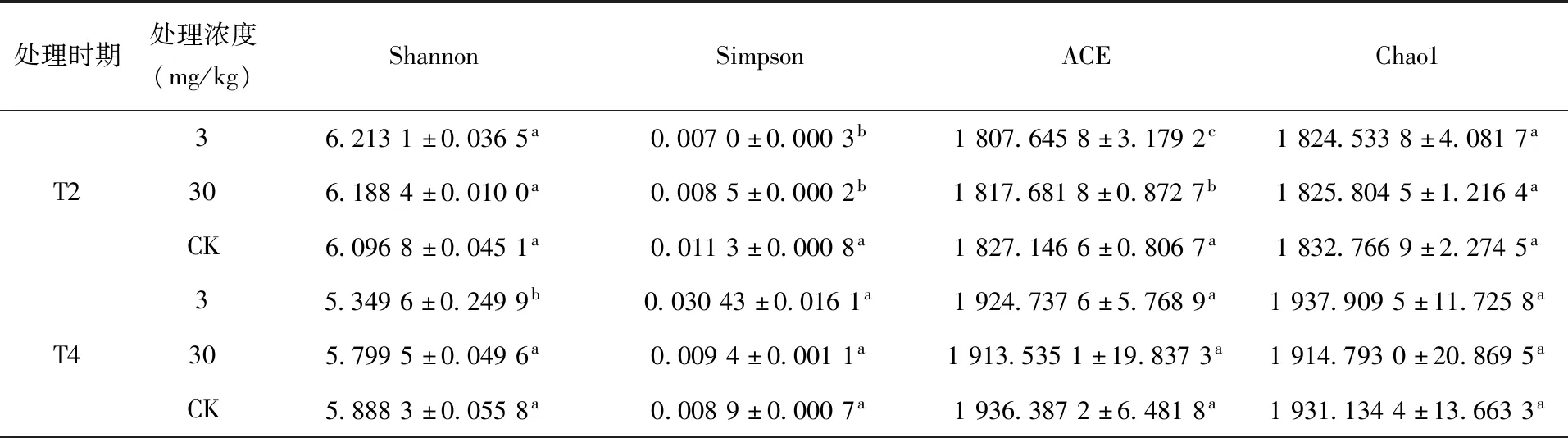
表2 细菌α多样性指数
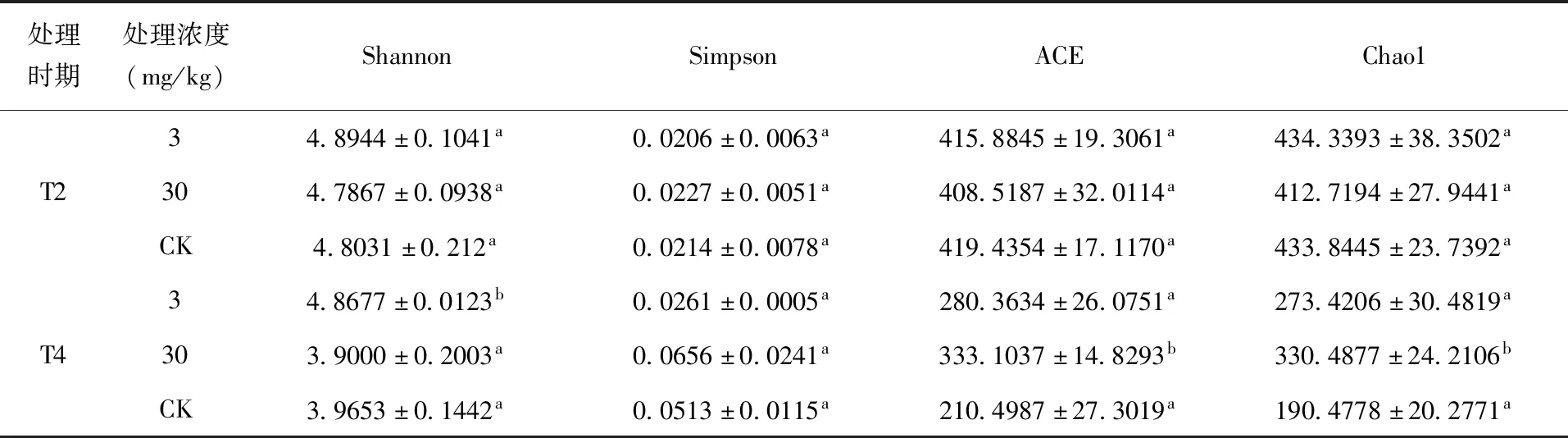
表3 真菌α多样性指数
T2时期,与CK组相比,D3和D30处理组土壤细菌ACE指数分别显著降低1.06%和0.52%,土壤真菌ACE指数和Chao1指数无显著区别。T4时期,与CK组相比,土壤细菌ACE指数和Chao1指数无显著区别,土壤真菌菌群D3处理组ACE 指数和Chao1指数相较于CK组分别增加了33.19%和43.54%,D30处理组ACE 指数和Chao1指数相较于CK组分别显著增加了58.24%和73.50%,处理后期土壤真菌丰富度表现出增高趋势。
对细菌和真菌β多样性进行分析。土壤细菌的PCoA分析结果(图2A)所示,T1至T3时期,各处理组与CK组距离不大,群落结构相似性高,T4时期处理组和CK组距离较远。说明处理前期,多效唑对细菌群落结构影响不大,T4时期多效唑改变了细菌群落结构,同时D30处理组和CK组在主成分2轴区分,说明随处理时间增加,高浓度多效唑处理对细菌群落结构产生较大影响。土壤真菌的PCoA分析结果(图2B)所示,T1时期处理组两个样本与CK组距离不大,说明此时处理组与CK组群落结构相似。T2、T3两个时期的CK组与多效唑处理组有一定距离,说明土壤真菌群落结构正在发生改变,T4时期处理组的样本均分布在主成分1轴的负轴,CK组分布在主成分2轴的正轴,多效唑处理组与CK组的真菌群落相似性不高,表明处理组和CK组土壤真菌群落结构差异明显。
2.5 微生物共现网络 基于Pearson在科水平上的相关性构建了土壤细菌和真菌互作网络(图3)。拓扑特性通常用于描述细菌和真菌相互关系的复杂模式[15]。在不同处理时期,不同的多效唑处理下,细菌和真菌的互作网络图节点和连接数发生了变化。T2时期,CK组网络共现图中节点数为318,而在D3和D30处理组中观察到307和315个节点(表4)。相比之下,CK组网络更复杂、连接更紧密。多效唑处理组网络的正相关比例降低,网络密度和网络图平均度也均 表4 拓扑特性 通过多效唑在热区土壤中降解率变化研究表明:多效唑具有较长的半衰期,可长期存在于土壤中。Bhattacherjee等人研究发现,当多效唑在土壤中的残留量为3.51mg/kg时,处理初期降解较快,后期逐渐变慢,其在土壤中残留可长达300d[16],与本文研究结果相似。施药150d后,低浓度多效唑处理组降解率低于高浓度多效唑处理组。多效唑在土壤中的降解率可能受到多种因素的影响。土壤微生物对多效唑的降解起重要作用,一些微生物可以降解多效唑,利用其作为碳源维持自身生长,微生物的组成和数量可以改变微生物降解土壤中多效唑速度[17-19]。当土壤中多效唑残留浓度较低时,微生物对多效唑的利用效率较低,可能利用其它有机物维持生长[20]。 土壤微生物在调节土壤养分循环、能量流动方面发挥着关键作用[21],微生物活性、多样性对土壤肥力和植物生长有一定影响[22-23]。研究多效唑对土壤微生物群落的影响,对热区农业生产具有重要意义。土壤微生物彼此之间存在复杂的关联网络[24],单一分析土壤细菌或真菌的群落结构变化和多样性不能全面评估施用多效唑对土壤微生物群落的影响。本文采用高通量测序技术研究了多效唑对热区土壤细菌和真菌的影响,同时构建土壤细菌和真菌互作网络,进一步分析了施用多效唑对微生物互作网络的影响。物种组成分析表明,经多效唑处理后,土壤细菌和真菌优势菌门和属的相对丰度发生变化,不同处理时期,变化程度和趋势不同。子囊菌门、壶菌门、担子菌门相对丰度都随着施药处理时间的延长而降低。施用多效唑150d后,放线菌门相对丰度均下降,芽单胞菌门、拟杆菌门相对丰度均增加。处理组曲霉菌属相对丰度随着处理时间的增加逐渐降低。Xu等[25]报道了曲霉属是对农药有降解作用的真菌属,曲霉菌属相对丰度升高,可能对多效唑原药起到一定降解作用。相对丰度>1%的土壤真菌优势菌属中包含镰刀菌属,伴随着一些有防治病害功能的菌属相对丰度降低,镰刀菌属的存在有可能会引起植物萎焉、根腐、穗腐等各种类型的植物病害发生[26]。但随着施药时间的延长,处理组镰刀菌属相对丰度下降,表明施用多效唑可能会减少作物受镰刀菌属侵害。 微生物共现网络越复杂代表微生物可利用的养分越高,微生物间相互作用加强,有助于菌群更有效地利用养分[27]。低浓度多效唑处理10d时促进了土壤细菌多样性增加,对真菌多样性与群落结构没有显著影响,同时降低了土壤细菌和真菌互作网络复杂程度。表明多效唑影响了微生物间相互作用,此外,网络图平均度下降、平均聚类系数的减少和平均路径长度的增加进一步证明了多效唑导致微生物之间的相互作用减弱,可能会阻碍养分的有效运输[28]。处理150d后,细菌菌群多样性降低,真菌菌群的多样性上升,微生物群落结构都发生变化,芽单胞菌门相对丰度增加,芽单胞菌门偏向于在营养不良的土壤中生存[15],表明此时可能土壤养分失衡,土壤养分变化导致了细菌和真菌多样性和群落结构发生变化[29]。处理后期细菌和真菌互作网络逐渐恢复,土壤细菌和真菌相互联系增加,真菌界与细菌界间相互作用的优势菌门属可能均发生改变。 高浓度多效唑处理持续影响土壤真菌群落结构,可能由于多效唑在结构上与三唑类杀菌剂类似,对真菌影响较大[8]。处理前期,土壤细菌和真菌互作网络复杂性降低,微生物之间的相互作用减弱,酸杆菌门相对丰度持续降低,酸杆菌门在与其它微生物互作中发挥着重要的作用[30],这些重要菌属的相对丰度改变,表明此时互作微生物可能正在发生较大改变。互作网络图中正相互作用减少,施用多效唑可能影响土壤微生物协同作用,引起不同群落对土壤养分竞争[31]。其他研究也发现,施用高剂量多效唑会对土壤养分有负面影响[32]。处理150d后,土壤细菌群落结构发生显著变化,真菌菌群丰富度显著上升,高浓度多效唑长期胁迫可能导致部分微生物死亡,进而成为碳源促进真菌生长[33]。随着施药时间的延长,高浓度多效唑对细菌和真菌群落间相互作用的干扰不断减少,细菌和真菌互作网络逐渐恢复到CK组水平,正相互作用增加,土壤细菌和土壤真菌菌群协同作用加强,可能利于土壤中多效唑的降解。也有其他研究发现,细菌和真菌的协同作用可促进土壤环境中多环芳烃降解[34]。细菌在土壤微生物群落中所占的比例较大,群落结构较稳定,其通过与真菌直接或间接的相互作用可能会促进微生物群落的恢复。 施用多效唑会改变土壤细菌和真菌群落组成,如能改变变形菌门、酸杆菌门、子囊菌门、壶菌门的相对丰度。多效唑处理可降低土壤细菌和真菌互作网络的复杂度。随着处理时间的延长,低浓度处理会降低土壤细菌菌群多样性,并导致土壤细菌和真菌群落结构都发生变化;高浓度多效唑处理对真菌群落结构会造成一定影响,同时也对细菌和真菌互作网络造成干扰,影响细菌和真菌的相互作用。施用推荐浓度和高浓度的多效唑都可能会在土壤中长期残留,导致土壤微生物多样性和微生物群落结构发生显著变化。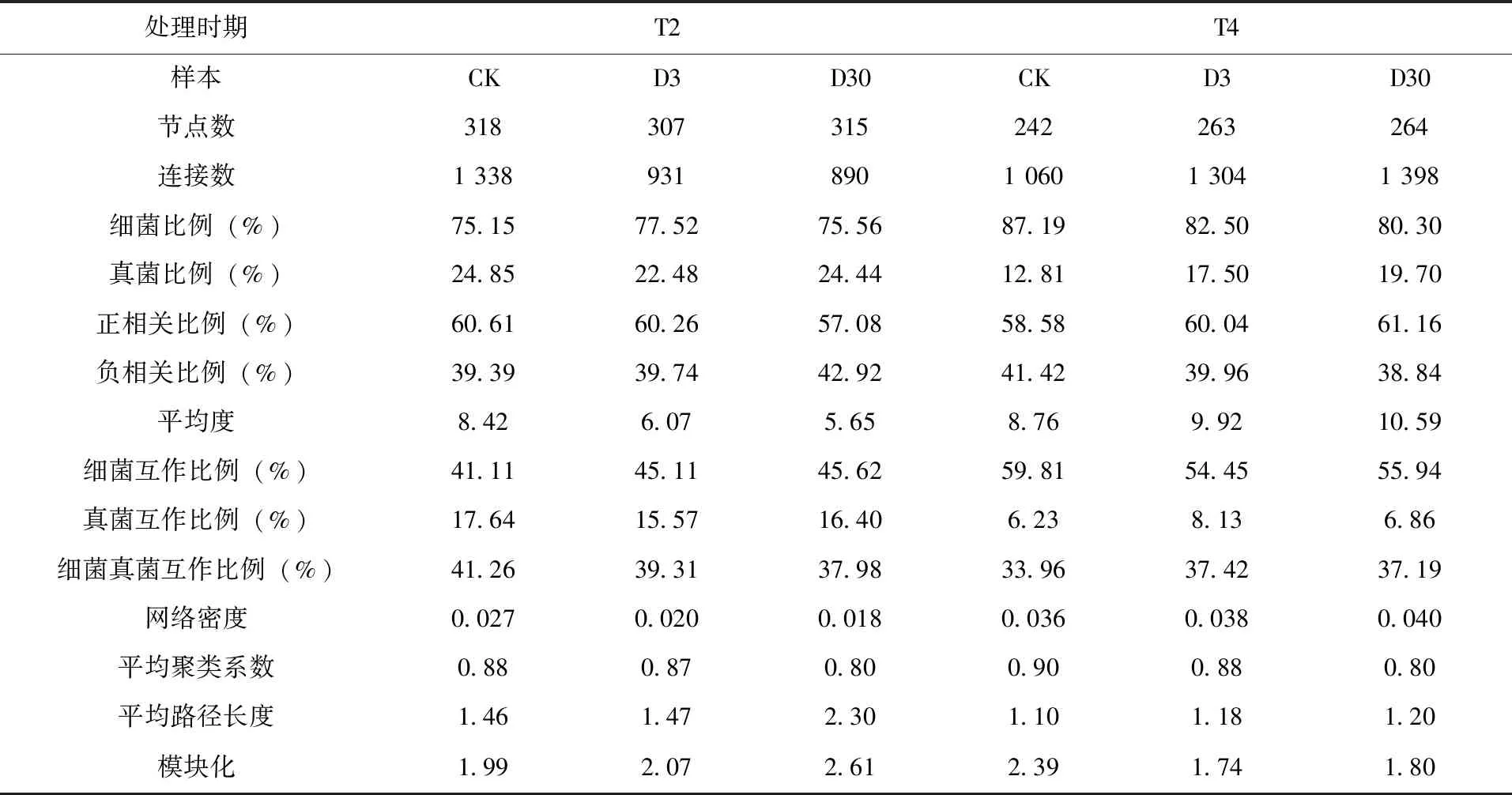
3 讨论
4 结论
