手术创伤对2 型糖尿病小鼠术后认知功能和脑葡萄糖代谢的影响
2021-01-14崔永晨张俊峰
罗 钢,崔永晨,曹 越,张俊峰
上海交通大学附属第六人民医院麻醉科,上海200233
术后认知功能障碍(postoperative cognitive dysfunction,POCD)是麻醉手术后常见的中枢神经系统并发症。术后认知研究国际协作组最近建议将POCD 更名为围术期神经认知障碍(perioperative neurocognitive disorders,PND),指术前与术后12 个月内发生的包括术后谵妄在内的所有围术期认知功能改变[1]。因本实验仅研究术后出现的以学习记忆功能下降为主要表现的神经认知功能障碍,故仍采用POCD 这一术语。POCD 可导致患者长期的认知、学习和记忆功能障碍,影响患者的生活质量,增加患者及社会的医疗负担和费用[2-3],但其发病机制目前尚未阐明。随着老龄化社会的到来,每年有超过30%的65 岁以上老年人经历手术创伤,所以POCD 所带来的健康问题和经济负担将会逐年加重[4],因此研究POCD 的发病机制具有重要的临床和社会意义。
糖尿病是认知功能受损的独立危险因素之一,合并糖尿病时POCD 的发生率明显增高[5]。动物实验[6]已证实糖尿病小鼠更容易发生POCD,其原因在于手术创伤导致糖尿病本身存在的中枢神经炎症反应加重。最新研究[7]显示小胶质细胞需通过改变其糖代谢功能维持其经典致炎途径的激活状态,进而释放大量炎症介质导致中枢神经炎症反应。然而,手术创伤诱导的小胶质细胞激活伴随的糖代谢功能改变是否参与POCD 的发生目前还不明确。
正电子发射型计算机断层显像(positron emission tomography/computed tomography,PET/CT)是一种基于放射性核素显像的功能成像技术,目前已被广泛应用于认知功能的机制研究[8]。通过对葡萄糖类似物18F-氟代脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)的追踪显影,PET/CT 可以客观展现脑内葡萄糖代谢的功能变化。本研究拟采用行为学及PET/CT 影像学技术,观察手术创伤对2 型糖尿病小鼠学习记忆功能影响及相关脑区葡萄糖代谢水平的变化,初步探讨POCD 发生的能量代谢机制。
1 对象与方法
1.1 2 型糖尿病小鼠模型的建立及分组
SPF 级C57BL/6 野生型雄性小鼠40 只,4 周龄,体质量(16±2)g,购自上海斯莱克实验动物责任有限公司,生产许可证号为SCXK(沪)2017-0005;小鼠饲养于上海交通大学附属第六人民医院实验动物中心,使用许可证号为SCXK(沪)2016-0020,小鼠常规饲养,自由饮食饮水,饲养温度约为25 ℃。操作规范均遵照《医学实验动物管理实施细则》《国家实验动物管理条例》,并通过上海交通大学附属第六人民医院动物伦理委员会批准。
参照文献[9]的方法,选取4周龄小鼠,常规饮食适应性喂养1周后开始60%高脂饲料喂养。高脂饮食喂养第5 周,小鼠禁食16 h 后腹腔注射烟酰胺240 mg/kg,15 min 后腹腔注射链脲佐菌素(用pH 4.5 的柠檬酸柠檬酸钠缓冲液溶解)60 mg/kg,1 次/d(烟酰胺+链脲佐菌素),连续注射3 d。末次注射后72 h 检测空腹血糖(禁食12 h) ≥ 11.1 mmol/L 表示2型糖尿病模型造模成功。最终本实验获得成功建模的2 型糖尿病小鼠30 只,记录小鼠体质量及一般情况,然后分2 批进行实验。第1 批选择模型小鼠20 只,随机分为对照组和腹部手术创伤组(手术组),10 只/组,用于术后行为学测试。术前将小鼠放入条件恐惧测试箱中进行适应性训练,由测试者从饲养盒轻柔抓取和放回,每日适应5 min,连续3 d;术后第3 日检测空腹血糖水平。为确保术后学习记忆功能和脑影像学功能改变时间上的一致性,第2 批10 只模型小鼠同样随机分为对照组和手术组,5 只/组,在术后第3 日进行脑部PET/CT 的检测。
1.2 腹部手术创伤小鼠模型的建立
参照文献[10-11]的方法构建腹部手术创伤小鼠模型。采用4%异氟烷吸入麻醉诱导,2%异氟烷面罩吸入麻醉维持(氧流量1 L/min)。术中持续监测血氧饱和度和呼吸(美国Datex-Ohmeda 监护仪),避免低氧和呼吸抑制。小鼠仰卧固定于37 ℃恒温加热板上。常规消毒铺巾,腹部正中做一长约1.5 cm 的切口,充分暴露肠管后钝性游离肠系膜上动脉,用微血管夹夹闭肠系膜上动脉一级分支30 min 后开放,然后用无菌丝线缝合肌肉筋膜和皮肤,整个手术过程持续约45 min。术毕皮下注射生理盐水(36 ℃,1 mL)+舒芬太尼(1 μg/kg),之后每隔12 h注射1 次,共注射3 次。对照组小鼠采用100% O2吸入45 min。术后48 h 进行条件恐惧记忆实验的训练,术后第3 日分别进行旷场实验和条件恐惧记忆实验行为学测试。
1.3 旷场实验
术后第3 日进行旷场实验,采用自发活动记录分析系统(美国Coulbourn,ACT-300A)观察小鼠的运动和探索行为。将小鼠放入实验箱(30 cm×30 cm×40 cm)中部开始自由探索5 min,视频录像后自动分析小鼠的运动总路程和中央格穿越次数。每只小鼠测试后使用75%乙醇清洗实验箱。
1.4 条件恐惧记忆实验
分为训练、场景相关性记忆测试和声音相关性记忆测试3 个阶段,同样采用自发活动记录分析系统。每只小鼠测试后使用75%乙醇清洗测试箱。
(1)训练阶段 术后48 h 将小鼠放在测试箱中适应180 s 之后,给予30 s 的声音刺激(80 dB,3 600 Hz),声音刺激的最后2 s 给予足底电击(0.8 mA),此训练重复3次。然后继续停留30 s 后放回饲养笼。训练阶段在阴暗环境下进行。
(2)场景相关性记忆测试 小鼠于训练阶段完成24 h后(即术后第3 日),将小鼠放入测试箱中观察360 s,场景与训练时完全相同,不予声音和电刺激,视频录像后自动分析小鼠的僵直反应时间。测试结束放回饲养笼。通过Freeze Frame 4 软件进行结果分析。计算总时相中小鼠的僵直反应时间占总观察时间的比例用于评估小鼠的记忆 功能。
(3)声音相关性记忆测试 场景相关性记忆测试后2 h,将小鼠被放入场景完全改变的测试箱(包括形状、颜色、气味及明暗)中观察360 s,期间随机给予与训练阶段相同的声音刺激3 次,每次持续60 s,视频录像后自动分析小鼠的僵直反应时间。通过Freeze Frame 4 软件进行结果分析。计算声音刺激时相中小鼠的僵直反应时间占总观察时间的比例,用于评估小鼠的记忆功能。
1.5 PET/CT 检测
对照组和手术组小鼠在术后第3 日进行PET/CT 检查。检查前小鼠禁食12 h,以减少或避免因血糖因素对18F-FDG 在小鼠脑内代谢分布的影响。尾静脉注射300 μCi18F-FDG 30 min 后,5%异氟烷麻醉小鼠,俯卧位固定于带保温装置的扫描板上,采用Siemens Inveon MicroPET/CT 成像系统进行头部显像。扫描视野包含小鼠整个脑部及颈部,采用3D 模式采集图像,滤波反投影法重建小鼠轴面、矢状面、冠状面断层图像进行分析,通过PMOD软件(PMOD Technologies,瑞士)进行PET/CT 图像融合并分析18F-FDG 在小鼠各脑区平均摄取率。
1.6 统计学分析
2 结果
2.1 一般资料
与对照组相比,手术组小鼠的体质量[ (34.067± 3.678) g vs (33.467±2.579) g,P=0.810]、 术前血糖[ (13.633±2.156) mmol/L vs (13.620±1.807) mmol/L,P=0.791]和术后第3 日血糖[ (13.514±2.812) mmol/L vs (13.746±2.418) mmol/L,P=0.814]差异均无统计学意义。
2.2 旷场实验
旷场实验结果(图1)显示,2 组小鼠的中央格穿越次数和运动总路程差异均无统计学意义(均P>0.05)。
2.3 条件性恐惧实验
与对照组比较,手术组术后第3 日场景相关性记忆测试和声音相关性记忆测试中僵直时间比例均显著降低(均P<0.05,图2)。

图1 旷场实验的中央穿越格次数(A)和总移动距离(B)的比较Fig 1 Comparison of number of central grid crossings (A) and total moving distance (B) in open field experiment

图2 条件性恐惧实验场景测试和声音测试僵直时间比例的比较Fig 2 Comparison of freezing time ratio in contextual test and tone-related test in fear conditioning experiment
2.4 18F-FDG 在各脑区的平均摄取率
基于PET/CT 融合图像,采用相同色标,由黑色到红色依次显示由低到高的18F-FDG 摄取率。结果显示,手术组小鼠海马(hippocampus,HIP)、皮质(cortex,CTX)、纹 状 体(corpus striatum,CPu) 和 杏 仁 核(amygdala,AMY)的18F-FDG 平均摄取率均显著高于对照组(均P<0.05);小脑(cerebellum,CB)、中脑(midbrain,MID)的平均摄取率的组间比较差异无统计学意义(均P>0.05)(图3)。
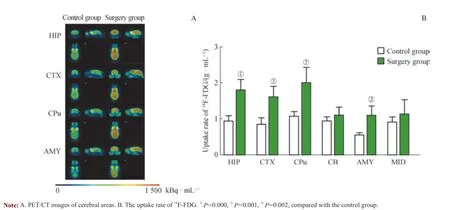
图3 小鼠各个脑区对18F-FDG 的摄取率Fig 3 Uptake rate of 18F-FDG in each brain region of mice
3 讨论
条件性恐惧实验是评估术后认知功能障碍的有效方法,其中场景相关性记忆主要检测海马相关性记忆功能,而声音相关性记忆则可以检测杏仁核、纹状体及前额皮质(prefrontal cortex,PFC)等海马非依赖性记忆功能[12]。本研究结果显示,2 型糖尿病小鼠手术后第3 日在条件性恐惧实验中的场景相关性记忆测试及声音相关性记忆测试中的僵直反应比例均较对照组明显缩短,说明手术创伤可导致糖尿病小鼠术后海马相关性和非海马相关性记忆 受损。
本项目组前期研究[13]表明麻醉手术创伤引起的中枢神经炎症反应是POCD 发生的重要原因,而小胶质细胞激活释放炎症介质在此过程中扮演着重要角色。Gimeno-Bayón 等[14]研究发现,小胶质细胞被炎症刺激激活后出现糖代谢功能的改变,表现为由氧化磷酸化代谢转变为有氧糖酵解代谢状态,这种现象被称为代谢重编程(metabolic reprogramming)。糖代谢重编程的意义在于:①更加快速地为激活状态的小胶质细胞提供能量。②有氧糖酵解的中间代谢物可以为激活状态的小胶质细胞合成炎症介质等活性物质提供重要的前体。并且有研究[7]证实改变小胶质细胞的能量状态可有效调控其激活状态。Hovens 等[15]研究发现,手术创伤后1 周内可观察到海马、纹状体、杏仁核及前额皮质等脑区的小胶质细胞激活。本研究采用脑部18F-FDG PET/CT 检查发现术后第3 日海马、杏仁核、纹状体和皮质脑区的葡萄糖摄取率显著增加,提示手术创伤导致2 型糖尿病小鼠术后相应脑区的葡萄糖代谢增强。由此可见,手术创伤导致2 型糖尿病小鼠认知功能障碍、小胶质细胞激活状态及脑糖代谢功能改变在时间和空间上的相关性,提示手术创伤诱导的小胶质细胞激活所伴随的脑部能量状态改变是导致POCD 发生的可能机制。
本研究也存在一些不足之处:①由于POCD 机制尚不明确,POCD 动物模型的建立缺乏公认的标准,目前国内外学者倾向于通过动物组间行为学差异来判断认知功能变化。本研究根据临床实践结合文献报道选择了腹部创伤手术模型,行为学结果也证实了该模型建立的有效性。② 本研究并未比较术后认知功能和脑糖代谢功能在糖尿病小鼠和正常小鼠之间的差异,但已有文献报道糖尿病可加重手术创伤导致的POCD 和海马炎症反应[16-17]。考虑到糖尿病本身合并糖代谢紊乱,糖尿病手术患者更加容易发生POCD,我们以2 型糖尿病小鼠为研究对象探讨POCD 和脑糖代谢功能改变之间的关系就更具有临床意义。③手术创伤可能会导致应激性高血糖,本研究并未监测术中及术后早期的血糖水平改变,但本研究监测了术前及术后第3日的血糖水平,结果显示组间均无明显差异,由此可以排除术后第3 日血糖水平变化对脑糖代谢功能的影响。④本研究仅观察到2 型糖尿病小鼠POCD 和认知功能相关脑区的糖代谢异常在时间和空间上的相关性,但并不能充分证明两者之间的因果关系,未来还需要通过糖代谢重编程的干预性研究予以明确。然而,本研究从脑能量代谢功能异常方面探索POCD 的机制,为该疾病的研究提供了新视角。
综上所述,2 型糖尿病小鼠术后出现的认知功能障碍可能与手术创伤导致的学习记忆相关脑区葡萄糖代谢功能异常有关,其具体调控机制还有待进一步研究明确。
参·考·文·献
[1] Evered L, Silbert B, Knopman DS, et al. Recommendations for the nomenclature of cognitive change associated with anaesthesia and surgery-2018[J]. Br J Anaesth, 2018, 121(5): 1005-1012.
[2] Newman MF, Kirchner JL, Phillips-Bute B, et al. Longitudinal assessment of neurocognitive function after coronary-artery bypass surgery[J]. N Engl J Med, 2001, 344(6): 395-402.
[3] Steinmetz J, Christensen KB, Lund T, et al. Long-term consequences of postoperative cognitive dysfunction[J]. Anesthesiology, 2009, 110(3): 548-555.
[4] Sprung J, Roberts RO, Knopman DS, et al. Association of mild cognitive impairment with exposure to general anesthesia for surgical and nonsurgical procedures: a population-based study[J]. Mayo Clin Proc, 2016, 91(2): 208- 217.
[5] Abbatecola AM, Paolisso G. Relationship between baseline glycemic control and cognitive function in individuals with type 2 diabetes and other cardiovascular risk factors: the action to control cardiovascular risk in diabetesmemory in diabetes (ACCORD-MIND) trial[J]. Diabetes Care, 2009, 32(8): e102-e103.
[6] Terrando N, Eriksson LI, Ryu JK, et al. Resolving postoperative neuroinflammation and cognitive decline[J]. Ann Neurol, 2011, 70(6): 986-995.
[7] Ghosh S, Castillo E, Frias ES, et al. Bioenergetic regulation of microglia[J]. Glia, 2018, 66(6): 1200-1212.
[8] Sperling RA, Dickerson BC, Pihlajamaki M, et al. Functional alterations in memory networks in early Alzheimer's disease[J]. Neuromolecular Med, 2010, 12(1): 27-43.
[9] 张伟云, 陈全成, 王丽荣, 等. 泽泻降低2 型糖尿病小鼠血糖的有效部位筛选[J]. 上海中医药杂志, 2016, 50(10): 81-85.
[10] He HJ, Wang Y, Le Y, et al. Surgery upregulates high mobility group box-1 and disrupts the blood-brain barrier causing cognitive dysfunction in aged rats[J]. CNS Neurosci Ther, 2012, 18(12): 994-1002.
[11] Huang CX, Chu JM, Liu Y, et al. Varenicline reduces DNA damage, tau mislocalization and post surgical cognitive impairment in aged mice[J]. Neuropharmacology, 2018, 143: 217-227.
[12] Maren S, Phan KL, Liberzon I. The contextual brain: implications for fear conditioning, extinction and psychopathology[J]. Nat Rev Neurosci, 2013, 14(6): 417-428.
[13] Zhang J, Jiang W, Zuo Z. Pyrrolidine dithiocarbamate attenuates surgeryinduced neuroinflammation and cognitive dysfunction possibly via inhibition of nuclear factor κB[J]. Neuroscience, 2014, 261: 1-10.
[14] Gimeno-Bayón J, López-López A, Rodríguez MJ, et al. Glucose pathways adaptation supports acquisition of activated microglia phenotype[J]. J Neurosci Res, 2014, 92(6): 723-731.
[15] Hovens IB, Schoemaker RG, van der Zee EA, et al. Postoperative cognitive dysfunction: involvement of neuroinflammation and neuronal functioning[J]. Brain Behav Immun, 2014, 38: 202-210.
[16] Feng XM, Valdearcos M, Uchida Y, et al. Microglia mediate postoperative hippocampal inflammation and cognitive decline in mice[J]. JCI Insight, 2017, 2(7): e91229.
[17] Zhang X, Dong HQ, Zhang SS, et al. Enhancement of LPS-induced microglial inflammation response via TLR4 under high glucose conditions[J]. Cell Physiol Biochem, 2015, 35(4): 1571-1581.
