小飞蓬捕光叶绿素结合蛋白基因CcLhca-J9克隆及表达分析
2021-01-14李祖任罗丁峰柏浩东徐晶晶韩进财徐强王若仲柏连阳
李祖任,罗丁峰,柏浩东,徐晶晶,韩进财,徐强,王若仲,柏连阳,✉
1湖南省农业科学院杂草生物学及安全防控生物学湖南省重点实验室,长沙 410125;2湖南农业大学植物激素与生长发育湖南省重点实验室,长沙 410128
0 引言
【研究意义】小飞蓬(Conyza canadensis)为菊科(Asteraceae)飞蓬属(Conyza)的一种具较强繁殖和环境适应能力的入侵杂草,主要分布于果、桑、茶园、草坪和荒地[1]。小飞蓬已对草甘膦、草铵膦、莠去津等多种化学除草剂产生不同程度的抗药性,例如浙江宁波的两个抗草甘膦种群抗性指数分别达8.28和7.92[2-3]。据报道,当小飞蓬1 m2发生数为72株时,油菜角果数、角果籽粒数显著下降,产量下降达35.93%,可见恶性杂草小飞蓬给农业生产带来较大的经济损失[4]。植物化感物质的挖掘和利用是开发植物源除草剂的有效途径,是治理小飞蓬等抗药性杂草的热点方向之一[5]。发掘新颖生物源化合物结构、除草作用机制和靶标,阐明活性化合物与杂草相互作用机制,利用生物除草关键基因资源,可最终克服生物除草剂产品发展的成本与环境制约因素[6]。【前人研究进展】目前,以天然产物为基础研发的生物除草剂的作用机制主要有五大类,但是许多天然产物的抑草作用靶点和分子机制仍然是未知的[7]。光合系统是除草剂作用的重要靶标之一,其中光系统I和光系统II是吡啶类和三嗪酮类除草剂的靶标[8]。链霉菌(Streptomycesspp.)产生的多肽L-phosphinothricin抑制谷氨酰胺合成酶,链格孢菌(Alternari alternata)产生的细交链孢菌酮酸(tenuazonic acid,TeA)阻断光合系统 II[9-10]。上述抑草靶标的发现,为生物除草剂的开发提供了科学依据。羊脂酸分子式为C8H16O2,油状液体不溶于水,属于有机酸类化合物,主要用于染料、防腐剂、杀菌剂[11]。笔者所在课题组前期从椰子中分离提取出羊脂酸,并验证其为一种具有广谱、高效抑草活性的植物源化合物,具有开发成为植物源除草剂的潜力[12]。采用透射电镜技术观察到羊脂酸处理小飞蓬叶片后,叶绿体和线粒体结构随着作用时间的延长出现了空腔、裂解的现象[13]。采用 Lable-free蛋白质组学技术分析羊脂酸处理小飞蓬叶片,发现LHC蛋白(UniProt ID:A0A103Y9J9)响应了羊脂酸处理,并与光合指标测定结果相一致,但该蛋白是否为羊脂酸抑制小飞蓬的靶标蛋白仍需进一步研究[14]。捕光叶绿素a/b结合蛋白(light harvesting chlorophyll a/b-binding protein,LHC)是光系统 I和光系统 II中获取光能并将其传送至光反应中心的色素蛋白复合体[15]。在高等植物体内,编码LHC(LHCI、LHCII)蛋白是一个多基因家族,定位于细胞核内;LHCI蛋白由Lhcal、Lhca2、Lhca3和Lhca4基因编码,LHCII蛋白由Lhcbl、Lhcb2、Lhcb3、Lhcb4、Lhcb5和Lhcb6基因编码[16]。随着分子克隆和基因测序技术的发展,部分植物的LHC蛋白基因已被克隆出来,例如拟南芥(Arabidopsis thaliana)、橡胶树(Hevea brasiliensis)、籼稻9311(Oryza sativa)[17-19]。【本研究切入点】目前的研究大部分集中在各植物 LHC蛋白及其基因的表达差异、功能解析等,对于LHC蛋白与抑草活性胁迫相关的功能解析研究较少[20]。【拟解决的关键问题】通过分子克隆和生物信息学等技术全面阐释小飞蓬捕光叶绿素a/b结合蛋白基因(CcLhca-J9)的分子特征,解析羊脂酸处理下该基因表达的特殊性,预测羊脂酸作用LHC蛋白的关键位点,为后续基因功能验证打下基础,同时为植物源羊脂酸产品研发提供科学依据。
1 材料与方法
1.1 供试材料
小飞蓬种子2018年9月采集于湖南省长沙市芙蓉区湖南省农业科学院院内荒地并保存于种子超干低湿存储柜(购于北京明日百傲生物科技有限公司),选出饱满种子用0.4%赤霉素溶液催芽后,挑选吐白的种子移入塑料盆钵(内径20 cm),置于光照培养箱(8 h黑暗、温度 18℃/16 h光照、光强 100—120 μmol·m-2·s-1、温度 20℃)培养至三叶期待用。羊脂酸(纯度99%)采用蒸馏萃取法自制,具体制备方法参考文献[12]。
1.2 CcLhca-J9的克隆
从NCBI中选择保守性高的Lhca基因同源序列设计简并引物CcJ9-1(表1),进行PCR扩增获取目的基因片段。PCR反应程序:94℃预变性5 min;94℃变性30 s,55℃退火30 s,70℃延伸30 s,循环30次;70℃延伸7 min。凝胶电泳检测PCR产物,切胶回收纯化目的片段,连接到pCambia2301载体,连接转化大肠杆菌 DH5α(购于南京诺唯赞生物科技有限公司),挑取阳性克隆送上海生工生物工程有限公司测序[17]。根据已知目的片段设计5′和3′ RACE特异引物(表1),采用TaKaRa公司Clonetech SMARTer RACE 5′/3′ Kit扩增试剂盒说明扩增。获得Lhca的 5′ RACE序列、核心序列及3′ RACE序列,根据三者拼接后序列设计引物(表1)确定CcLhca-J9全长。
1.3 生物信息学分析
采用DNAMAN分析核酸序列并检测编码氨基酸序列,ExPaSy在线预测分子量和等电点(molecular weight/isoelectric point,MW/pI),在 NCBI中搜索LHC的高相似度氨基酸序列,选取19个典型的植物蛋白,先用ClustalX软件多序列比对,再用MEGA 4.1软件的邻接法(neighbor-joining,NJ)构建进化树[21]。利用 SWISS-MODEL在线搜索与选择模板,再通过Swiss-PdbViewer软件优化模型结构[22]。
1.4 分子对接
采用上一步 LHC同源建模结果作为模型来寻找羊脂酸与LHCI-J9蛋白的对接方式。在AutoDock 4.2软件上运行,电荷计算采用 RESP(Restrained electrostatic potential)法;活性位点采用AutoGrid格式点搜索,网格大小为60Å×40Å×60Å,格点间隔为1.0Å。中心设定为配体在LHC中的质心;采用LGA(Lamarckian genetic algorithm)法计算配体与受体间的自由能,其余参数均为缺省值[23]。在最终得到的10个最优构象中,选取能量值最低的构象作为进一步研究对象。
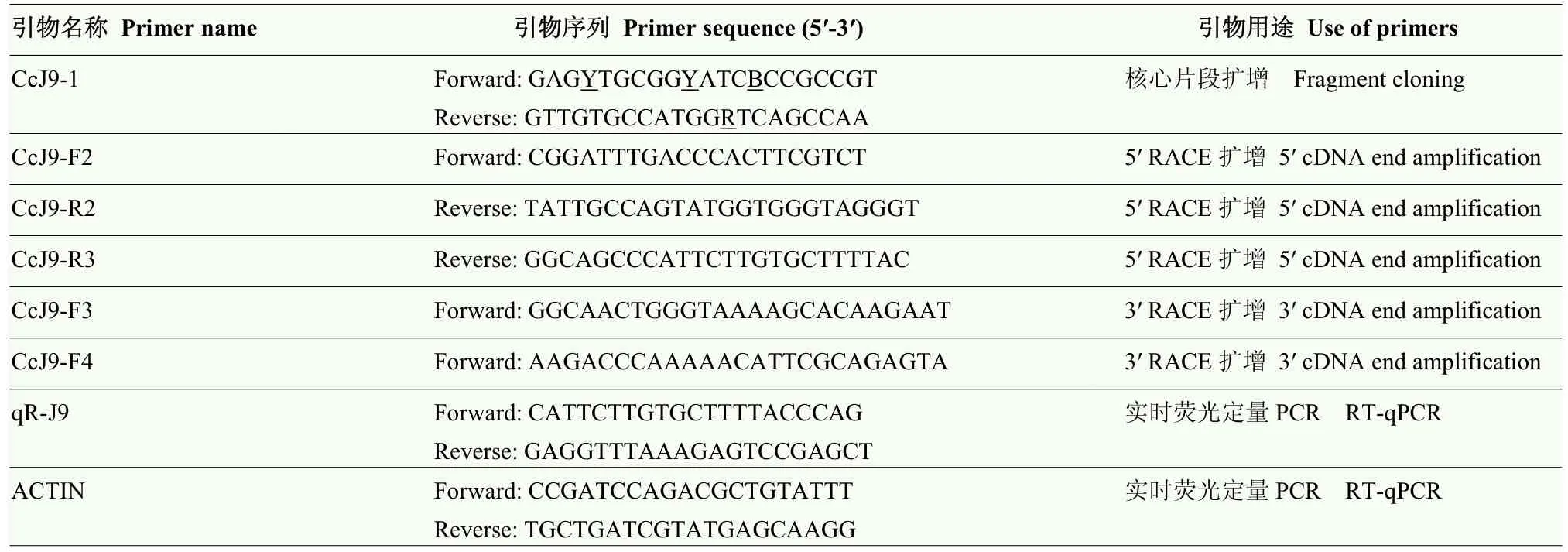
表1 CcLhca-J9克隆及实时荧光定量PCR表达引物Table 1 The primers used for CcLhca-J9 cloning and RT-qPCR
1.5 CcLhca-J9响应羊脂酸的表达分析
用羊脂酸(625 μmol·L-1)、阿魏酸(625 μmol·L-1)和清水对照各10 μL,兑水10 mL,喷雾处理小飞蓬叶片0、0.5、1、2、4、8 h后,收集新鲜叶片立即置于液氮。参照 Trizol改良法提取小飞蓬叶片总RNA,反转录合成第一链cDNA。RT-qPCR反应体系 20 μL:SYBR Premix ExTaqTM10 μL、引物(R和 F)0.5 μL、cDNA 5 μL、ddH2O 4 μL。反应程序:95℃ 30 s,58℃ 20 s,循环40 次。所用引物为目的基因特异性引物qR-J9和内参基因Actin引物(表1)。数据处理运用 2-ΔΔCT法,比较目的基因的表达水平[24]。利用SPSS软件中Duncan氏新复极差法进行差异显著性分析。
2 结果
2.1 CcLhcIa-J9序列的获得
以反转录未施药的小飞蓬叶片cDNA为模板,用简并引物CcJ9-1进行PCR扩增、回收和测序,获得CcLhca-J9核心序列483 bp(图1-A)。用引物Cc-F2、Cc-R2、Cc-R3、Cc-F3和Cc-F4进行三轮PCR扩增,产物经回收和测序,获得cDNA 5′端序列428 bp和3′端序列253 bp(图1-B)。将5′ RACE序列、核心序列及 3′ RACE序列用 DNAMAN 软件拼接,获得CcLhca-J9cDNA序列全长(图2)。
2.2 CcLhcIa-J9生物信息学分析
经同源克隆和 RACE克隆,获得了CcLhca-J9的全长cDNA序列,该基因阅读框长744 bp,编码247个氨基酸(图2)。编码蛋白分子质量为26.766 kD,理论等电点为6.43;该蛋白中25个丙氨酸,占总数的 10.1%;其次是脯氨酸和甘氨酸,分别为 24和23个,各占9.7%和9.3%。CcLhca-J9蛋白保守区预测显示,该蛋白属于Chloroa_b-bind家族,具有典型的捕光叶绿素a/b结合蛋白功能(图3)。系统进化结果表明,不同物种来源的Lhca蛋白在分属不同分支,CcLhca-J9蛋白与除虫菊(GEW73959.1,Tanacetum cinerariifolium)和黄花蒿(PWA35049.1,Artemisia annua)Lhca蛋白进化程度最为接近,同处于菊科这一分支(图4)。预测二级结构发现,蛋白具有螺旋(Hh)97个,占39.27%;β转角(Tt)7个,占2.83%;延伸链(Ee)9个,占3.64%;无规则卷曲(Cc)134个,占54.25%(图5)。LHC-J9蛋白以4y28.1.O(2.80Å)为模板进行同源建模,序列相似度为 89.9%,高度同源结构,GEQE=0.75,QMEAN=-2.20,可见所获得的模型质量是较为可靠的。CcLhca-J9蛋白是单分子物体,具有6个叶绿体a配体,是一个典型的捕光复合物I叶绿素a/b结合蛋白(图6)。
2.3 分子对接
分子对接的计算结果显示(图 7),羊脂酸与CcLhca-J9蛋白形成氢键和p-π的作用力共同影响了两者之间的结合,其结合能量为-20.9 kJ·mol-1。羊脂酸的羰基氧原子与 Gly68氨基酸残基形成氢键,键长为2.9Å;Phe67和Phe69中氮原子与羊脂酸的碳氧双键形成p-π,距离均为3.1Å;羊脂酸的羟基氢原子与Arg197氨基酸残基形成氢键,键长为 2.4Å;羊脂酸的羟基氧原子与Arg197氨基酸残基形成p-π,键长为3.3Å。
2.4 羊脂酸处理对CcLhca-J9 表达的影响
RT-qPCR结果表明,在羊脂酸处理小飞蓬叶片后0—8 h,CcLhca-J9表达量明显下降。羊脂酸处理后0.5—1 h,CcLhca-J9的表达量与清水对照相比下降了66.01%;羊脂酸处理后2 h,CcLhca-J9的表达量缓慢下降,与对照相比下降了 82.72%;4—8 h 后,CcLhca-J9的表达量趋于稳定,与对照相比下降 92%—93%(图8)。羊脂酸处理后,CcLhca-J9表达量与对照相比呈下调趋势,此结果与前期蛋白质组学结果一致。清水对照和另一有机酸类化合物阿魏酸处理小飞蓬叶片,CcLhca-J9表达量总体未出现显著变化。
3 讨论
植物LHC蛋白家族基因是细胞核内的光合系统基因,其编码的蛋白与色素形成的复合物能捕获光能并传递能量至光化学反应中心[16]。本研究采用RACE技术克隆获得小飞蓬叶片LHC蛋白家族基因成员CcLhca-J9cDNA序列,其OFR全长为744 bp,编码247个氨基酸,分子量为26.766 kD,理论等电点为6.43;二级结构具有螺旋、β转角、延伸链、无规则卷曲;以4y28.1.O(2.80Å)为模板进行同源建模,三级结构是单分子物体,具有6个叶绿体a配体,是一个典型的捕光复合物I叶绿素a/b结合蛋白。系统进化分析表明,与除虫菊和黄花蒿Lhca蛋白进化程度最为接近,同处于菊科这一分支,一致性超过85%,表明该基因家族保守性较强。比对已报道的植物LHC蛋白,发现它们均无信号肽,存在跨膜区,含有结构功能域,为亲水性非分泌蛋白[25-26]。
植物LHC表达与抗逆性密切相关。YANG等[27]研究表明,与野生型相比,稀脉浮萍(Lemna perpusilla)的细胞色素b6f突变体在低光强下可维持LHC II在一个恒定的低水平上;李真等[28]研究发现,东南景天(Sedum alfredii)的SaLhcb2在镉、铜、铅处理后,根、茎、叶中表达量相比对照均发生显著上调或者降低;YANG等[29]研究发现,菠菜(Spinacia oleracea)N-端LHCII可识别蛋白降解酶,通过降解LHCII的含量可达到响应不同光强。本研究qPCR结果显示,羊脂酸胁迫处理小飞蓬叶片后,CcLhca-J9的表达量在处理后0—8 h随时间延长表现出下降的趋势。与对照清水和阿魏酸处理相比,羊脂酸抑制CcLhca-J9的表达存在着一定的特异性,预示着LHC可作为抑草靶标用来开发除草剂。
植物LHC是一类潜在的植物源除草剂作用靶标。光合作用抑制剂的开发一直是农药学家创制新型除草剂的热门方向,但是建立在充分研究受体蛋白结构与抑制剂相互作用的前提下[30]。去草净(terburyn)是一种典型三嗪类 PSII抑制剂,与 D1蛋白氨基酸残基Ile224和Ser233形成氢键,与Glu212、Val220和Ile229也有反应[31]。敌草隆(diuron,DCUM)的芳香取代基与 Phe255形成氢键,提高了其抑制活性[32]。TeA是一种从链格孢菌里分离提取出来的抑制PSII的除草化合物,其作用机制也是与靶蛋白D1的相互作用有关[33]。本研究采用分子对接的手段,发现羊脂酸与植物LHC中氨基酸残基Gly68、Phe67、Phe69和Arg197形成氢键和p-π键,其结合能量为-20.9 kJ·mol-1,两者存在较强的作用力,羊脂酸具有开发成光合作用抑制剂类除草剂的潜力。
4 结论
CcLhca-J9是一个典型的捕光复合物I叶绿素a/b结合蛋白,与羊脂酸结合形成氢键和 p-π键,同时CcLhca-J9表达量在羊脂酸处理小飞蓬叶片后存在明显的特异性。因而,推测CcLhca-J9在羊脂酸抑制小飞蓬叶片生长过程中起了较为关键的作用,但是该基因是否为植物源羊脂酸的靶标基因有待更进一步的功能验证。
