超声造影与CT/MRI肝脏影像报告与数据系统对肝细胞癌诊断评分的一致性分析
2021-01-13刘媛李晨吴明晓罗晓捷陈秀华许静涌
刘媛,李晨,吴明晓,罗晓捷,陈秀华,许静涌
(北京医院,a超声科,b放射科,c普外科 国家老年医学中心 中国医学科学院老年医学研究院,北京 100730)
肝细胞癌(HCC)是我国常见的恶性肿瘤之一,其病死率居第3位[1],因此早期诊断和治疗尤为重要。超声造影(CEUS)可实时动态显示微血管及组织血流灌注状态,分辨率较高,且无肾毒性及辐射,已广泛应用于肝脏病变的诊断[2]。美国放射学院(ACR)2016年8月首次发布了针对HCC高危人群的肝脏影像报告和数据管理系统(LI-RADS),目前仍在不断修订及更新,其临床应用价值尚需进一步探讨[3]。以往的研究[4-5]大多探讨CEUS-LI-RADS对于HCC的诊断效能,对于不同医师之间诊断评分的一致性及CEUS-LI-RADS与CT/MRI-LI-RADS对HCC诊断效能的比较研究较少。本文旨在比较CEUS-LI-RADS与CT/MRI-LI-RADS对HCC的诊断效能以及不同医师之间诊断评分的一致性。
1 资料与方法
1.1 临床资料 回顾性分析2016年7月至2019年5月在北京医院就诊的具有HCC高危风险的肝局灶性病变患者的超声造影及CT/MRI资料。经过筛选,最终35例患者共47个病灶纳入本研究,其中男28例,女7例;年龄范围53~81岁,年龄(64±8.2)岁;所有患者均接受CEUS检查,其中16例患者(21个病灶)接受增强CT检查,19例患者(26个病灶)接受增强MRI检查。
1.2 纳入与排除标准 纳入标准:①肝硬化患者;②慢性乙型病毒性肝炎患者;③诊断为HCC的患者;④病灶均经病理证实。排除标准:①CEUS或增强CT/MRI资料不完整;②病灶接受过介入或手术治疗。
1.3 仪器与方法
1.3.1 超声造影 采用GE Logic E9、Toshiba Aplio 500超声诊断仪,C1-5凸阵探头,频率2~5 MHz,具有低机械指数超声造影技术。造影剂采用Sono Vue(意大利Bracco公司)。
患者取平卧位或左侧卧位,选择最佳切面,启动超声造影模式,经肘正中静脉弹丸式注射Sono Vue 2.4 mL,随后快速推注5 mL 0.9%氯化钠注射溶液冲管。对病灶进行实时、动态观察3~5 min,并存储动态图像。
1.3.2 CT 使用GE HD750、Toshiba Aquilion one多排螺旋CT。扫描参数:120 kVp,300 mAs,层厚5 mm,层间距5 mm。常规行平扫及增强三期(动脉期、门脉期及延迟期)扫描,经高压注射器静脉团注碘海醇80 mL,注射流率3.5 mL/s,分别于注射对比剂后25~30 s、60 s及3 min扫描获得动脉期、门脉期及延迟期图像。
1.3.3 MRI 扫描设备为3T磁共振扫描仪,包括GE Signa Pioneer、GE Discovery MR750,用8通道体部相控阵线圈采集信号。常规行T1WI、T2WI、DWI、同反相位及动态增强扫描。MR对比剂为钆喷酸二甲基葡胺(Gd-DTPA),标准剂量(0.1 mmol/kg),注射速率2.5~3 mL/s,采用高压注射器经静脉注射。扫描方位均为轴位。
FSPGR脂肪抑制T1WI扫描参数:TR 3.89 ms,TE 1.74 ms,层厚≤6 mm,层间距≤ 1.5mm,矩阵512×512,FOV 38 cm×(34.2~38)cm。
化学位移同反相位成像扫描参数:TR 3.89 ms,同相位TE 2.32 ms,反相位TE 1.16 ms,层厚≤6 mm,层间距≤1.5 mm,矩阵512×512,FOV 38 cm×(34.2~38)cm。
脂肪抑制FSE T2WI扫描参数:TR为2~3个呼吸周期,TE 86.2ms,回波链<20,层厚≤6 mm,层间距≤1.5 mm,矩阵512×512,FOV 38 cm×28.5 cm。
DWI扫描呼吸触发单次激发自旋回波-回波平面成像(SE-EPI)序列:b值为0,600s/mm2,扩散方向为3个,并行采集加速因子为2,TR为2~3个呼吸周期,TE默认为最短(56.2 ms),矩阵256×256,采用选择性水激励技术进行脂肪抑制,其他参数同T1WI。
LAVA动态增强扫描参数:TR为最短,TE为最短,层厚4 mm,层间距0,FOV (32~38)cm×(32~38)cm,矩阵512×512。扫描期相:包括平扫、动脉早期、动脉晚期、门静脉期及平衡期。注射对比剂后15~20 s及25~30 s连续采集动脉早期及动脉晚期,注射对比后50~60 s及3 min分别采集门静脉期及平衡期。
1.4 图像分析
1.4.1 超声造影 由2位不同年资的超声科医师(分别具有5年及10年以上腹部超声诊断经验)对所有病灶的超声图像进行独立盲法阅片,参照CEUS-LI-RADS V2017对病灶进行分类,不提供任何临床及病理资料。
1.4.2 CT/MRI 由2位熟悉腹部影像诊断的医师(分别具有腹部阅片经验4年及10年)对所有病灶的超声图像进行独立盲法阅片,参照CT/MRI-LI-RADS V2018对病灶进行分类,不提供任何临床及病理资料。
1.5 统计学处理 应用SPSS 19.0统计学软件进行分析。以病理为金标准,计算超声组和CT/MRI组2名高年资医师利用CEUS及CT/MRI对HCC的诊断符合率,应用χ2检验分析,P<0.05为差异有统计学意义。应用Kappa检验分析超声组和CT/MRI组2名不同年资医师组内诊断的一致性。Kappa值定义为:0.81~0.99,一致性非常高;0.61~0.80,一致性良好;0.41~0.60,一致性中等;0.21~0.40,一致性一般;≤0.20,一致性差。
2 结果
2.1 病理结果 47个病灶最大径线范围为0.9~6.8 cm,最大径线(2.7±1.5)cm;经病理证实31个为HCC,2个为胆管细胞癌,2个为转移癌,7个为肝硬化结节,2个为血管瘤,1个为局灶性结节增生(FNH),1个为肝脓肿,1个为复杂囊肿。
2.2 超声造影LI-RADS与CT/MRI-LI-RADS对病灶诊断评分的一致性比较 超声组两名医师利用CEUS-LI-RADS对病灶的评分一致性为中等,Kappa值为0.481(表1)。评分不一致的情况主要为:医师1评为LR-5而医师2评为LR-M的病灶有5个,医师1评为LR-M而医师2评为LR-5的病灶有6个,医师1评为LR-4而医师2评为LR-5的病灶有2个,医师1评为LR-3而医师2评为LR-M的病灶有1个。

表1 超声组两名医师利用CEUS-LI-RADS 对病灶的分类结果(个)
CT/MRI组两名医师利用CT/MRI-LI-RADS对病灶的评分一致性为中等,Kappa值为0.467(表2)。评分不一致的情况主要为:医师1评为LR-3而医师2评为LR-4的病灶有3个,医师1评为LR-4而医师2评为LR-3的病灶有1个,医师1评为LR-4而医师2评为LR-5的病灶有4个,医师1评为LR-3而医师2评为LR-5的病灶有3个。
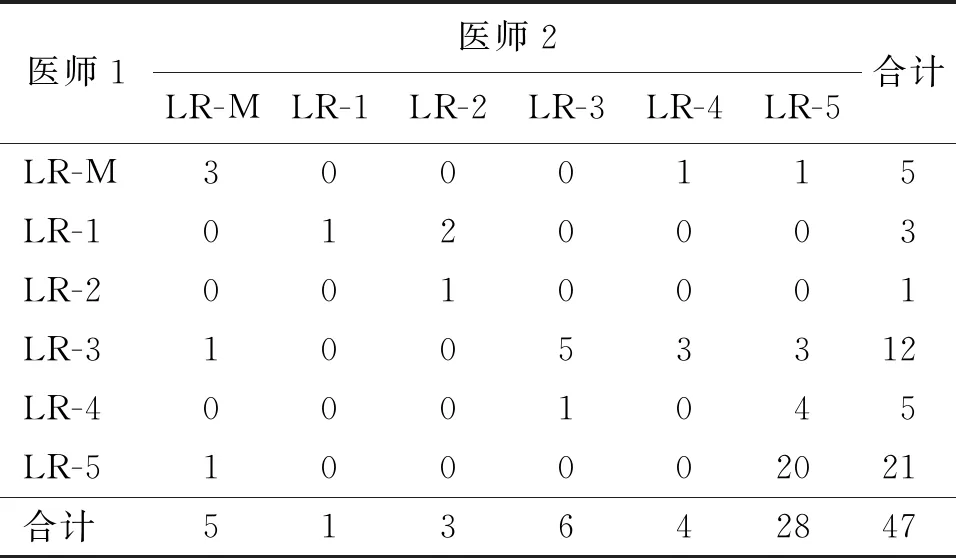
表2 CT/MRI组两名医师利用CT/MRI-LI-RADS 对病灶的分类结果(个)
将LI-RADS 4~5类归为阳性,以病理结果为金标准,超声组和CT/MRI组两名高年资医师分别利用CEUS和CT/MRI对HCC的诊断符合率分别为80.9%(38/47)、89.4%(42/47)(表3,4),经χ2检验,其差异无统计学意义,χ2=1.571,P=0.240。某典型病例影像图片见图1。
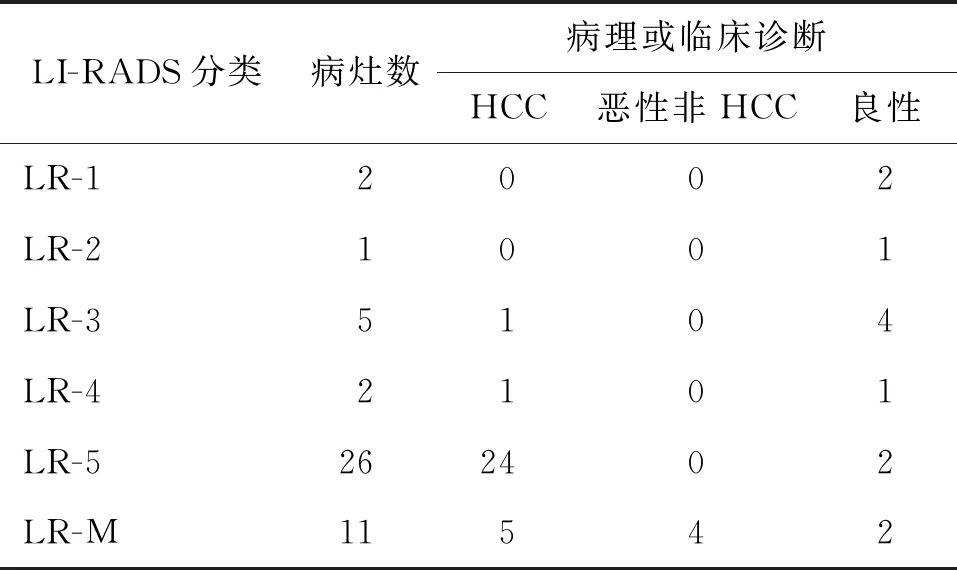
表3 47个病灶CEUS-LI-RADS分类与病理或临床 诊断情况(个)

表4 47个病灶CT/MRI-LI-RADS分类与病理或临床 诊断情况(个)
3 讨论
肝癌是最常见的恶性肿瘤之一,其中HCC占85%以上,多发生于肝硬化背景[6]。由于HCC影像学表现具有一定特征,因此影像学检查成为HCC常用的无创性监测和诊断方法。美国放射学院(ACR)于2011年首次发布了基于CT/MRI的LI-RADS分类标准,目前已发布v2018[7],而超声造影LI-RADS由ACR于2016年8月发布,并更新至v2017,其分类原则与CT/MRI保持一致,目前仍处于不断更新及验证中[3]。既往研究表明将LR-4类及LR-5类归为阳性,利用CEUS-LI-RADS诊断HCC的准确度较高[8],但关于不同医师之间的诊断一致性研究较少。有研究显示利用CT/MRI-LI-RADS,高年资医师之间的一致性高于低年资医师[9]。本研究分别比较了不同医师利用CEUS-LI-RADS及CT/MRI-LI-RADS分类评分的一致性及两者对HCC的诊断符合率。
本研究显示超声组两名医师利用CEUS-LI-RADS分类评分的一致性为中等,Kappa值为0.481,较文献中(Kappa值为0.218)一致性高[10]。这可能是因为本组病例中HCC比例较高,而非HCC恶性肿瘤中转移瘤较多,病灶多≥1.0 cm,并且在阅片前两名医师对CEUS-LI-RADS分类标准进行了严格学习和实践,尽量减少由于不熟练导致的不一致。医师之间不一致主要集中在LR-M与LR-5之间、LR-4与LR-5之间,这主要是由于两名医师对病灶是否廓清和廓清时间的判断存在争议。对于评分存在争议的大多数病灶,2名医师都认为病灶具有动脉期高增强,其中9个病灶1名医师认为廓清时间<60 s,而另1名医师认为廓清时间≥60 s,另外2个病灶伴有中央坏死,1名医师认为病灶环形强化,而另1名医师认为病灶为动脉期非环状高增强,因此造成了LR-M与LR-5的差异。另外3个病灶一名医师认为有动脉晚期轻度廓清,而另一名医师认为未见明显廓清,因此造成了LR-4与LR-5的差异。这点与文献[11-12]一致。本研究中的主要差异为廓清时间的判断,并且有2个HCC病灶廓清时间<60 s,因此笔者认为对于廓清时间的界定尚需要进一步探讨。
关于CT/MRI组2名医师利用CT/MRI-LI-RADS分类评分的一致性,本研究结果与文献报道(Kappa值为0.398~0.537)基本一致,其一致性为中等,Kappa值为0.467[13]。本研究中两名医师的评分差异主要集中在LR-3与LR-4之间、LR-4与LR-5之间,造成差异的一个重要原因是对次要征象的认识不同,其次对于强化或廓清不明显的病灶在判读上存在分歧。
本研究中超声组和CT/MRI组两名高年资医师利用CEUS-LI-RADS与CT/MRI-LI-RADS诊断HCC的诊断符合率分别为80.9%(38/47)、89.4%(42/47),CT/MRI组略高于超声组,但其差异无统计学意义。由于CT/MRI-LI-RADS发布较早且不断修正更新,并且MRI软组织分辨率较高,序列较多,次要征象较多,为诊断提供的信息较多。尤其对于肝转移、胆管细胞癌等LR-M类病灶以及肝脓肿等,MRI多序列能提供更多信息,提高诊断的准确性。本研究中5个HCC在CEUS上被诊断为LR-M类,仅1个HCC在CT/MRI上被诊断为LR-M类。既往研究显示CEUS-LI-RADS对HCC的诊断准确率较高[8,14],但其发布时间短,临床实践较少,仅利用主要征象进行诊断评分,可利用的信息较少,且尚需要进一步验证和探讨。
本研究尚存在一定的局限性,比如样本量较小,且仅对医师之间的诊断评分进行探讨,未对影像征象进行具体分析。
总之,不同医师利用CEUS-LI-RADS对病灶诊断评分之间的一致性与CT/MRI-LI-RADS接近,不一致的主要原因是对于是否廓清以及廓清时间的判定,这尚需要进一步研究来探讨。CEUS-LI-RADS对HCC的诊断具有重要参考价值,但仍需要大量研究来验证及修正,不断提高其诊断效能。
