Fenton体系处理黑臭河道沉积物的效果初探*
2021-01-12罗春燕巩小丽张巧颖杜瑛珣
罗春燕,巩小丽,张巧颖,陈 煜,杜瑛珣
(1:中国科学院南京地理与湖泊研究所,南京 210008) (2:中国科学院大学,北京 101408) (3:南京瑞迪建设科技有限公司,南京 210029)

目前,黑臭水体沉积物的修复技术主要分为异位修复和原位修复[3]. 异位修复主要有清淤疏浚技术;原位修复则包括物理修复技术(如覆盖、引水冲刷、曝气[4])、生物生态修复技术(如激活土著微生物、投加微生物菌剂/酶制剂、植物净化)、化学修复技术(如往沉积物中加入氧化剂、凝结剂或沉淀剂),和一些在此基础上发展起来的新的复合技术(如硝酸钙-曝气联合法[5]、无机凝集剂MSC工法[6])等. 其目的是通过以上手段,抑制或削减沉积物中的污染物,改善水体的氧化环境,减缓水体黑臭现象. 相对于其他修复技术,化学氧化法能快速削减沉积物中的污染物,提高沉积物氧化还原电位,但可能会导入其他物质,造成二次污染. 目前用于黑臭水体沉积物修复的氧化剂包括Ca(NO3)2、CaO2、H2O2和KMnO4等[7]. 其中,H2O2在环境中能分解为氧气和水分子,对环境危害较小. 孙远军等的研究发现H2O2可以削减底泥的酸挥发性硫化物(AVS),改善底泥黑臭现象;对提高底泥的氧化还原电位(Eh)有一定的作用,但效果不显著[8];我们推测这可能是由于H2O2的氧化性不高,难以降解某些有机质.
以H2O2为氧化剂、Fe2+/Fe3+为催化剂的Fenton反应,能快速产生羟基自由基(·OH),·OH的氧化还原电位极高,对有机物的氧化几乎无选择性[9]. 因此,以Fenton反应为基础的光Fenton、电Fenton和非均相Fenton氧化法是常见的工业有机废水控制[10]和有机污染土壤修复方法[11]. 另外,在活性污泥、疏浚底泥的后续处置中,Fenton反应能破坏污泥絮体中的胞外聚合物,促进污泥絮体中结合态水的释放,因此常用于污泥脱水前的调理,提高污泥的脱水性能[12]. 在黑臭水体的修复中,有研究报道了Fenton试剂对富营养化湖水黑臭的氧化降解作用,结果表明:投加Fenton试剂后,水体的色度、浊度和臭味明显降低,水体溶解氧显著提高;鱼类毒理实验表明:实验中采用的Fenton试剂剂量对实验鱼类无急性毒性作用[13]. Fenton试剂氧化黑臭水体沉积物的研究未见报道. 由于Fenton试剂在有机物降解中具有优异效果,另外,铁常用于富营养化水体中内源磷的钝化,对生态系统的影响小. 因此,本研究拟通过室内模拟实验,对黑臭水体沉积物进行Fenton氧化处理,考察Fenton氧化对沉积物Eh和污染物(碳(C)、氮(N)、磷(P)和AVS)的修复;并分析Fenton氧化后沉积物中物质向水体的释放;同时与H2O2的修复效果进行比较. 以期了解Fenton氧化对黑臭水体沉积物修复的效果和修复过程可能产生的问题,初步探讨Fenton氧化法对黑臭水体沉积物修复的适用性,并针对过程可能产生的问题,提出可能的解决方法.
1 材料与方法
1.1 样品来源
沉积物采自苏州市东山镇黑臭河道,采样位置为31.095°N,120.412°E. 采样处河道接纳了东山镇的生活污水与工业废水,与太湖之间有闸口相隔,且闸口常年关闭,已无水生植物生存的迹象. 所采沉积物呈黑色,具有恶臭,其中夹杂着生活垃圾. 采集后取出沉积物中生活垃圾、树枝等杂物后带回实验室备用.
1.2 实验过程
实验室内模拟实验设在温度(T)为28℃下,分为Fenton体系、H2O2体系和对照组(未加任何试剂),每组含3个平行实验. 为了消除沉积物中物质(C/N/P)向上覆水的释放而影响沉积物物质数据的分析,实验分为两个阶段:第1阶段中,体系中无上覆水,考察Fenton和H2O2试剂对沉积物的氧化过程,实验周期为7 d;第2阶段是沉积物经氧化后,进行覆水,考察沉积物中物质向上覆水的释放,实验周期为28 d. 具体过程为:在有机玻璃柱内(内径10 cm,高80 cm),加入2 L混合均匀的湿泥样(平均含水率为77.91%,干重1.16 kg/L,泥样高度约25 cm),然后加入药剂. H2O2体系中H2O2的投加量为20%Q(Q为体系中沉积物有机质完全矿化的理论H2O2用量);Fenton体系中H2O2投加量为20%Q,Fe2+以Fe2+∶ H2O2=0.5∶1(摩尔比)投加. H2O2和FeCl2·4H2O的投加量分别为0.324和0.162 mol/kg. H2O2用水草液肥注射器(具备50 cm长针管)按不同深度注入;Fenton试剂的投加为先向沉积物加入FeCl2·4H2O固体颗粒,搅拌均匀后用注射器注入H2O2试剂. 第1阶段实验在加入药剂的第0、1、2、3、5和7天进行采样,测定沉积物中各物质(C/N/P和AVS)的含量. 第2阶段实验利用虹吸法向氧化7 d后的沉积物加入2 L上覆水(自来水),考虑到操作的可行性,覆水后1 h取样,作为覆水后第0天的数据,在不同时间采集沉积物和上覆水表层样品,考察沉积物中C/N/P等物质的释放情况. 水样每次采集0.1 L,随后向柱子中补充等量自来水. 取样后立刻对样品进行处理.
1.3 测量指标与方法
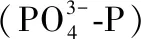
1.3.2 水体指标测定 水样用0.45 μm的滤膜过滤后,测定方法参照《水和废水监测分析方法》[16].
1.3.3 累计释放量测定 累计释放量为:经Fenton和H2O2处理过的沉积物覆水后28天内向上覆水释放某物质的总量,由上覆水浓度转化得到. 计算公式为:
(1)
式中,M为28 d累计释放量,g;C1和Ci为第一次和第i次采集的上覆水DOC和营养盐的浓度,g/L;V0为上覆水体积,L;Va为采样体积,L.
1.3.4 统计分析 各处理组指标差异显著性采用均值比较检验(SPSS 17.0).
2 结果与分析
2.1 黑臭水体沉积物污染特征

2.2 Fenton和H2O2氧化过程中沉积物性质变化的比较
在第1阶段实验,未设置对照组. 因在第2阶段实验,对照组沉积物性质无明显变化(见2.3节);说明在实验时间(7 d)内未做任何处理不会引起沉积物性质的改变,第1阶段中物质的变化均为Fenton和H2O2氧化所致.
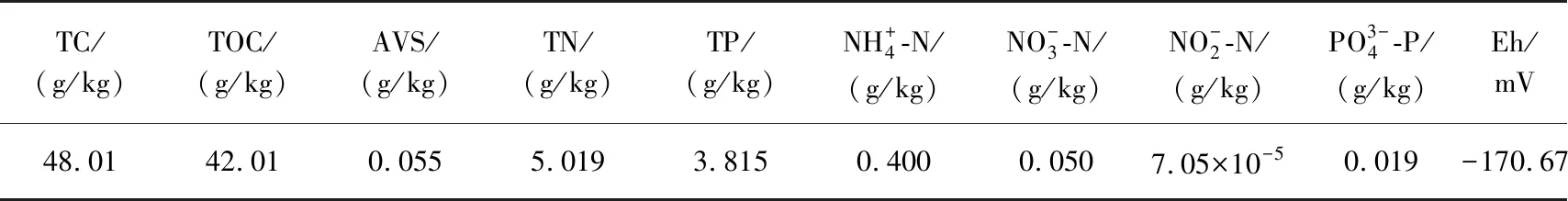
表1 采样黑臭河道的沉积物特征
2.2.1 沉积物AVS和TOC含量的变化 从如图1a可知,Fenton和H2O2体系对沉积物AVS都有很好的处理效果,最大去除率分别为95.22%和88.41%,在统计学意义上两者无明显差异(P>0.05). Fenton体系在第1天对AVS的去除率高于H2O2体系,两种体系在第1天对AVS的去除率分别为70.13%和53.36%;Fenton体系在第5天达到最大去除率(95.22%),而H2O2体系在第2天达到最大去除率(88.41%). 从整个反应过程(7 d)来看,Fenton和H2O2试剂对AVS的去除效果相当. 沉积物中AVS在湿润有氧的条件下可在短时间内被完全氧化为硫酸盐[21],说明Fenton和H2O2体系在反应过程中大幅度提高了沉积物的氧化性,使沉积物中AVS快速减少;另外,由于试剂造成的酸性环境也可能使沉积物AVS释放或逸出,使沉积物AVS含量减少.
从图1b可知,Fenton和H2O2体系对TOC的处理效果相似(P>0.05),但处理效率上Fenton体系优于H2O2. 在第1天,Fenton体系TOC含量迅速减少了22.14%;而H2O2体系第1天只减少了7.86%,在第5天达最大减少量(20.71%). Fenton体系生成·OH,其具有很高的氧化还原电位(2.80 V)[22],对有机质的氧化作用极强,能快速氧化并矿化有机质,使TOC在反应初期迅速减少. 随着Fenton试剂的消耗,反应1 d后沉积物中TOC含量无明显变化;这也说明了大部分Fenton试剂在第1天已经消耗. H2O2体系的处理效率较低,应该是由于体系中无外加铁剂,H2O2难以生成强氧化剂·OH,而H2O2自身的氧化能力较弱,氧化速率低;因此H2O2消耗速率慢,在其消耗完前,沉积物中TOC含量缓慢下降.
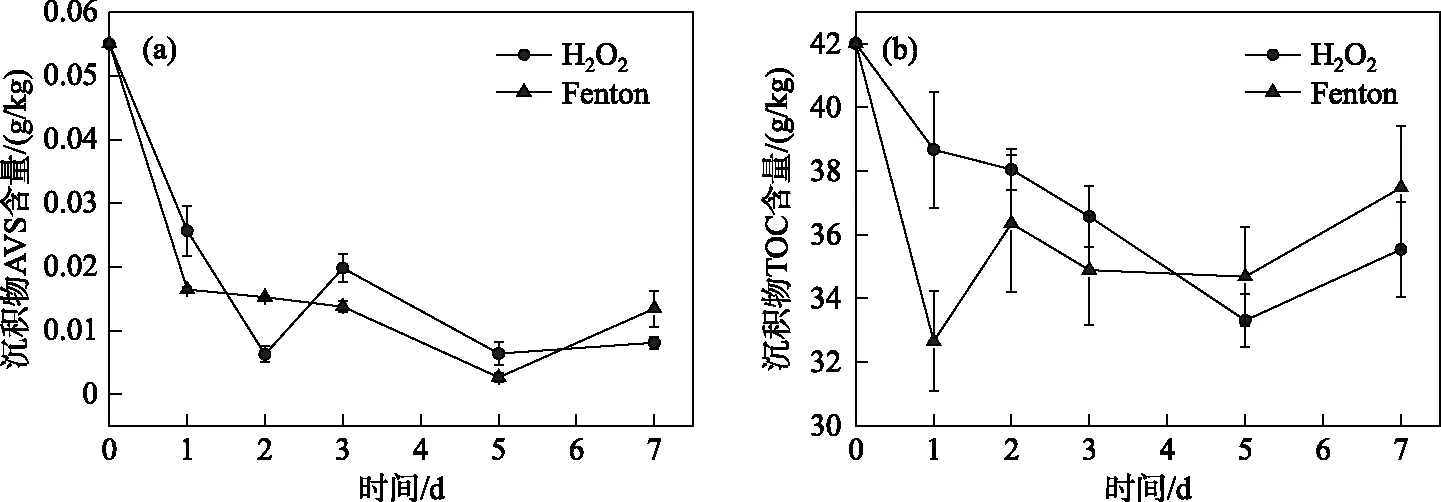
图1 Fenton和H2O2处理过程中沉积物AVS(a)和TOC(b)含量的变化(H2O2=20%Q,Fe2+∶H2O2=0.5∶1(摩尔比), T=28℃)Fig.1 Changes of AVS (a) and TOC (b) contents in the sediment of Fenton and H2O2 treatments (H2O2=20%Q,Fe2+∶H2O2=0.5∶1(molar ratio), T=28℃)


图2 Fenton和H2O2处理过程中沉积物和含量的变化(H2O2=20%Q,Fe2+∶H2O2=0.5∶1(摩尔比), T=28℃)Fig.2 Changes of TON (a), (d) contents in the sediment of Fenton and H2O2 treatments (H2O2=20%Q,Fe2+∶H2O2=0.5∶1 (molar ratio),T=28℃)
2.3 覆水后沉积物与上覆水性质的变化
2.3.1 覆水后沉积物与上覆水Eh、pH的变化 从图3a可以看出,覆水后对照组沉积物的Eh在-220~-180 mV之间;Fenton体系覆水后第1周沉积物Eh在-130~-80 mV范围内波动,随后稳定在-100 mV左右,与对照组相比,Fenton处理后可以有效提高沉积物的Eh(P<0.05);H2O2处理组沉积物的Eh为-210~-180 mV,H2O2不能有效提高沉积物的Eh(P>0.05).

图3 覆水后沉积物与上覆水Eh(a和b)和上覆水pH(c)的变化(T=28℃)Fig.3 Changes of Eh of the sediment and overlying water (a and b) and pH (c) of overlying water (T=28℃)
上覆水的Eh变化见图3b. 相对于所加自来水的初始Eh(505 mV),覆水后第0天测得的3个组别上覆水的Eh均降低. 对照组上覆水的Eh在28 d内呈缓慢下降趋势,过程中有所波动. 在第0天,对照组上覆水的Eh为66 mV,第28天时,下降为 -19 mV;Fenton体系上覆水的Eh在第1周从-55 mV上升至259 mV,之后稳定在300 mV左右;H2O2体系上覆水的Eh则在第1周从-162 mV上升至17 mV,之后稳定在-60 mV左右. 对比3个组别,Fenton体系上覆水的Eh高于对照组(P<0.05),而H2O2体系低于对照组(P<0.05). 虽然反应7 d后,Fenton和H2O2体系对沉积物TOC的削减量相似,但无论是沉积物还是上覆水,Fenton体系的Eh均更高,这可能是相比于H2O2,·OH能更快更彻底地氧化有机质,因此Fenton体系中剩余的有机质具有更高的氧化态(即有机中间产物含氧量高),使体系Eh维持在较高水平.
值得注意的是,Fenton处理后上覆水pH(加入自来水的初始pH为7.02)迅速下降到3.0~4.5的范围,而单独投加H2O2对上覆水的pH影响不大,在7~8之间浮动(图3c). 本实验中,Fe2+是以固体形式投加的,无人为对沉积物进行pH调节. 加入沉积物中的Fe2+,以及Fe2+被氧化生成的Fe3+产生水解反应,极可能降低pH;更重要的是,由于Fenton体系产生的·OH具有强氧化性,能将沉积物中的有机质氧化分解为小分子有机酸[24],加入上覆水后,沉积物中的有机小分子酸释放到上覆水中,使pH降低;另外,有机质矿化产物CO2溶解于间隙水中,也可能增加上覆水的酸性.
2.3.2 覆水后沉积物TOC和DOC的累计释放量 覆水后对照组沉积物TOC含量保持在40 g/kg左右(图4a);Fenton体系沉积物TOC含量在34 g/kg左右波动;H2O2体系除了第28天的含量为41.540 g/kg,基本稳定在36 g/kg左右. 对3个组别进行统计分析,Fenton和H2O2体系均与对照组具有显著差异(P<0.05),而Fenton和H2O2体系之间无显著差异(P>0.05),说明Fenton和H2O2试剂能有效减少沉积物的TOC,但两者处理效果差异不大. 将上覆水DOC浓度转化为28 d累计释放量(图4b),发现:H2O2体系>Fenton体系>对照组. 值得注意的是,释放量计算中忽略了上覆水有机质的降解. 对照组DOC释放量为0.013 g,占覆水前沉积物TOC含量的0.013%,释放量很低,但在实际河道中由于外力等的干扰很可能造成更大的释放. 在沉积物有机质含量很高的情况下,即使外源污染被截断,沉积物有机质向水体的持续释放将可能使水体长期处于不良状态[25]. Fenton体系DOC累计释放了0.025 g,释放量占覆水前沉积物中TOC含量的0.029%(与氧化过程第7天的沉积物TOC含量比较);H2O2体系DOC累计释放了0.127 g,释放量占0.154%. Fenton和H2O2试剂氧化性较强往往会降解高分子量的有机质,相对而言,低分子量有机质的溶解性有助于其释放;此外,两种氧化剂可能会更大程度地破坏有机胶体,使多种有机质组分(蛋白质、多糖等)从沉积物中释放出来[1];Fenton体系的氧化性更高,有机质可能得到彻底矿化,再加上Fe2+/Fe3+形成的胶体可能吸附有机质,因此其释放量相对较少. 沉积物中高含量的有机质是水体反复黑臭的原因之一,Fenton氧化能快速有效地削减沉积物中有机质含量,但在处理过程中造成的有机质向水体的释放是需要关注的(后续需加强其矿化). 值得强调的是,要削减黑臭沉积物中C/N等的含量,除了以气态形式逸出,必定会伴随着向上覆水的转移.


图5 覆水后沉积物和含量的变化(a和b)与累计释放量(c和d)(T=28℃)Fig.5 Changes of contents (a and b) in the sediment and cumulative releases(c and d) (T=28℃)

图6 覆水后沉积物含量的变化(T=28℃)Fig.6 Change of content in the sediment after covering water (T=28℃)
3 讨论
用Fenton氧化法处理黑臭沉积物1周,其性质发生明显的变化;在加入上覆水的后期观察中也呈现一定规律. Fenton体系的强氧化性能明显提高沉积物与上覆水的Eh,沉积物Eh从-170.67 mV提高到-100 mV左右,上覆水稳定在300 mV左右. 但由所投化学药剂(FeCl2·4H2O)性质和反应产物如CO2、有机酸等的影响使上覆水呈酸性(pH在3.0~4.5间).
Fenton体系中H2O2的投加量为体系中沉积物有机质完全矿化理论H2O2用量的20%,经Fenton氧化后,沉积物中TOC的去除率为22.14%;并且,Fenton试剂对有机质的降解速度很快,在处理的第1~3天便能有明显的效果. 从有机质去除率和降解速率看,投加的H2O2得到有效、充分的利用且发生了Fenton反应,也表明本实验的投加方式适用于沉积物处理. Fenton体系在7 d内能大幅度减少沉积物AVS含量,对AVS的去除率达95.22%,但由于Eh仍处于还原条件,硫酸盐在硫酸盐还原菌作用下容易再生成AVS,使沉积物AVS含量回升. 以本实验投加量一次处理沉积物仅减少22.14%的有机质,也可能是限制沉积物氧化状态进一步提升的原因. 对于严重黑臭的河道,在经济与相对安全的投药量下,可能需要加大氧化剂的投加量或多次投加才能有效削减沉积物中的有机质,使水体黑臭减缓并且防止水体反复黑臭.

相对于Fenton试剂,H2O2对沉积物中有机质和AVS的去除有类似的作用,但对有机氮的去除和溶解性磷的削减不如Fenton试剂;剩余有机质的氧化状态也没有Fenton试剂高,导致H2O2氧化后,沉积物与上覆水Eh提升不明显,这与孙远军等[8]的研究结果一致. 在其他化学修复药剂(Ca(NO3)2、CaO2和KMnO4等)中,其修复机理主要针对的是黑臭物质和营养盐本身,其中Ca(NO3)2表现出更多的优势,通过投加Ca(NO3)2能促进硫自养反硝化过程,达到C、N、S的同步去除,对沉积物溶解性磷、重金属含量、生物毒性均有降低作用[27],但其处理时间较长. Fenton氧化法则具有快速氧化有机质的优势,沉积物有机质的快速削减可防止其对水体溶解氧的长期消耗,改善沉积物氧化还原环境,从而抑制黑臭物质的产生.
综合以上,Fenton试剂能够快速氧化黑臭水体沉积物中的有机碳、氮和钝化溶解性磷;由于沉积物中有机质的快速分解,产生的有机酸和氨氮会释放到水中,导致水体pH下降,氨氮浓度升高. 值得注意的是,沉积物中C、N、S等污染物的削减除了以气态形式逸出,其向上覆水的转移也是必然过程. 为此,可将Fenton氧化法与其他技术联用,如结合生物法,投加微生物菌剂加强水体中的硝化与反硝化过程,让氮以N2的形式离开水体,使氮营养盐得到真正有效的削减. Fenton氧化法作为高级氧化技术,在有机污染废水和土壤修复中的应用很广泛,而在黑臭水体沉积物修复中研究较少,在后续研究中,还需进一步考察Fenton氧化后沉积物的生物毒性和生物生态功能等的变化,评估该修复技术的处理效益,加强与其他修复技术的联合,为黑臭水体治理提供新思路. 另外,需要加强试剂投加装置的研发,使Fenton试剂在带水条件下能简便、精准投加,才能拓展Fenton氧化技术在黑臭水体控制的实际应用.
4 结论

致谢:本实验上覆水累积释放量转换由中国科学院南京地理与湖泊研究所博士研究生文帅龙师兄指导完成,对此表示衷心感谢.
