‘永泰’杨梅亲本鉴定及其单核苷酸多态性遗传变异分析
2021-01-11陈方永胡丹颜帮国倪海枝王引
陈方永,胡丹,颜帮国,倪海枝,王引
(1.浙江省柑橘研究所,浙江 台州318026;2.温州市特产站,浙江 温州325000)
杨梅(Myrica rubra)为被子植物门双子叶植物纲壳斗目杨梅科杨梅属植物,在我国已有2 000 多年的栽培历史,多分布在长江流域以南地区。据浙江省农业厅2018 年报统计,全省杨梅栽培面积为9 万多hm2,产量为50 多万t,均约占全国的1/3。我国杨梅品种资源丰富,约有400 个杨梅栽培种(材料),其中120 个属于经济栽培品种(材料),22 个通过了省级品种审定[1]。全国4个主栽品种‘东魁’‘荸荠’‘丁岙梅’‘晚稻梅’均来自浙江。目前,我国杨梅品种大多由实生变异选育而来。
传统的种质资源鉴定主要建立在形态学的基础上,虽然该方法简便经济,但易受环境影响,准确性有待提高。重测序技术是基于DNA分子水平,对已知基因组序列的物种的不同个体进行基因组测序,是基因分型的一种方法,能将新品种的序列与参考序列进行比较而确定新品种的遗传构成差异。该技术能简单、有效、迅速地分析并处理DNA数据,确定个体的遗传构成(基因型)差异,是种质资源鉴定中经济有效的方法之一[2-3]。近年来,重测序技术已被广泛应用于桃[4]和柑橘[5]等果树上。单核苷酸多态性(single nucleotide polymorphism,SNP),是指基因组中某个特定位置上发生单个核苷酸变化(转换或颠换)所引起的DNA序列多态性。与简单重复序列多态性(simple sequence repeat polymorphism,SSR)等其他分子标记相比,SNP是国际植物新品种保护联盟(International Union for the Protection of New Varieties of Plants, UPOV)BMT 分子测试指南中推荐的分子标记之一[6],具有数量多、分布广泛、稳定性高、快速且高通量分型等优点。随着测序通量的提高以及成本的下降,对果树进行全基因组高通量重测序,检测SNP及进行SNP基因分型已成为一种高效便捷的手段。目前,除甘蓝[7]、冬油菜[8]、棉花[9]外,全基因组高通量重测序还被广泛应用于梨[10-11]、苹果[12-13]、桃[14]、柑橘[15-16]、枇杷[17]、山核桃[18]等果树遗传多样性的研究中。但对于杨梅,仅用其构建了高密度遗传连锁图谱[19-20]。因此,本文以9个杨梅品种和新种质‘永泰’为研究材料,结合基因组高通量重测序和参考基因组比对,重点开发核心SNP标记,构建聚类图,以揭示‘永泰’和其他品种间的亲缘关系,并结合形态学、风味和SNP 变异水平等综合分析,推测新种质‘永泰’芽变的机制。
1 材料与方法
1.1 供试材料
供试杨梅品种(材料)‘黑晶’‘东岙早梅’‘早大梅’‘早佳’‘木叶’‘乌紫’‘荸荠’‘永泰’‘软丝’‘硬丝’,均取自浙江省和福建省的不同地区(表1)。其中:‘永泰’取材于母树,‘荸荠’为营养系嫁接苗种植株。
杨梅新种质‘永泰’(品种受理号:20191004772)为来源于浙江省泰顺县百丈镇的杨梅栽培园中一株杨梅的变异侧枝,因母树失管死亡,故无法确定其亲本来源。该杨梅园位于浙江省温州市泰顺县百丈镇与福建省寿宁县交界处,主要种植‘荸荠’杨梅和‘硬丝’杨梅。与‘荸荠’相比,‘永泰’成熟期早4~5 d,果实大80%以上;与‘硬丝’相比,‘永泰’成熟期早2~3 d,果实大27%以上;‘永泰’的叶片大小与此二者没有明显不同。自2013 年‘永泰’嫁接树投产后,年年稳产优质。

表1 10个杨梅品种名称及来源Table 1 Name and origin of 10 Chinese bayberry accessions
1.2 方法
1.2.1 DNA 提取
取供试的10 个杨梅品种的幼嫩叶片,于-20 ℃条件下保存,备用。采用改良后的十六烷基三甲基溴化铵(CTAB)法[21]提取各品种叶片的DNA。通 过1.0% 琼 脂 糖 凝 胶 电 泳(λ-Hind Ⅲdigest,日本TaKaRa公司)检测DNA的提取情况,并使用紫外分光光度计测定D(260 nm)/D(280 nm)值和D(260 nm)/D(230 nm)值,以检测DNA的纯度与浓度。
1.2.2 基因组重测序与参考基因组比对
按照美国Illumina公司推荐的标准进行基因组重测序与参考基因组比对。用超声破碎的方法将1.2.1 节提取的DNA 随机打断成350 bp 的片段,然后,DNA片段经末端修复,3’端加A、加测序接头和纯化,再用琼脂糖凝胶电泳进行片段大小选择,并通过聚合酶链式反应(polymerase chain reaction,PCR)扩增形成测序文库。将建好的文库纯化和去接头污染后,进行文库质检,合格后通过Illumina测序平台进行上机测序。通过高通量测序,并经碱基识别(base calling,BC)得到原始测序序列(raw data,RD)。用分析软件Illumina Casava 1.8 对行中每个字符对应的ASCⅡ值进行计算,即得到对应碱基的测序质量值Qphred。计算公式为Qphred=-10 lg e,式中e为测序错误率。
为了保证信息分析质量,对原始测序序列进行过滤,去除带接头的序列,并过滤氮(N)含量超过10%的序列,以及去除测序质量值低于10 的碱基超过50%的序列,最后得到高质量序列(clean reads,CR)。
将重测序获得的CR 重新定位到参考基因组上,接着进行后续变异分析。利用BWA软件[22]将得到的短序列与参考基因组进行比对。通过比对定位序列在参考基因组上的位置,统计各品种的测序深度、基因组覆盖度等信息,并进行变异检测。
1.2.3 SNP 的变异检测与系统进化树的构建
主要使用GATK工具包[23]对SNP进行检测。根据高质量序列在参考基因组中的定位结果,使用Picard 法(https://sourceforge.net/projects/picard/)过滤冗余序列(mark duplicates, MD),以保证检测结果的准确性。然后,使用GATK 的HaplotypeCaller(局部单体型组装)算法进行SNP变异检测,每个样本先各自生成gVCF 文件,再进行群体联合基因型分析。最后,通过过滤得到最终的变异位点集。
利用Plink软件(http://zzz.bwh.harvard.edu/plink/data.shtml),运用生物信息算法,即输入文件(vcf T848.snp.vcf)—参数(distance-matrix)—参数(allowextra-chr)计算种间的遗传距离(genetic distance,GD)。遗传相似系数(genetic similarity,GS)按下列公式[24-25]计算:GS=1-GD。
对检出的SNP进行核心SNP筛选,通过深度过滤(深度低于5X 的SNP 位点,X 为碱基总量与基因组大小的比值)、检出率过滤(完整度小于0.8 的SNP 位点)、次优等位基因频率SNP 筛选和SNP 均匀度过滤后,基于杨梅群体筛选出核心SNP,用MEGA 5.0 软件中的邻接(neighbor-joining,NJ)法构建核心SNP的系统进化树[26]。
1.2.4 叶片形态学观察比较
随机摘取供试的10个杨梅品种叶各100片,分别对叶的纵横径、形状等指标进行观察记录,并挑选每个品种中典型的叶片样本进行对比分析。
1.2.5 果实形态学观察比较
随机摘取50 颗‘荸荠’‘硬丝’果实和拟为二者突变的‘永泰’果实,并挑选出典型的果实,参照2015年版中华人民共和国农业行业标准《植物新品种特异性、一致性和稳定性测试指南 杨梅》,进行相关指标认定。
2 结果与分析
2.1 高通量重测序统计
通过对杨梅10 个品种(材料)基因组的重测序检测,共得到39.69 Gb 大小的高质量序列。分别对测序错误率、测序质量值、各碱基比例分布、GC 含量的标准参数进行统计分析,并通过Illumina Casava 1.8对测序错误率与质量值参考标准进行比对发现:碱基发生错误的概率低,Q20平均为96.82%,Q30平均为91.47%;杨梅品种间AT、CG碱基配对比正常,GC平均含量为38.35%(表2)。
2.2 参考基因组比对分析
将获得的高质量序列重新定位到参考基因组上,以开展后续变异分析。通过与参考基因组比对,各品种的基因覆盖度均在90%以上,测序深度≥9×(表2)。这说明各个品种的基因组被均匀覆盖,测序随机性较好,获得的SNP代表性强。极个别深度不均的地方可能是由重复序列和PCR 偏好性引起的。通过以上分析可知,各品种(材料)均符合后续遗传变异分析。

表2 杨梅10个品种重测序及参考基因组比对统计Table 2 Re-sequencing and reference genome comparisons of 10 Chinese bayberry accessions
2.3 多态性核心SNP 变异分析
2.3.1 品种间核心SNP 位点开发
通过对杨梅各品种(材料)的SNP 与参考基因组[27]进行比对,汇总所有差异的SNP变异位点,并开发出核心SNP标记。SNP位点变异分转换和颠换2种类型:同类型碱基之间突变称为转换,如嘌呤与嘌呤、嘧啶与嘧啶之间的变异;不同类型碱基之间的突变称为颠换,如嘌呤与嘧啶之间的变异。10个杨梅品种(材料)的SNP 转换的变异数量均显著大于颠换数量,且转换与颠换比均大于1(表3)。这说明SNP 转换比颠换变异更容易发生。杨梅同源染色体上的某一SNP位点均为同一种碱基,则该SNP位点称为纯合SNP 位点;若包含不同类型的碱基,则该SNP 位点称为杂合SNP 位点。10 个杨梅品种杂合SNP 位点数均显著大于纯合SNP 位点数(表3)。这说明各个品种的SNP杂合程度较高,与参考基因组的SNP位点对比变异显著。
2.3.2 核心SNP 位点的筛选
对SNP 标记进行筛选,共筛选出4 025 个杨梅核心SNP(附表1,http://www.zjujournals.com/agr/CN/10.3785/j.issn.1008-9209.2020.06.231),可用于杨梅的遗传和育种研究。这些标记的次要基因型频率平均为0.447 2,期望等位基因数为1.934 1,期望杂合度为0.48,Nei基因多样性指数为0.506 4,观测等位基因数为2,观测杂合度为0.784 9,多态性信息含量为0.363 9,Shnnon-Wiener指数为0.672 3。

表3 杨梅10个品种与参考基因组之间的SNP开发与检测Table 3 Development and detection of SNP between 10 Chinese bayberry accessions and the reference genomes
结合多态性核心SNP位点在杨梅基因组上对应位置分析,4 025个核心SNP定位于杨梅8条染色体上,但每条染色体上的遗传多样性存在差异。其中:染色体编号为CM012073.1 的核心SNP 位点最多,为631个;染色体编号为CM012078.1的核心SNP位点最少,为426 个(图1A)。观察每对染色体核心SNP位点的分布情况,发现每条染色体间的SNP位点都分布均匀(图1B),说明多态性SNP位点具有较高的基因组覆盖度,在基因组上分布相对均匀,能够有效应用于杨梅品种全基因组遗传多样性分析。
2.4 遗传变异分析
2.4.1 种间遗传相似性分析
基于多态性SNP位点基因分型数据分析杨梅品种间的遗传关系。如表4所示,10个品种的杨梅GS分布在0.820 11~0.979 63 之间,平均为0.863 42。其中:‘早佳’和‘早大梅’的GS为0.979 63,亲缘关系最近;‘软丝’和‘东岙早梅’的GS为0.820 11,亲缘关系最远。‘永泰’与‘硬丝’‘早大梅’‘软丝’‘荸荠’的GS分别为0.977 83、0.881 47、0.881 23、0.851 72。综合分析比较认为,‘永泰’跟‘硬丝’的亲缘关系最近,其次与‘早大梅’‘软丝’较近,而与‘荸荠’相对较远。
2.4.2 种间SNP 系统进化分析

图1 核心SNP位点在杨梅染色体上的数量(A)及分布(B)Fig.1 Number and distribution of core SNP loci on the Chinese bayberry chromosomes
基于核心SNP 的遗传距离构建杨梅系统进化树(图2)。从中可见,杨梅各品种分为2组:‘黑晶’‘东岙早梅’‘乌紫’‘荸荠’‘木叶’5 个品种聚为一组;‘早大梅’‘早佳’‘软丝’‘永泰’‘硬丝’5 个品种聚为一组。与所有杨梅品种相比,系统进化树反映了种间亲缘关系远近,其中:‘东岙早梅’和‘乌紫’聚为一小支,亲缘关系最近;‘早大梅’和‘早佳’聚为一小支,亲缘关系最近;‘永泰’与‘硬丝’聚为一小支,亲缘关系最近。这与对品种间GS分析(表4)得出的结论相一致。这表明,‘硬丝’是‘永泰’的母树,‘永泰’是‘硬丝’的芽变。
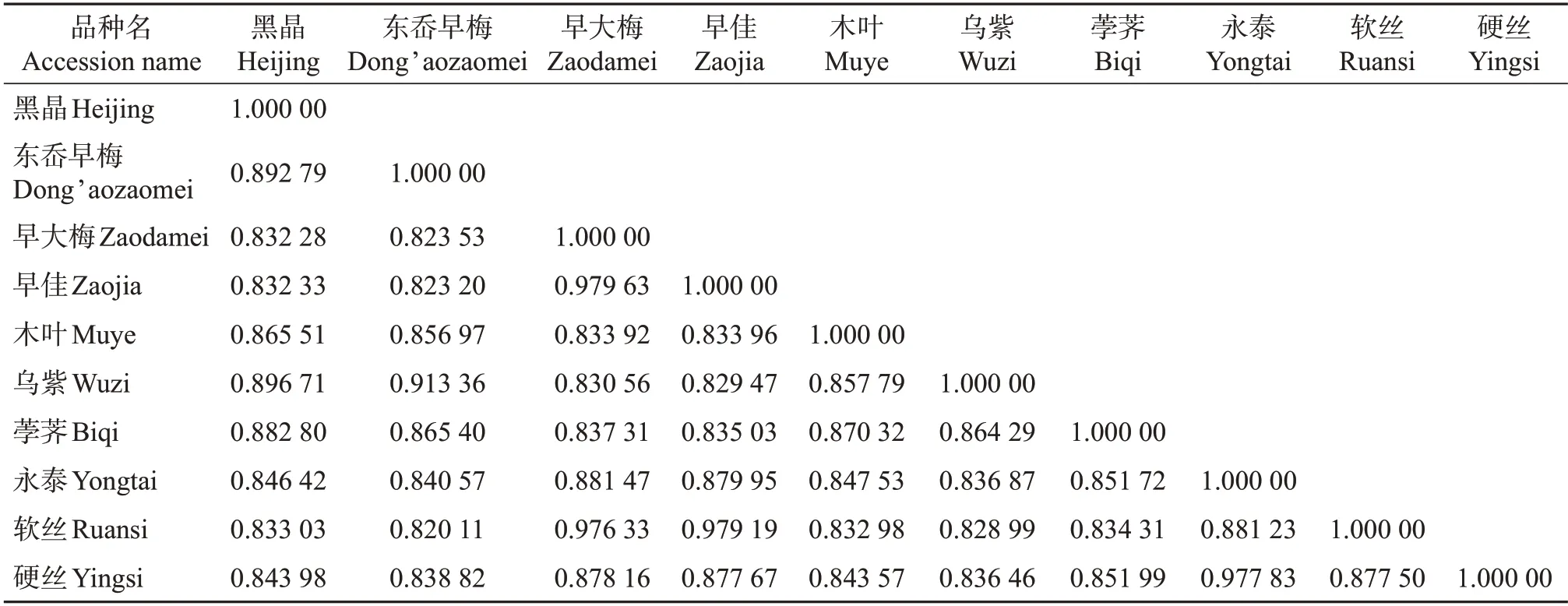
表4 杨梅10个品种间的遗传相似性Table 4 Genetic similarity(GS)of 10 Chinese bayberry accessions
2.5 叶片和果实的形态学鉴定
对来源于不同地方的10 个杨梅品种(材料)的叶片形态进行观察,发现各个杨梅种质间叶片形态学性状存在显著差异。‘永泰’叶片纵横径最大,‘荸荠’纵横径均最小;‘东岙早梅’‘早大梅’和‘软丝’叶片色泽均为中绿,其余品种均为深绿(表5,图3)。其中:‘黑晶’‘东岙早梅’‘早大梅’的原产地分别来自浙江省台州市辖区的温岭、黄岩、临海3 地;‘早佳’和‘木叶’均来自浙江省兰溪市;‘乌紫’和‘荸荠’分别来自浙江省宁波市的象山县和余姚市;‘硬丝’和‘软丝’均来自福建省龙海市。这些各自在同一地市级行政区域内的杨梅品种叶片存在差异,说明来源于同一地区的杨梅不一定是同一种质。

图2 杨梅10个品种的核心SNP系统进化树Fig.2 Phylogenetic tree of core SNP of 10 Chinese bayberry accessions
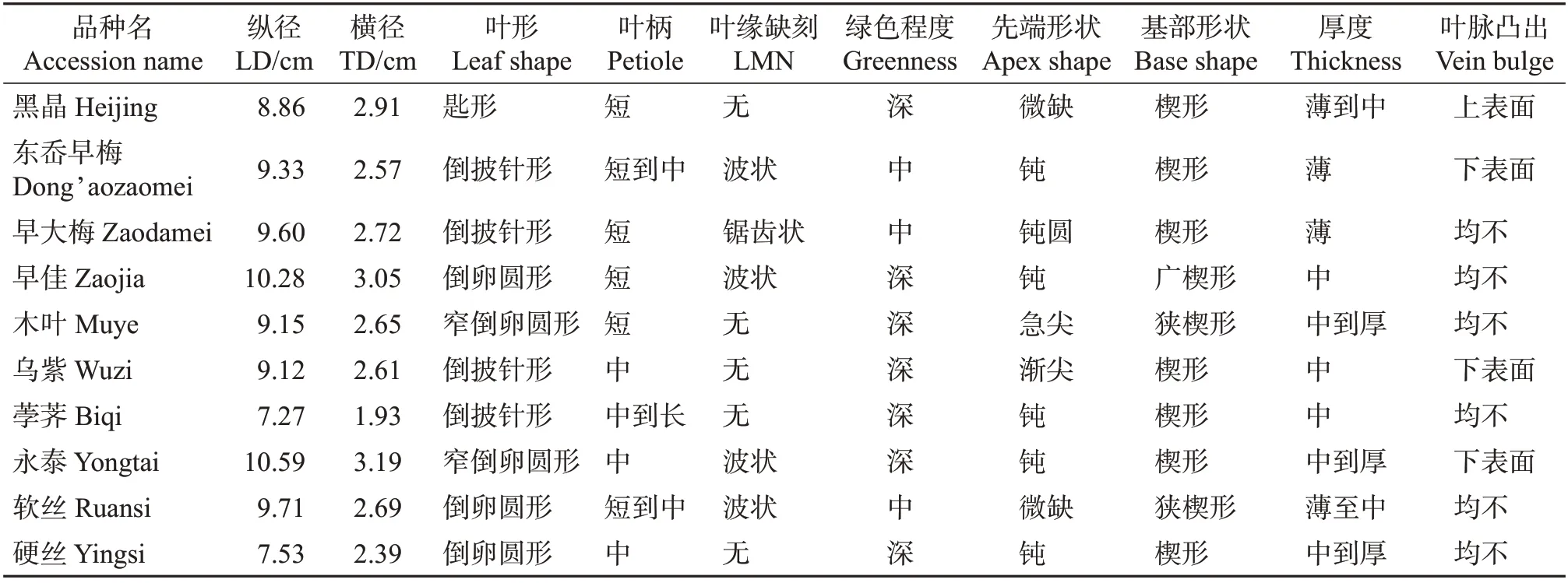
表5 杨梅10个品种叶片性状比较Table 5 Leaf trait comparisons of 10 Chinese bayberry accessions
‘永泰’杨梅的来源倾向于‘硬丝’,它是由后者的一个枝条突变而来的,在叶片大小、叶缘、叶脉与果实上的表现均不同,其他7项指标相同或接近(表5,图3)。与拟亲本的‘荸荠’相比差异大,与浙江省临海市的‘早大梅’、福建省龙海市的‘软丝’差异较小。可见,‘永泰’和‘硬丝’‘早大梅’亲缘关系较近,GS数值大(表4)。这说明品种间亲缘关系的远近不一定与地理区域相一致。
从比较各品种的果实成熟期来看,‘软丝’‘永泰’‘硬丝’‘早佳’‘荸荠’间前后依次相差5~10 d,但‘永泰’比‘硬丝’‘荸荠’分别提早2~3 和4~5 d成熟。对‘荸荠’和‘永泰’果实形态进行比较发现:‘永泰’的平均单果质量为15.6 g,比‘荸荠’(8.6 g)大81%以上,比‘硬丝’(11.3 g)大38%以上;这3 个品种果实颜色均为紫色(表6,图4),但‘永泰’‘荸荠’无松香味,‘硬丝’有淡松香味。这是种性变异驯化的结果。
2.6 种间SNP 遗传机制分析

表6 ‘永泰’‘荸荠’和‘硬丝’果实性状描述Table 6 Description of fruit traits of‘Yongtai’,‘Biqi’and‘Yingsi’

图4 ‘永泰’‘荸荠’和‘硬丝’果实形态比较Fig.4 Comparisons of fruit morphology among‘Yongtai’,‘Biqi’and‘Yingsi’
通过比对‘永泰’与亲本‘硬丝’基因组SNP变异位点,结合不同单核苷酸位点变异性,共得到4 660个SNP变异位点。结合非冗余(non-redundant,NR)和基因本体论(gene ontology,GO)数据库进行对比注释发现,差异位点分别在转录翻译、蛋白质合成、新陈代谢、酶催化等方面发挥相应的功能。‘永泰’叶片典型的形态变异主要与其生长发育(形态,细胞、维管组织,衰老)、生长素合成相关的SNP位点产生了变异有关,从而使‘永泰’和‘硬丝’在叶片大小及形态方面产生显著性差异。综上所述,可以认为‘永泰’是‘硬丝’的突变体,而非‘荸荠’的突变体。
3 讨论与结论
芽变是快速高效获得果树新品种(材料)的一种方法[28]。它主要表现为染色体变异、基因突变和表观遗传变异。鉴别芽变的方法多样,主要集中在形态学水平、生化水平、DNA分子水平上[29-30]。除了上述方法,还可通过不同种质间染色体核型大小[31]、倍数[32]和叶绿体基因组[33-34]进行不同种质的亲缘关系和变异性质鉴定。
由形态学鉴定分析可知,‘永泰’和拟亲本‘荸荠’在叶片大小、果实大小和糖度等各项指标上差异极为显著,而与‘硬丝’差异不明显。对照产地同为福建省龙海市的‘硬丝’与‘软丝’,前者果实有松香味,而后者无,从而排除了‘永泰’是‘软丝’突变体的可能性。‘永泰’经过长期的逆境(长期失管导致病虫害多发等),树势高度衰弱,与亲本是福建的营养系‘硬丝’相比,已经没有松香味的表现,这可能是遗传变异的结果。因此,新种质不仅在叶片、果形、果实质量等表征方面产生了变化,而且在香味方面也产生了重要变化,应为遗传变异所致。
本文基于重测序技术开发了4 025 个核心SNP标记,并通过构建聚类图,揭示了‘永泰’和其他品种间的亲缘关系。通过计算GS发现,‘永泰’和‘硬丝’的GS 最高,达0.977 83,与‘荸荠’的较低,为0.851 72。在构建的系统进化树中,‘黑晶’‘东岙早梅’‘乌紫’‘荸荠’‘木叶’5 个品种聚为一组;‘早大梅’‘早佳’‘软丝’‘永泰’‘硬丝’5个品种聚为一组。其中,虽然‘早大梅’与‘早佳’、‘乌紫’与‘东岙早梅’、‘永泰’与‘硬丝’这3 个小支彼此亲缘关系最近,但实际是完全来源于不同地区的不同种质。调查表明,它们也没有异地引种更名。这说明,同一杨梅种间遗传距离有宽窄,遗传具有多样性,但不存在同物异名现象。该结果与先前对‘荸荠’及其芽变品种‘早佳’‘甬选56 号’进行遗传多样性分析的结果相一致:焦云等[35]和张淑文等[36]基于SSR 聚类分析得出,‘早佳’与母体‘荸荠’聚为一组,但为不同小支,‘甬选56 号’也与‘荸荠’聚为一组,但也位于不同小支上,表明亲缘关系间存在一定的差异。关于变异的差异性还可从与遗传相关的叶片气孔上得到佐证。陈方永等[37]研究表明,‘荸荠’的气孔密度和面积与其3 个芽变后代‘早荠’‘晚荠’‘甬选56号’存在显著差异。其中:作为母体‘荸荠’的气孔密度为780.91 mm-2、面积为59.18 μm2;而作为‘荸荠’变异的‘早荠’,分别为1 003.71 mm-2和69.57 μm2;‘晚 荠’为1 124.44 mm-2和48.03 μm2;‘甬选56号’为742.52 mm-2和55.85 μm2。
目前,对于杨梅遗传多样性、亲缘关系的鉴定主要采用传统分子标记的手段。如:林旗华等[38]利用相关序列扩增多态性(sequence-related amplified polymorphism,SRAP)标记技术对18 份杨梅种质资源进行了遗传多样性分析;ZHANG 等[39-40]使用扩增片段长度多态性(amplified fragment length polymorphism,AFLP)标记对100 份杨梅进行遗传多样性分析,并通过筛选杨梅果实表达序列标签(expressed sequence tag,EST)库开发了11对SSR标记;XIE 等[41]利用14 对SSR 标记对122 个杨梅品种进行了遗传多样性分析。与上述传统分子标记相比,SNP 分子标记具有高丰度、高稳定性和高通量等优点[42-43],在杨梅上尚未见报道。本研究通过比对‘永泰’与亲本‘硬丝’基因组SNP变异位点,共得到4 660个SNP变异位点。这些位点分别在转录翻译、蛋白质合成、新陈代谢、酶催化等方面发挥了相应的功能。在叶片方面,‘永泰’叶片大、叶肉厚,蜡质层明显,这可能是由与叶片生长发育、生长素合成等相应的SNP 位点变异所致;‘永泰’叶缘呈波状,下表面叶脉凸出,可能是由与叶片的形态发育相应的SNP位点变异所引起的。在果实上,‘永泰’果实成熟期比亲本早2~3 d,这可能与果实成熟相关的SNP位点的变异有关。
综上所述,‘永泰’为‘硬丝’的芽变,其芽变的机制可能是因为DNA 分子中的SNP 位点产生了多处变异,导致基因组序列和结构发生变异,在形态学典型变异上表现为大叶大果。同时,基于高通量重测序技术,本文开发了杨梅SNP 分子标记,有助于开展杨梅等果树种质资源的遗传多样性研究,加快育种进程。
