白皮杉醇对过氧化氢诱导的血管平滑肌细胞凋亡的影响与机制
2021-01-10李文娣吴雷琪黄全忠
李文娣 吴雷琪 黄全忠
动脉粥样硬化(atherosclerosis, As)是机体对血管内皮细胞损伤的一种慢性反应[1],As 的发病机制与氧化应激损伤、血脂代谢紊乱、炎症反应等密切相关[2]。 AS 损伤的各时期均存在细胞凋亡,而斑块中凋亡的细胞包括血管平滑肌细胞(vascular smooth muscle cells, VSMCs)。 VSMCs 是血管壁的主要成分,其结构和功能的异常可导致成熟AS 斑块不稳定以及心脑血管疾病的发生发展[3-4],而VSMCs 的过度增殖和凋亡是造成动AS 发生病变的关键因素。
白皮杉醇(piceatannol,PCT)是一种具有较强抗氧化活性的多酚物质,可以清除自由基,提高机体免疫力[5]。 有研究证实,PCT 还具有抑制炎症反应与抵抗细胞凋亡的作用[6],并且能够抑制肿瘤细胞的生长,降低癌症的发生率[7-8]。 而关于白皮杉醇在抑制AS 进展及预防介入治疗心血管疾病的研究却不多。 本文以过氧化氢(hydrogen peroxide, H2O2)为凋亡诱导剂,观察白皮杉醇对H2O2诱导的VSMCs 凋亡的影响及相关凋亡蛋白的表达变化,探讨其抗凋亡机制。
材料与方法
1.动物 健康,雄性Sprague-Dailey 大鼠,15只,体质量平均(100±10)g,购于北京生命科学研究所,动物许可证号:SYXK(京)2018-0022。
2.试剂 白皮杉醇(PCT,>98%),DMEM,FBS和MTT 购于美国Sigma 公司,兔抗Bcl-2、Bax、caspase-3、PI3K、p-PI3K、Akt、p-Akt、eNOS、p-eNOS、
鼠抗β-actin、山羊抗鼠IgG、山羊抗兔IgG 等抗体以及Bio-Rad 试剂盒购于美国Millipore 公司,LDH 测定试剂盒,超氧化物歧化酶(SOD)测定试剂盒,Annexin V/PI 凋亡试剂盒和Hoechst 33258 均购于碧云天生物技术研究所。 其他试剂为进口分装或国产分析纯。
3.VSMCs 获取与培养 摘取健康雄性SD 大鼠胸主动脉血管,除去血管中粘连的结缔组织和脂肪组织,刮取血管中膜,将其剪成约1 mm×1 mm 组织块,贴于培养瓶内,于37 ℃,5% CO2条件下用含20% FBS 的DMEM 培养液进行培养,培养液每3 d更换1 次。 待生长至60% ~80%融合时,加入0.25%胰蛋白酶消化传代。 倒置相差显微镜下观测原代VSMCs 为梭形,长成致密细胞层时出现典型的“峰-谷”状结构。 实验中使用第3~8 代细胞。
4.分组与处理 (1)400 μM H2O2处理VSMCs不同时间(1,2,4,8 h)诱导细胞过氧化损伤。
(2)不同浓度H2O2(100,200,400,800 μM)处理VSMCs 2 h 以诱导过氧化损伤。
(3)白皮杉醇(piceatannol,PCT)预处理2 h 后,H2O2继续处理2 h,具体分为五组:①对照组(control),VSMCs 正常培养2 h;②H2O2组,VSMCs 在含有400 μM H2O2的培养基中培养2 h;③10 μM PCT+400 μM H2O2,10 μM PCT 预处理VSMCs 2 h后,400 μM H2O2继续处理VSMCs 2 h;④20 μM PCT+400 μM H2O2,20 μM PCT 预处理VSMCs 2 h后,400 μM H2O2继续处理VSMCs 2 h;⑤40 μM PCT+400 μM H2O2,40 μM PCT 预处理VSMCs 2 h后,400 μM H2O2继续处理VSMCs 2 h。
5.MTT 法 将VSMCs 以1×105个/孔的密度接种到96 孔板中,培养24 h。 按1.4 进行不同处理后,离心弃上清,每孔加入20 μL 二苯基溴化四氮唑蓝(MTT)溶液,37 ℃孵育4 h,接着加入200 μL 二甲基亚砜(DMSO),微量震荡仪震荡至生成的蓝紫色甲臜完全溶解,于酶标仪570 nm 下测定吸光度(OD)值。
6.LDH 和SOD 测定 LDH 测定:VSMCs 按1.4(3)分组进行相应处理后,吸取培养液,在2 000 r/min,4 ℃下,离心10 min 后,收集上清液按照试剂盒说明进行测定。
SOD 测定:VSMCs 按1.4(3)分组进行相应处理后,加入0.25% 胰蛋白酶消化并收集细胞;2 000转/min,4 ℃下离心10 min,弃上清;加入1 mL PBS,2000 r/min,4 ℃下离心10 min,重复3 次。 细胞沉淀中加入0.5 mL PBS 溶液,重悬并混匀,在冰水浴条件下研磨细胞,取匀浆液按照试剂盒说明进行测定。
7.Annexin V-PI 检测 将VSMCs 以2×105个/孔的密度接种到6 孔板,于37 ℃、5% CO2培养箱中培养24 h。 待细胞完全贴壁后,进行以下分组处理:①对照组(control),VSMCs 正常培养2 h;②H2O2组,400 μM H2O2处理VSMCs 2 h;③PCT 预处理组,40 μM PCT 预处理VSMCs 2 h 后,400 μM H2O2继续处理VSMCs 2 h。 处理完毕后,用不含EDTA 的胰酶消化并收集细胞,用预冷的PBS 洗涤两次,加入500 μL 1×Binding Buffer 重悬细胞,在细胞悬浮液加入5 μL Annexin V-FITC,接着加入10 μL PI,室温避光孵育20 min,立即用流式细胞仪进行检测,数据用CELL QUEST 软件分析处理。
8.Hoechst 33258 检测 将VSMCs 以2×105个/孔接种于6 孔板中,培养24 h。 按1.7 中分三组进行相应处理后,PBS 洗涤两次,使用4%多聚甲醛固定15 min,PBS 冲洗,加入Hochest 33258 37 ℃避光染色10 min, PBS 洗涤两次。 在倒置荧光显微镜下观察细胞核形态的改变。
9.Western blot 检测 收集按1.4(3)分组处理后的VSMCs,分别加入RIPA 裂解液裂解细胞,提取总蛋白,通过Bio-Rad 试剂盒测定蛋白质的浓度,10%SDS-PAGE 凝胶电泳分离蛋白,切胶并转移至PVDF膜上,5% 脱脂奶粉室温封闭2 h,分别加入兔抗Bcl-2(1 ∶1 000),兔抗Bax(1 ∶1 000),兔抗caspase-3(1 ∶1 000),鼠抗β-actin(1 ∶5 000),兔抗PI3K(1 ∶1 000),兔 抗p-PI3K(1 ∶ 1 000),兔 抗Akt(1 ∶1 000),兔抗p-Akt(1 ∶1 000),兔抗eNOS(1 ∶500),兔抗p-eNOS(1 ∶500)在4 ℃下过夜。 一抗孵育后,TBST 漂洗PVDF 膜3 次,将PVDF 膜与HRP 标记的山羊抗小鼠IgG 或山羊抗兔IgG 抗体(1 ∶5 000)常温孵育2 h,TBST 洗膜3 次后,滴ECL 发光液进行曝光,使用Image J 定量分析目标条带的灰度值。
10.统计学方法 数据采用SPSS 22.0 统计学软件处理。 计量资料以均数±标准差表示,多组间数据比较采用one-way ANOVA 检验,两两比较采用LSD-t 检验。 以P<0.05 为差异有统计学意义。
结 果
1.H2O2对VSMCs 存活率的影响 VSMCs 经400 μM H2O2的不同时间处理后,与对照组(0 h)比较,H2O2处理1 h 后细胞存活率显著下降(P <0.05),而处理2 h 后,降至约为50%(P<0.01),8 h后<20%(P<0.001,图1A)。 与对照组(0 μM)相比,200 μM H2O2处理使细胞存活率显著下降(P<0.01),400 μM H2O2处理后细胞存活率约为50%(P<0.01),而800 μM H2O2处理后细胞存活率仅约为30%(P<0.001)(图1B)。 结合以上实验结果,选择400 μM H2O2处理2 h 建立VSMCs 损伤模型,进行后续实验。
2.PCT 对H2O2诱导的VSMCs 存活率的影响VSMCs 经不同浓度PCT 处理2 h 后,细胞活性无变化(图2 A)。 VSMCs 经不同浓度PCT 预处理2 h后,再加入400 μM H2O2处理2 h(图2B),与对照组相比,H2O2组存活率显著降低(P <0.01);与H2O2组相比,不同浓度PCT 预处理2 h 后均可提高细胞存活率,且呈剂量依赖关系,40 μM PCT 预处理下细胞存活率可恢复到80% 左右(P<0.01)。
3.PCT 对H2O2诱导的VSMCs 中SOD、LDH 活力的影响 与对照组相比,H2O2组VSMCs 中SOD活力显著下降(P <0.01);与H2O2组相比,VSMCs经不同浓度PCT 预处理2 h 再加400 μM H2O2处理2 h 后,VSMCs 中SOD 活力显著升高(P<0.01)(图3 A)。 与对照组相比,H2O2组VSMCs 中LDH活力显著升高(P<0.01);用不同浓度PCT 预处理VSMCs 2 h,再加入400 μM H2O2处理2 h 后,与H2O2组相比,PCT 能够明显降低LDH 的活力并呈浓度依赖关系(图3B)。
4.PCT 对H2O2诱导的VSMCs 凋亡的影响结合上述实验结果,选用40 μM PCT 进行VSMCs的预处理后检测凋亡情况。 结果表明,与对照组比较,H2O2组VSMCs 凋亡率显著增加(P<0.01);与H2O2组比较,40 μM PCT 预处理后VSMCs 凋亡率则显著降低(P<0.01,图4)。
5.PCT 对H2O2诱导的VSMCs 细胞和细胞核形态的影响 倒置显微镜下观察各组VSMCs(图5 A),对照组细胞形态为梭形,细胞密度大,细胞边界清晰;H2O2组细胞数量明显减少,细胞形态变得不规则,伪足回缩明显;40 μM PCT 预处理后能减轻H2O2所致的VSMCs 损伤,可使细胞伪足回缩减轻。
Hoechst 33258 结果显示,对照组VSMCs 细胞核呈圆形、染色质均匀、边缘清晰,蓝色荧光弱,略见细胞核边缘不规则的凋亡细胞;H2O2组细胞核固缩,细胞核或细胞质内可见浓染致密的荧光,有细胞核破裂成碎片状;而40 μM PCT 预处理后明显改善了VSMCs 的细胞凋亡形态,减少凋亡细胞数量(图5B)。
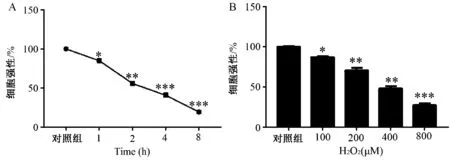
图1 H2O2 对VSMCs 活力的影响 A:400 μM H2O2 处理VSMCs 不同时间后的细胞存活率;B:不同浓度H2O2 处理VSMCs 2 h 后的细胞存活率,注:与对照组相比,*P<0.05,** P<0.01, ***P<0.001
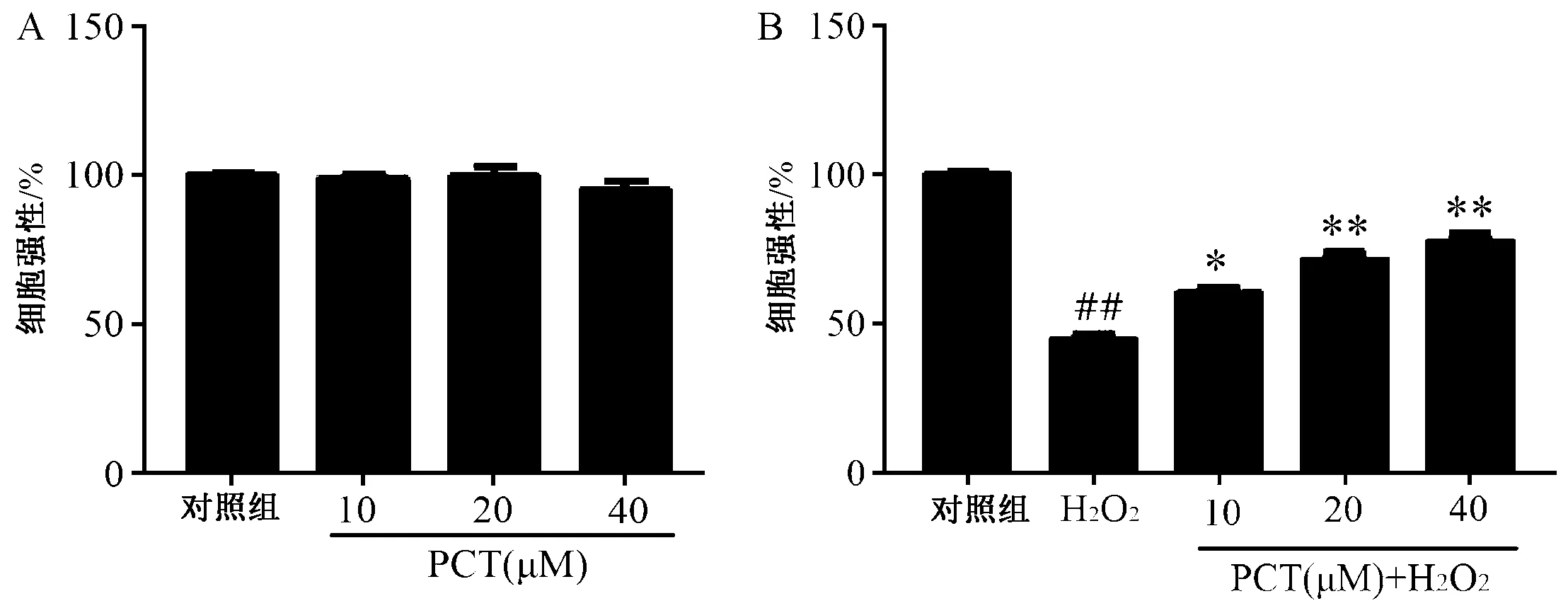
图2 PCT 对H2O2 损伤VSMCs 活性的影响A:不同浓度PCT 处理VSMCs 2 h 后的细胞存活率;B:不同浓度PCT 预处理VSMCs 2 h,400 μM H2O2 再处理2 h 后的细胞存活率,注:与对照组相比,## P <0.01;与H2O2 组相比,*P<0.05,**P<0.01

图3 PCT 对H2O2 损伤VSMCs 中LDH、SOD 活力影响 A: 不同浓度PCT预处理VSMCs 2 h,400 μM H2O2 再处理2 h 后VSMCs 中SOD 活力变化;B: 不同浓度PCT 预处理VSMCs 2 h,400 μM H2O2 再处理2 h 后VSMCs 中LDH 活力变化 注:与对照组相比,##P <0.01;与H2O2 组相比,* P <0.05,**P<0.01
6.PCT 对H2O2诱导的VSMCs 相关凋亡蛋白的影响 与对照组相比,400 μM H2O2作用2 h 后,VSMCs 中Bax 和caspase-3 的蛋白表达水平显著增加(P<0.01),而Bcl-2 的蛋白表达水平显著下降(P<0.01)。 与H2O2组相比,不同浓度PCT 预处理后,Bax、caspase-3 蛋白表达水平随PCT 浓度增加而逐渐下降(P<0.01), Bcl-2 蛋白表达水平却逐渐增加(P<0.05 或P<0.01,图6)。
7.PCT 对H2O2诱导的VSMCs 中PI3K/Akt/eNOS 信号转导途径的影响 与对照组相比,400 μM H2O2处理VSMCs 2 h 后,细胞中p-PI3K、p-Akt 和peNOS 的蛋白表达水平显著下降(P<0.01);与H2O2组相比,不同浓度PCT 预处理2 h 后H2O2再处理,p-PI3K、p-Akt、p-eNOS 的蛋白表达水平逐渐升高,且呈浓度依赖关系(P<0.05 或P<0.01,图7)。

图4 Annexin V/FITC 染色检测PCT 对H2O2 损伤VSMCs 凋亡的影响 A:对照组;B:400 μM H2O2 处理组;C:40 μM PCT+400 μM H2O2 处理组;D:各组VSMCs 凋亡率, 注: 与对照组相比,##P <0.01,与H2O2 组相比,**P<0.01

图5 PCT 对H2O2 损伤VSMCs 形态和细胞核的影响 A: 倒置显微镜观察各组VSMCs 形态变化;B: Hoechst 33258 检测各组VSMCs 凋亡情况。 从左到右依次为:对照组, 400 μM H2O2 处理组,40 μM PCT+400 μM H2O2 处理组
讨 论
在血管内膜损伤的早期,VSMCs 被激活后通过释放基质金属蛋白酶导致细胞外基质、胶原或弹力纤维的解离,促使VSMCs 增殖与迁移,同时,VSMCs的大量增殖也会使得新生内膜的增厚及血管腔的狭窄,VSMCs 可通过稳固纤维帽而使AS 斑块稳定[1],但随着病变发展到晚期阶段,VSMCs 作为AS 发展中的关键炎症细胞,其不正常凋亡及坏死将会导致斑块不稳定以及血栓的形成[9-10]。 有研究表明,氧化应激反应在AS 的病程发展中至关重要,H2O2作为血管细胞中最重要的活性氧,能够被过氧化物酶催化产生氧次氯酸[11]。 因此,本研究建立了由H2O2诱导的氧化应激VSMCs 模型,探讨了PCT 在AS 中的作用,研究结果表明,VSMCs 经不同时间和不同浓度的H2O2处理后,其活性明显下降,导致VSMCs 的死亡数目增加。

图6 PCT 对H2O2 诱导VSMCs 中相关凋亡蛋白表达的影响 A: Western blot检测各处理下VSMCs 凋亡相关蛋白表达水平;B ~D: 各处理下VSMCs 中Bcl-2、Bax、caspase-3 蛋白相对表达量, 注:与对照组相比,##P <0.01;与H2O2组相比,* P<0.05,**P<0.01

图7 PCT 对H2O2 处理的VSMCs 中PI3K、Akt、eNOS 磷酸化水平的影响 A:Western blot 检测各组VSMCs PI3K-Akt-eNOS 信号通路相关蛋白的表达;B ~D 依次为:各处理VSMCs 中p-PI3K、p-Akt、p-eNOS 蛋白相对表达量 注:与对照组相比,##P <0.01;与H2O2组相比,* P<0.05,**P<0.01
通过本研究表明,PCT 可以对H2O2诱导的VSMCs 损伤起到保护作用,PCT 预处理VSMCs 可呈浓度依赖地抑制H2O2诱导的VSMCs 活力降低与凋亡率增加。 LDH 的释放与细胞膜完整性相关,一旦细胞膜受损,LDH 会释放到细胞外,因此通过检测细胞培养上清液中LDH 的水平即可判断细胞的受损程度[12]。 SOD 可清除细胞内自由基,对抗与阻断因氧自由基对细胞造成的损害,并及时修复受损细胞,复原因自由基造成的对细胞伤害[13]。 为了进一步确定用PCT 预处理是否可以减轻H2O2诱导的损伤,我们检测了VSMCs 中LDH 与SOD 活力,结果显示PCT 预处理可使细胞内LDH 活力下降而SOD 活力升高,证明PCT 可以增强VSMCs 抗氧化能力。
Bcl-2 和Caspase 蛋白家族在细胞凋亡过程中发挥着重要作用。 Bcl-2 家族蛋白可通过影响线粒体膜的通透性来调控细胞凋亡,其中Bcl-2 具有抑制凋亡的功能,而Bax 可以与Bcl-2 结合形成异二聚体,从而促进细胞凋亡[14]。 本研究结果表明,H2O2诱导下VSMCs 中Bax 和caspase-3 的蛋白表达水平明显增加,Bcl-2 蛋白表达水平明显减少,而PCT 预处理VSMCs 后,Bax 和caspase-3 蛋白表达随PCT 浓度增加而逐渐下降,Bcl-2 蛋白表达逐渐增加。
PI3K/Akt 信号通路被认为是调控细胞生长、存活和转移的关键通路[15],可起到抑制中性粒细胞的活化与聚集,减轻细胞的凋亡以及保护线粒体等作用。 eNOS 是PI3K/Akt 通路下游的重要底物之一,Akt 可以直接激活eNOS 释放NO,从而起到保护冠状动脉、抑制血小板粘附及减轻炎症反应等作用[16]。 已有研究表明,激活PI3K/Akt 通路可促进VSMCs 增殖、凋亡与迁移[17]。 本研究结果显示,H2O2诱导下VSMCs 中p-PI3K、p-Akt 和p-eNOS 蛋白表达水平下降,而PCT 预处理后p-PI3K、p-Akt 和p-eNOS 的蛋白表达水平呈浓度依赖性地升高,推测PCT 抗VSMCs 凋亡作用可能由PI3K/Akt/eNOS 信号通路所介导。
综上所述,PCT 对H2O2损伤的VSMCs 具有一定的保护作用,可以减轻H2O2诱导的VSMCs 细胞凋亡,可能是通过激活PI3K-Akt-eNOS 信号传导途径实现的。 本研究为动脉粥样硬化提供了新的治疗靶点及治疗手段,并为进一步阐明动脉粥样硬化以及其他血管增生性疾病的机理提供了新的视角。 然而,目前对PCT 的研究还是普遍集中在生物活性上,临床药理学方面的研究和应用仍相对较少,同时,PCT 对人体治疗的有效性也尚未确立,仍需通过大量的基础研究及临床试验来进一步探讨其在心血管疾病的具体作用。
