半定量RT-PCR 方法检测Gch2 基因在草金鱼皮肤中的表达
2021-01-08李俊茹崔长海王良炎
冯 彩, 胡 菊, 李俊茹, 崔长海, 王良炎
(河南师范大学水产学院, 河南新乡453007)
体色是鱼类的重要表型性状之一,由鱼类皮肤及鳞片中色素细胞的种类、数量和分布情况决定[1-2]。色素细胞由外胚层神经嵴细胞分化形成,在胚胎发育过程中,神经嵴细胞沿背腹轴分化成包括色素细胞在内的不同类型细胞[3]。色素细胞种类不同,所含有的色素颗粒存在较大差异。黑色素细胞具有含有黑色素的色素小体,红色素/黄色素细胞具有包含类胡萝卜素、喋啶成分的红/黄色素小体。虹彩细胞合成含有嘧啶成分的色素小体[4-6]。喋啶代谢通路调控喋啶色素合成,Gch2是喋啶合成通路的重要限速酶。在斑马鱼(Danio rerio)和花鳉(Poecilia reticulata)等鱼类中,喋啶代谢通路是调控体色变化的一条重要代谢通路,其终产物为黄色和微红的喋啶色素。这些色素是以GTP为底物经过该通路转化而来。该通路由3个步骤组成:(1)三磷酸鸟苷(GTP)在GTP环化水解酶及其他酶的催化下合成四氢生物蝶呤;(2)四氢生物蝶呤作为辅助因子参与喋啶通路反应后的再生[7];(3)黄色素、墨蝶呤及其衍生物和蝶呤的合成。Gch2是喋啶代谢通路的限速酶,对黄色素、喋啶、果蝇蝶呤等色素的合成起重要的调控作用[8]。
草金鱼(Carassius auratus)属于鲤科(Cyprinidae)、鲫属(Carassius),是鲫(Carassius auratus)的一个变种,因体色丰富且组合形式多样深受人们喜爱,具有十分重要的观赏价值[9]。草金鱼的体色有红色、黑色、白色、红白和五花等,是研究鱼类乃至脊椎动物体色变化的重要实验材料[9]。目前为止,所有的草金鱼品系表型性状差异主要集中在尾鳍及体表色泽上,远不及其他观赏鱼如金鱼、锦鲤的种类丰富,且具有较高观赏价值的草金鱼个体较少[10]。因此,研究其体色发生和形成机理,是草金鱼遗传育种中亟待解决的问题。本文旨在通过半定量PCR分析Gch2 mRNA在纯红、纯白和黑黄体色草金鱼皮肤中的表达情况,为更深入理解Gch2基因在草金鱼体色形成中的作用提供参考数据。
1 材料
1.1 实验鱼
实验材料取自河南师范大学水产养殖基地,均为2龄草金鱼,选择纯色的红色、白色草金鱼的皮肤,黑黄色草金鱼的黄色皮肤和黑色皮肤进行RNA提取实验。
1.2 Total RNA提取及完整性检测
按照RNAiso Plus试剂(TaKaRa公司,大连)说明书步骤分别提取不同体色草金鱼皮肤的RNA。取3 μL样品进行非变性琼脂糖凝胶电泳,通过紫外凝胶成像系统观察提取的RNA的完整性。
1.3 cDNA第一链合成
根据前述检测结果,取调整后达到等量的不同体色草金鱼RNA,参照PrimeScript RT 反转录试剂盒(TaKaRa公司,大连)合成cDNA第一链。
1.4 Gch2及常用内参基因β-actin的PCR扩增
根据定量PCR引物的设计原则,利用Primer Premier3.0 软件,设计草金鱼Gch2的引物及β-actin的引物,引物序列见表1,由上海生工合成。PCR反应体系如表2所示。
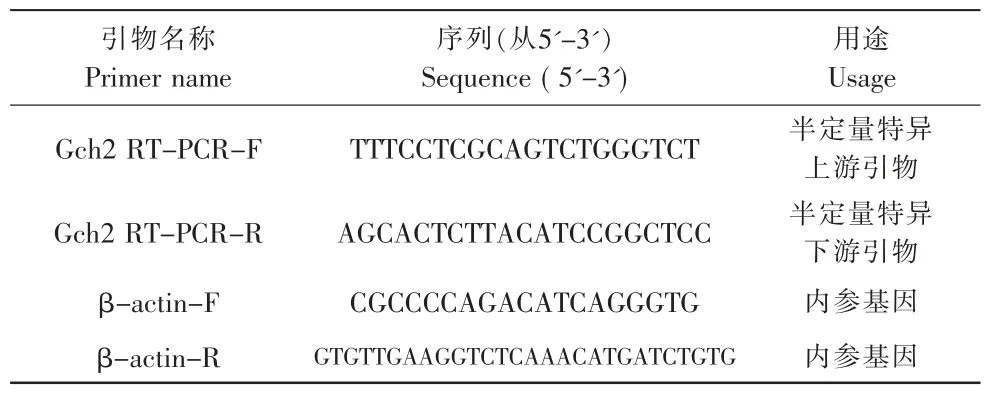
表1 PCR引物序列Tab.1 PCR primer sequence

表2 半定量PCR反应体系Tab.2 The reaction system of Semi-QRT-PCR
采用的扩增程序为:94 ℃预变性3 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,进行30个循环;72 ℃延伸5 min。反应完成后进行琼脂糖凝胶电泳检测,EB染色,紫外灯观察照相。β-actin的PCR扩增体系同表2。所有实验结果平行重复3次。
2 结果
2.1 总RNA提取及cDNA第一链合成
提取的不同体色草金鱼皮肤的RNA经凝胶电泳检测(图1),可观测到清晰的28s和18s条带,28s rRNA条带基本为18s rRNA条带亮度的2倍,表明提取的RNA完整性良好,无降解,可以用于本实验后续研究。
用ND-2000核酸蛋白仪检测RNA浓度和OD值,一般以1.8<A260/A280(Ratio,R)<2.0为标准,表明所提RNA质量符合要求,将合格RNA暂存于-80 ℃用于后续实验。反转录体系中RNA量均为1 μg,从而保证反转录合成不同的cDNA样品之间可以达到良好的平行性,以此确保半定量PCR实验的一致性,提高半定量结果的可靠性。
反转录体系中RNA量均为3 ug,通过调整起始RNA的量,以等量的Total RNA反转录合成不同的cDNA样品之间可以达到良好的平行性,以此确保半定量PCR实验的一致性,提高半定量结果的可靠性。
2.2 Gch2基因在不同体色草金鱼皮肤的表达
不同体色草金鱼皮肤中Gch2的表达情况如图2。Gch2在红色、白色、黑黄色草金鱼的皮肤中均有表达。其中黑黄色草金鱼的黄色皮肤中Gch2的表达量最高,在红色草金鱼的皮肤中Gch2的表达略高于白色草金鱼,在黑黄色草金鱼黑色皮肤中Gch2表达量最低。重复试验结果一致,β-actin扩增条带在各样本表达比较均一,表明该PCR体系符合表达分析的要求。用软件Imagej Software对电泳条带进行分析也得到了相同的结果,见图3。
3 讨论
鱼类色素细胞起源于神经嵴的色素母细胞,由色素母细胞再分化成6种色素细胞,分别为黑、红、黄、白、蓝色素细胞和虹彩细胞[8]。当前阶段对黑色素细胞的分化、形成和黑色素合成等分子调控通路的研究较为清晰而对其他色素细胞的色素颗粒代谢调控研究较少[9-10]。黄色素细胞可以合成红/黄碟啶色素小体,在鱼类体色形成中具有重要作用,是仅次于黑色素细胞的重要研究对象。因此,黄色素细胞代谢通路的研究对认识鱼类体色的形成具有重要的理论意义。
喋啶代谢通路的最终产物为四氢生物蝶呤(BH4),BH4是多个代谢酶的辅助因子,在组织和细胞中均有表达[11-14]。因为Gch2是BH4从头合成路径和反向补救合成路径的关键催化酶,所以在斑马鱼和比目鱼中可以作为黄色素细胞的标记基因[15]。目前,Gch2在经济价值、观赏价值高的草金鱼中还没有相关研究。
鉴于草金鱼有多种体色模式,本研究选择常见的纯红、纯白、黑黄体色草金鱼作为研究对象。其中红色和黑黄色草金鱼所具有的色素细胞主要包含红色素细胞、黄色素细胞和虹彩细胞。而红色素细胞、黄色素细胞和虹彩细胞的色素颗粒主要为含有不同颜色的蝶啶体和类胡萝卜素小胞,从而使鱼体看起来呈橙色、黄色和红色[16]。分析结果发现,Gch2在纯红和黑黄色草金鱼黄色皮肤中的表达量相对较高。Gch2作为喋啶代谢通路的限速酶,其高表达将促使喋啶代谢通路活跃,喋啶色素合成量增加。纯白体色草金鱼皮肤中Gch2的表达量与纯红体色草金鱼的表达量相比偏低,这一结果同斑马鱼的研究结果近乎一致[17]。这可能是因为白色草金鱼的色素细胞主要包含白色素细胞和虹彩细胞[18],相较于红/黄色素细胞,白色组织的虹彩细胞可合成一部分无色的喋啶颗粒,但主要以嘌呤成分为主[19]。Gch2在黑黄色草金鱼的黑色皮肤中表达量最低,推测主要因为黑色草金鱼的色素细胞为黑色素细胞,黑色素细胞中的细胞器是由黑色素小体合成的,喋啶成分含量较少[20]。本研究初步揭示了Gch2基因在不同体色草金鱼皮肤中mRNA水平表达情况,旨在为深入探究Gch2在鱼类体色形成中的作用提供基础数据。
