绿针假单胞菌YL-1高产荧光性嗜铁素的摇瓶发酵工艺优化
2021-01-07余文杰乔俊卿易厚天左杨刘永锋刘邮洲
余文杰 乔俊卿 易厚天 左杨 刘永锋 刘邮洲





摘要:绿针假单胞菌(Pseudomonas chlororaphis)YL-1是一种对多种病原菌均有良好防治效果的生防菌株,前期研究结果表明,在室內缺铁培养基和自然环境中,绿针假单胞菌的主要抑菌物质是其分泌的荧光性嗜铁素(Pyoverdine,简称PVD)。为提高其嗜铁素的产量,采用摇瓶培养发酵,通过 Plackett-Burman 试验设计、中心组合(CCD)试验设计和响应曲面法,优化YL-1菌株高产嗜铁素的发酵培养基成分和发酵条件,最终获得YL-1菌株高产嗜铁素的最佳培养基成分为1.52 g/L丁二酸、2.00 g/L丁二酸钠、0.88 g/L MgSO4·7H2O、0.50 g/L (NH4)2SO4、0.50 g/L蔗糖、3.49 g/L KH2PO4,5.44 g/L K2HPO4,最佳培养条件:温度为26 ℃,pH值为7.0,发酵时间为36 h,接种量为2%,转速为180 r/min,装液量为250 mL三角瓶装50 mL液体。摇瓶试验结果表明,优化培养基成分及培养条件后,菌株YL-1嗜铁素的产量提高43.18%,D405 nm/D600 nm值为2.36,优化效果明显。
关键词:绿针假单胞菌;荧光性嗜铁素PVD;发酵培养基;发酵条件;工艺优化
中图分类号:S182 文献标志码: A
文章编号:1002-1302(2021)24-0225-08
收稿日期:2021-04-09
基金项目:国家自然科学基金 (编号:31672076);苏州市科技计划 (编号:SNG2018095) 。
作者简介:余文杰(1997—),男,安徽淮南人,硕士研究生,主要从事植物病害生物防治研究。E-mail:260717453@qq.com。
通信作者:刘邮洲,博士,研究员,主要从事植物病害生物防治与农药开发研究。E-mail:shitouren88888@163.com。
铁是一种地壳中广泛存在的微量元素,同时也是许多生物体维持正常生命活动所必需的,但由于铁元素的特性导致自然环境中可以使用的自由铁浓度远低于大部分微生物的生理需求[1]。为吸收土壤中的铁元素以满足自身需求,生物体需要形成一套高效的铁吸收机制来维持自身生命活动,包括还原机制、螯合机制以及质子化机制,其中,利用嗜铁素(siderophore,别称铁载体)来运转外界铁离子是生物体较为重要的一种螯合机制[2]。
假单胞菌(Pseudomonas spp.)是一种常见的革兰氏阴性菌,广泛存在于自然环境中,可以抑制多种植物病原菌的生长[3]。假单胞菌可以产生多种抗菌物质,已报道的主要是吩嗪类 (Phenazine,简称PHZ)、硝吡咯菌素 (Pyrrolnitrin,简称PRN)、藤黄绿脓菌素 (Pyoluteorin,简称PLT)、氢氰酸(HCN)和荧光性嗜铁素(Pyoverdine,简称PVD)等[4-5]。PVD作为一种铁螯合剂,可以螯合周围环境中的铁离子,使病原菌无法获得生长所必需的铁营养,生长发育受到抑制[6]。Chen等发现,台湾假单胞菌(P. taiwanensis)可以产生PVD,对水稻白叶枯病菌(Xanthomonas oryzae pv. oryzae)生长有抑制作用[7];Chlebek 等发现,产嗜铁素的荧光假单胞菌(P. fluorescens)BRZ63对多种病原真菌均有抑制作用[8];Ran等从马铃薯根际中分离出生防细菌-恶臭假单胞杆菌(P. putida)WCS358r菌株,该菌株产生的嗜铁素可以抑制桉树灰霉病的发生[9]。假单胞菌分泌的PVD的基本结构由二羟基喹啉集团、1条肽链、1条脂肪酸侧链组成,在自然光下呈黄绿色,紫外光激发时可以发生荧光反应,这一特性是其种属所特有的[10]。
绿针假单胞菌(P. chlororaphis)YL-1是笔者所在实验室从大豆根围分离获得的一株对多种病原菌均有良好抑制作用的生防菌[11]。前期研究结果表明,在室内缺铁培养基和自然环境中,菌株 YL-1 分泌的PVD具有明显的抑菌作用,且结构新颖[10]。本研究首先比较8种常见嗜铁素发酵培养基对菌株YL-1产生嗜铁素的影响,筛选出最佳的基础培养基,通过Plackett-Burman试验、中心组合(central composite design,简称CCD)试验和响应曲面法对菌株YL-1基础培养基成分进行优化;同时,采用单因素筛选的方法,探明菌株YL-1产嗜铁素的最佳培养条件,旨在为菌株YL-1的田间应用提供理论依据。
1 材料与方法
1.1 供试菌株和培养基
绿针假单胞菌YL-1由江苏省农业科学院植物保护研究所水稻病害与生物防治研究室保存。
8种常见培养基及配方:(1)1/2胰蛋白胨大豆琼脂(TSA)培养基:15.00 g胰酪大豆胨液体培养基,1 000 mL蒸馏水;(2)LB培养基:10.00 g胰蛋白胨、5.00 g酵母提取物、10.00 g NaCl、1 000 mL蒸馏水;(3)SM培养基:3.00 g KH2PO4、6.00 g K2HPO4、0.10 g MgSO4·7H2O、1.00 g (NH4)2SO4、4.00 g丁二酸、1 000 mL蒸馏水,pH值为7.0;(4)Iron-limited medium:12.80 g Na3PO4·7H2O、3.00 g KH2PO4、0.50 g NaCl、1.00 g NH4Cl、0.50 g MgSO4·7H2O、21.90 mg CaCl2、4.00 g葡萄糖、10.00 g酸水解酪蛋白、5 mL丙三醇、1 000 mL蒸馏水;(5)Succinate medium:3.00 g KH2PO4、6.00 g K2HPO4、0.10 g MgSO4·7H2O、1.00 g (NH4)2SO4、4.00 g丁二酸钠、1 000 mL蒸馏水、pH值为7.0;(6)金氏培养基甲:20.00 g蛋白胨、1.40 g MgCl2、10.00 g K2SO4、10 mL 丙三醇、1 000 mL蒸馏水;(7)金氏培养基乙:20.00 g蛋白胨、1.50 g K2HPO4、1.50 g MgSO4·7H2O、10 mL丙三醇、1 000 mL蒸馏水;(8)WW[12]培养基:1.50 g丙三醇、1.00 g酸水解酪蛋白、2.50 g MgSO4·7H2O、2.50 g K2HPO4、1 000 mL 蒸馏水、pH值为6.5。
1.2 主要试剂和仪器
主要试剂包括CuSO4、NH4Cl、NaCl、KH2PO4、MgSO4·7H2O均购自西陇化工股份有限公司;琼脂粉、胰蛋白胨、酵母提取物均购自生工生物工程(上海)股份有限公司;丁二酸、K2HPO4、(NH4)2SO4均购自上海麦克林生化科技有限公司;胰酪大豆胨液体培养基购自杭州百思生物技术有限公司;K2SO4、MgCl2、丁二酸钠、柠檬酸钠、甘油、葡萄糖、丙三醇均购自西陇化工股份有限公司;蔗糖、酸水解酪蛋白、蛋白胨、Na3PO4·7H2O、CaCl2、MnSO4均购自上海麦克林生化科技有限公司。
主要仪器包括电子天平(JM-A6002 余姚市纪铭称重校验设备有限公司)、离心机(Eppendorf AG Germany)、分光光度计(UVmini-1240 SHIMADZU)、恒温培养振荡器(ZWY-240 上海智城分析仪器制造有限公司)、光照培养箱(宁波东南仪器有限公司)、立式高压蒸汽灭菌器(LDZF-50L-Ⅱ 上海申安医疗器械厂)、超净工作台(SW-CJ-1CU 苏净集团苏州安泰空气技术有限公司)、微量移液槍(德国Eppendorf公司)、pH值仪[Starter 2100奥豪斯仪器(上海)有限公司]。
1.3 发酵种子液的制备
试验于2021年1月在江苏省农业科学院植物保护研究所进行。首先取-70 ℃冰箱保存的 YL-1 菌种于LB平板活化,28 ℃倒置培养,待平板上长出单菌落后,挑取单菌落接种于20 mL LB液体培养基中,28 ℃、180 r/min过夜培养,待培养液D600 nm≈1.0,即为发酵种子液。
1.4 培养基中嗜铁素产量的测定
参照文献[12]测定嗜铁素产量,将发酵种子液以1 ∶100比例转接至100 mL培养基中,28 ℃,180 r/min 摇菌培养48 h。取2 mL菌液于2 mL EP管中,6 000 r/min离心10 min,分离上清液和菌体。将上清液移入新的2 mL EP管中,菌体用2 mL PBS缓冲液充分悬浮。以无菌培养基为对照,测其上清液D405 nm值;以PBS缓冲液为对照,测其菌体D600 nm值。计算D405 nm/D600 nm值,即为嗜铁素的相对产量,试验重复3次。
1.5 发酵培养基筛选试验
1.5.1 基础培养基的筛选
比较菌株YL-1在8种常见培养基中的D405 nm/D600 nm值,筛选最佳的基础培养基。
1.5.2 发酵培养基单因素筛选
根据基础培养基筛选结果可知,菌株YL-1在SM培养基中嗜铁素产量最高,以SM培养基为基础培养基,研究不同碳源、氮源、金属离子以及盐离子对菌株YL-1产生嗜铁素的影响。
1.5.2.1 碳源对菌株YL-1产生嗜铁素的影响 在基础培养基的基础上,不改变其他成分,向基础培养基中加入丁二酸钠、蔗糖、甘油、葡萄糖;同时,将丁二酸替换为丁二酸钠、蔗糖、甘油、葡萄糖、嗜铁素产量测定同“1.4”节,观察碳源的增加或改变对菌株YL-1产生嗜铁素的影响。
1.5.2.2 氮源对菌株YL-1产生嗜铁素的影响 在基础培养基的基础上,不改变其他成分,向基础培养基中加入酸水解酪蛋白、蛋白胨;同时将(NH4)2SO4替换为酸水解酪蛋白、蛋白胨,嗜铁素产量测定同“1.4”节,观察氮源的增加或改变对菌株YL-1产生嗜铁素的影响。
1.5.2.3 金属离子及盐离子对菌株YL-1产生嗜铁素的影响 在基础培养基的基础上,不改变其他成分,向培养基中加入一定浓度的CaCl2、CuSO4、MnSO4、NaCl,嗜铁素产量测定同“1.4”节,观察金属离子以及盐离子的加入对菌株YL-1产生嗜铁素的影响。
1.5.3 Plackett-Burman试验与最陡爬坡试验
选取单因素筛选试验对嗜铁素产量有较大提高作用的影响因子,采用Design Expert 10软件设计PB摇瓶发酵试验,试验中每个因子设计高低2个水平,观察其对嗜铁素产生是否有显著影响,试验重复3次。根据PB试验结果,筛选出对嗜铁素产量有显著影响的培养基关键成分并采用最陡爬坡试验确定关键因素的用量,试验重复3次。
1.5.4 中心组合试验
在PB、最陡爬坡试验后,采用中心组合(CCD)试验对培养基关键成分进行响应曲面法优化,试验重复3次。
1.6 培养条件筛选
1.6.1 温度对菌株YL-1产嗜铁素的影响
培养基初始pH值为7.0,在含100 mL培养液的250 mL三角瓶中接种1%种子液,分别在24.0、25.0、25.5、26.0、26.5、27.0、27.5、28.0、30.0、32.0、34.0 ℃,180 r/min条件下培养48 h后测定嗜铁素产量,试验重复3次。
1.6.2 pH值对菌株YL-1产嗜铁素的影响
培养基初始pH值分别设定为6.4、6.6、6.8、7.0、7.2、7.4,共计6个处理,在含100 mL培养液的250 mL三角瓶中接种1%种子液,在26 ℃、180 r/min条件下培养48 h后测定嗜铁素产量,试验重复3次。
1.6.3 发酵时间对菌株YL-1产嗜铁素的影响
培养基初始pH值为7.0,在含100 mL培养液的250 mL 三角瓶中接种1%种子液,26 ℃,180 r/min条件下培养,取不同时间段的发酵液测定嗜铁素产量,试验重复3次。
1.6.4 接种量对菌株YL-1产嗜铁素的影响
培养基初始pH值为7.0,在含100 mL培养液的 250 mL 三角瓶中接种比例分别设定为0.5%、1.0%、2.0%、3.0%、4.0%,共计5个处理,26 ℃、180 r/min条件下培养36 h后测定嗜铁素产量,试验重复3次。
1.6.5 转速对菌株YL-1产嗜铁素的影响
培养基初始pH值为7.0,在含100 mL培养液的250 mL三角瓶中接种2%种子液,转速分别设定为140、160、180、200 r/min,共计4个处理,26 ℃培养36 h后测定嗜铁素产量,试验重复3次。
1.6.6 装液量对菌株YL-1产嗜铁素的影响
培养基初始pH值为7.0,分别在含50、75、100、125、150 mL 培养液的250 mL三角瓶中接种2%种子液,26 ℃、180 r/min培养36 h后测定嗜铁素产量,试验重复3次。
1.7 摇瓶发酵验证
根据CCD试验结果以及培养条件筛选结果,配制优化后的培养基,运用新的培养条件,与原始培养基进行比较,验证优化结果,试验重复3次。
1.8 数据分析
Plackett-Burman试验、中心组合试验及响应曲面试验均利用Design Expert 10软件进行设计和分析。
2 结果与分析
2.1 基础培养基的筛选
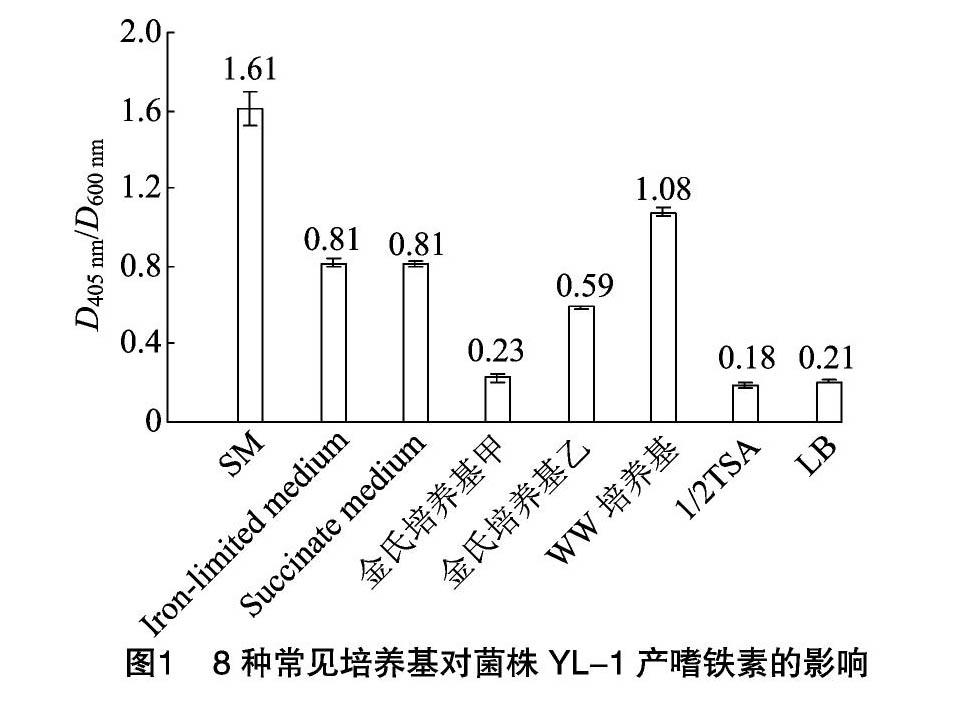
由图1可知,在8种培养基中,菌株YL-1在SM液体培养基中D405 nm/D600 nm值最高,达到1.61;其次是WW培养基,D405 nm/D600 nm值为1.08;菌株YL-1在金氏培养基甲、LB和1/2 TSA液体培养基中产生的嗜铁素较少,D405 nm/D600 nm值分别为0.23、0.21、0.18。试验结果说明,在8种常见培养基中,SM培养基最适合菌株YL-1产生嗜铁素。
2.2 发酵培养基单因素筛选
2.2.1 碳源对菌株YL-1产生嗜铁素的影响
由图2可知,单一碳源时,菌株YL-1在以丁二酸为碳源的SM液体培养基中嗜铁素产量最高,D405 nm/D600 nm值为1.61,其他碳源替换处理情况下,D405 nm/D600 nm值均明显下降;如果维持培养液中丁二酸成分不变,向其中加入丁二酸钠,D405 nm/D600 nm值为2.13,嗜铁素的产量提高32.29%,加入蔗糖时,D405 nm/D600 nm比值为1.64,嗜铁素产量也略有提升。因此,接下来的研究将以丁二酸、丁二酸钠、蔗糖为碳源进一步优化。
2.2.2 氮源对菌株YL-1产生嗜铁素的影响
由图3可知,(NH4)2SO4为菌株YL-1产嗜铁素的最佳氮源,D405 nm/D600 nm值为1.61。当氮源替换为酸水解酪蛋白时,D405 nm/D600 nm值为0.84,氮源替换为蛋白胨时,D405 nm/D600 nm值仅为0.48。此外,在基础培养基中增加氮源会降低菌株YL-1嗜铁素的产量。因此,将以(NH4)2SO4为氮源进行使用量的优化。
2.2.3 金属离子及盐离子对菌株YL-1产生嗜铁素的影响
由图4可知,SM培养基中加入金属离子及盐离子反而降低了菌株YL-1嗜铁素的产量,如在SM培养基中加入NaCl时,D405 nm/D600 nm值下降为0.55,加入MnSO4时,D405 nm/D600 nm值下降为0.46,加入CuSO4时,D405 nm/D600 nm值下降为0.41,加入CaCl2时,D405 nm/D600 nm值下降为0.21。据此说明,基础培养基中不需要再额外添加金属离子及盐离子。
2.3 PB试验与最陡爬坡试验
由表1可知,KH2PO4、K2HPO4、MgSO4·7H2O、丁二酸这4个因子对嗜铁素的产量有显著影响(P<0.05)。随后进行最陡爬坡试验来确定关键因子的最佳用量,当丁二酸、MgSO4·7H2O、KH2PO4、K2HPO4的用量分别为3.00、2.00、3.00、5.00 g/L时,培养液D405 nm/D600 nm值达到爬坡试验的最高值2.23。
2.4 CCD试验以及相应曲面分析
在基于PB试验和最陡爬坡试验的基础上,设计4因素5水平的CCD试验来确定各因素的最佳用量,对培养基成分进行进一步优化。对试验结果进行多重回归分析后,得出产物产率的二次多项方程式:Y=-5.571 27+2.227 71X1+1.350 63X2+0.417 39X3+1.610 56X4+0.059 861X1X2-0.235 19X1X3 -0.323 44X1X4-0.174 03X2X3-0.044 028X2X4+0.158 81X3X4-0.117 55X21-0.452 11X22-0.0703 02X23-0.132 93X24,校正系数R2=0.974 9。
式中:Y是嗜铁素产量的预测值;X1、X2、X3、X4分别是丁二酸、MgSO4·7H2O、KH2PO4、K2HPO4。方差分析结果见表2。试验中变异系数(CV)为9.14%(<10%),属于弱变异,证明试验数据的可靠性,表2中P、R2、F值都进一步证明了模型对嗜铁素产量预测的准确性。
根据得到的二次多项方程式求得4个因素的最优值,即丁二酸、MgSO4·7H2O、KH2PO4、K2HPO4的用量分別为1.52、0.88、3.49、5.44 g/L时,嗜铁素产量预测能达到最大,预测D405 nm/D600 nm值为2.25。
2.5 培养条件优化
2.5.1 温度和pH值对菌株YL-1产嗜铁素的影响
当温度处于25.5~26.5 ℃这一范围内时,嗜铁素产量较高,其中温度为26 ℃时,D405 nm/D600 nm值为2.39。当温度高于28 ℃时,菌株YL-1产嗜铁素的能力会迅速降低,32 ℃时,D405 nm/D600 nm值降低至1.56(图5)。培养液pH值对菌株YL-1产嗜铁素的影响较大。由图6可知,产嗜铁素的最适pH值出现在6.6~7.4这一范围内,其中培养液pH值为7.0时,D405 nm/D600 nm值为2.23,pH值为6.6、7.4时,D405 nm/D600 nm值分别为1.70、1.42。据此,研究中培养温度设定为26 ℃,pH值设定为7.0。
2.5.2 发酵时间、接种量、转速和装液量对菌株 YL-1 产嗜铁素的影响
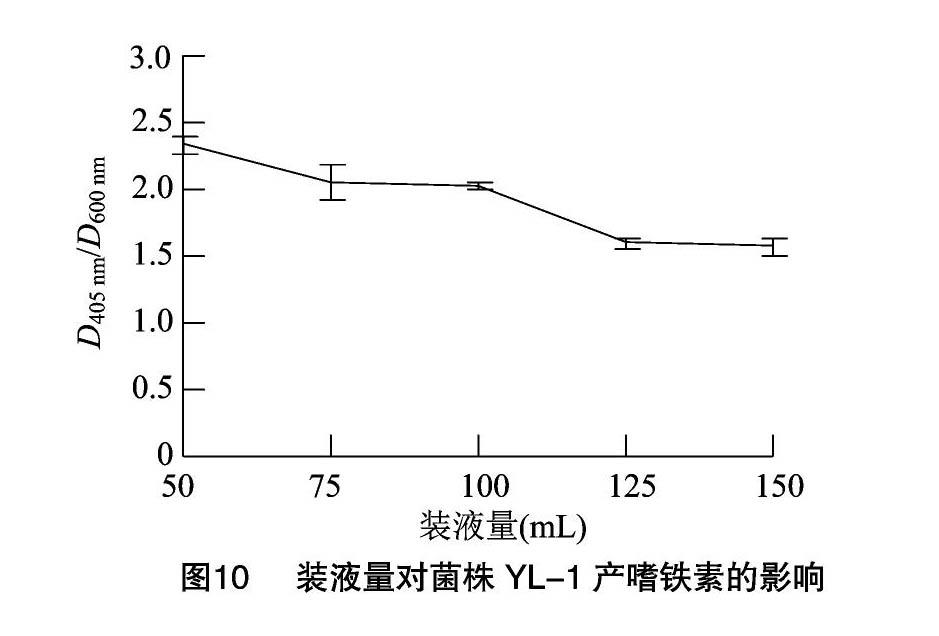
菌株YL-1嗜铁素的产量随着发酵时间的增加而不断提高,接种后12 h时,D405 nm/D600 nm值为0.65;24 h时,D405 nm/D600 nm值为1.25;36 h时,D405 nm/D600 nm值为1.68;48 h 时,D405 nm/D600 nm值达到1.69,与36 h相比,无显著差异,因此选择36 h为最佳发酵时间(图7)。随着接种量的提高,菌株YL-1嗜铁素的产量呈先上升后下降的趋势,当接种量为2%时,嗜铁素的产量最高,D405 nm/D600 nm值为2.30。当接种量继续上升后,菌株YL-1产嗜铁素的能力快速下降,当接种量为4%时,D405 nm/D600 nm值为1.31。这可能是由于嗜铁素的合成和菌株YL-1的生长处于一种动态平衡状态,当接种量增大时,菌株较多地利用培养基中的营养成分供自身生长,从而影响了嗜铁素的合成(图8)。当转速为180 r/min时,嗜铁素的产量最高,D405 nm/D600 nm值为2.05,其他过高或过低的3个转速反而会影响菌株YL-1产生嗜铁素的能力,当转速为140 r/min时,D405 nm/D600 nm值为1.22,当转速为200 r/min时,D405 nm/D600 nm值为1.69(图9)。当在250 mL三角瓶中装液50 mL时,菌株YL-1产嗜铁素的能力最高,D405 nm/D600 nm值为2.33。推测较少的装液量提高了瓶中的氧含量,因此提高了菌株YL-1生长繁殖的速度,进而增加了嗜铁素的产量(图10)。
2.6 摇瓶发酵验证
菌株YL-1在优化培养基中培养 36 h、温度为26 ℃、pH值为7.0、接种量为2%、转速为180 r/min以及装液量为50 mL(250 mL三角瓶中),D405 nm/D600 nm值为2.36(图11),与模型预测值接近。与原始出发培养基(SM培养基)相比,培养基和培养条件优化后菌株YL-1的嗜铁素产量提升43.18%,肉眼观察发酵液的颜色更加黄绿,紫外光下观察发酵液的荧光反应更加强烈(图12)。
3 讨论与结论
嗜铁素是假单胞菌产生的重要抗菌物质,通过螯合周围环境中的铁离子,形成不能为其他病原菌所利用的铁-嗜铁素复合物,从而起到抑制病原菌生长的作用。同时,嗜铁素也有促进植物生长的作用,武雯雯等发现,用嗜铁素处理黑麦草种子后,种子发芽率提高150.92%,提升效果显著[13]。Trapet等发现,荧光假单胞菌C7R12分泌的嗜铁素能促进拟南芥的生长[14]。而在临床医学上,嗜铁素作为一种铁螯合剂,可以用来治疗人体内铁过量而引发的疾病,如地中海贫血症[15]。除此之外,越来越多的医学研究人员对微生物的铁吸收系统非常有兴趣,由此引发药物的“特洛伊木马策略”,即利用铁载体摄取机制,将药物和铁载体偶联,使药物更容易进入靶向病原微生物,同时还不会产生抗药性[16-17]。因此,开发利用高产嗜铁素的生防菌、提高嗜铁素产量均具有重要意义。
有关嗜铁素发酵培养基及发酵条件筛选的研究,目前已有多篇报道,如伊艳杰等研究了荧光假单胞菌RB5产嗜铁素的发酵条件[18],梁建根等对恶臭假单孢菌(P. putida)HZ-2产生嗜铁素的发酵培养基及条件进行了筛选[19]。但这些报道大多只使用单因素筛选的方法来考察嗜铁素发酵条件,而且对培养基成分未做优化。近年来,Plackett-Burman试验设计和中心组合试验被广泛运用于微生物发酵工艺的筛选和优化[20]。许睿娉利用Plackett-Burman试验得到了枯草芽孢杆菌(Bacillus subtilis)HG-15菌株发酵最佳培养基,与基础培养基相比,发酵液菌体数量提高2.74倍[21],董文等采用Plackett-Burman设计对铜绿假单胞菌(P. aeruginosa)DN1产鼠李糖脂的发酵培养基及培养条件进行了优化,优化后鼠李糖脂的产量提高了73.97%[22]。Sen等通过响应曲面法对影响表面肌动蛋白产量的培养基成分以及发酵条件等进行了优化研究[23]。本研究通过比较菌株YL-1在不同培养基中嗜铁素的产量,筛选出基础培养基SM培养基,D405 nm/D600 nm值为1.61。随后通过Plackett-Burman试验、CCD试验以及响应曲面法优化菌株YL-1发酵培养基的成分,最终得出YL-1菌株高产嗜铁素的最佳培养基成分:1.52 g/L丁二酸、2.00 g/L 丁二酸钠、0.88 g/L MgSO4·7H2O、0.50 g/L (NH4)2SO4、0.50 g/L蔗糖、KH2PO4 3.49 g/L、5.44 g/L K2HPO4。模型预测的D405 nm/D600 nm值为2.25。随后利用单因素筛选得出最佳发酵条件:温度为26 ℃,pH值为7.0,培养时间为 36 h,接种量为2%,转速为180 r/min,装液量为 250 mL 三角瓶裝50 mL。通过实际摇瓶发酵验证可知,与初始SM培养基相比,优化后D405 nm/D600 nm值为2.36,嗜铁素产量提高43.18%,优化效果显著。
本研究结果显示,影响菌株YL-1产生嗜铁素的主要培养基成分是KH2PO4、K2HPO4、MgSO4·7H2O、丁二酸,这与王伟的报道[24]基本一致。此外,还发现虽然同为假单胞菌,但不同的菌株、不同的培养基成分对嗜铁素的产生影响很大。绿针假单胞菌YL-1产嗜铁素的最适温度为26 ℃,最适装液量为50 mL,而夏清强等通过对假单胞菌P11培养条件进行优化后,发现其最适温度为30 ℃[25];伊艳杰等研究发现,荧光假单胞菌RB5最适装液量为 90 mL[18]。当然,本研究仅在摇瓶中对绿针假单胞菌YL-1产嗜铁素的培养基成分和培养条件进行了筛选和优化,如需工厂化放大,还需要更多试验对其发酵工艺进行完善,为菌株YL-1的进一步开发利用提供科学依据。
参考文献:
[1]Wang Y,Brown H N,Crowley D E,et al. Evidence for direct utilization of a siderophore,ferrioxamine B,in axenically grown cucumber[J]. Plant,Cell & Environment,1993,16(5):579-585.
[2]Guerinot M L. Microbial iron transport[J]. Annual Review of Microbiology,1994,48(1):743-772.
[3]Subashri R,Raman G,Sakthivel N.Biological control of pathogens and plant growth promotion potential of fluorescent pseudomonads[M]//Bacteria in agrobiology:disease management. Berlin,Heidelberg:Springer Berlin Heidelberg,2012:77-110.
[4]金 颖,胡洪波,张雪洪,等. 假单胞菌产生的抗生素研究[J]. 上海农业学报,2005,21(3):106-109.
[5]赵 芳. 铜绿假单胞菌抗菌物质的研究[D]. 雅安:四川农业大学,2012:10-19.
[6]Nagata T,Oobo T,Aozasa O.Efficacy of a bacterial siderophore,pyoverdine,to supply iron to Solanum lycopersicum plants[J]. Journal of Bioscience and Bioengineering,2013,115(6):686-690.
[7]Chen W J,Kuo T Y,Hsieh F C,et al. Involvement of type Ⅵ secretion system in secretion of irochelator pyoverdine in Pseudomonas taiwanensis[J]. Scientific Reports,2016,6:32950.
[8]Chlebek D,Pinski A,Z·ur J,et al. Genome mining and evaluation of the biocontrol potential of Pseudomonas fluorescens BRZ63,a new endophyte of oilseed rape (Brassica napus L.) against fungal pathogens[J]. International Journal of Molecular Sciences,2020,21(22):8740.
[9]Ran L X,Xiang M L,Zhou B,et al. Siderophores are the main determinants of Fluorescent Pseudomonas strains in suppression of grey mould in Eucalyptus urophylla[J]. Phytopatology Research,2005,35(1):6-12.
[10]Liu Y Z,Dai C,Zhou Y Q,et al. Pyoverdines are essential for the antibacterial activity of Pseudomonas chlororaphis YL-1 under low-iron conditions[J]. Applied and Environmental Microbiology,2021,87(7):e02840-20.
[11]劉邮洲,Lu S E,Baird S M,等. 绿针假单胞菌YL-1抗细菌活性相关基因的克隆和分析[J]. 植物病理学报,2015,45(3):307-316.
[12]Visaggio D,Pasqua M,Bonchi C,et al. Cell aggregation promotes pyoverdine-dependent iron uptake and virulence in Pseudomonas aeruginosa[J]. Frontiers in Microbiology,2015,6:902.
[13]武雯雯,薛林贵,张 璐,等. 一株产嗜铁素耐镉菌的分离及其对黑麦草种子萌发的作用[J]. 微生物学通报,2021,48(6):1895-1906.
[14]Trapet P,Avoscan L,Klinguer A,et al. The Pseudomonas fluorescens siderophore pyoverdine weakens Arabidopsis thaliana defense in favor of growth in iron-deficient conditions[J]. Plant Physiology,2016,171(1):675-693.
[15]白国慧. 铜绿假单胞菌铁载体pyoverdine在周质空间合成途径中蛋白质结构与功能的研究[D]. 济南:山东大学,2014:5-20.
[16]Wencewicz T A,Mllmann U,Long T E,et al. Is drug release necessary for antimicrobial activity of siderophore-drug conjugates?Syntheses and biological studies of the naturally occurring salmycin “Trojan Horse” antibiotics and synthetic desferridanoxamine-antibiotic conjugates[J]. BioMetals,2009,22(4):633-648.
[17]Mislin G L A,Schalk I J.Siderophore-dependent iron uptake systems as gates for antibiotic Trojan horse strategies against Pseudomonas aeruginosa[J]. Metallomics,2014,6(3):408-420.
[18]伊艳杰,周广舟,时 玉,等. 荧光假单胞菌RB5产嗜铁素的发酵条件[J]. 河南工业大学学报(自然科学版),2011,32(6):32-35,39.
[19]梁建根,施跃峰,竺利红,等. 恶臭假单胞菌株HZ-2产嗜铁素的发酵条件研究[J]. 浙江农业学报,2008,20(4):266-269.
[20]代志凯,张 翠,阮 征. 试验设计和优化及其在发酵培养基优化中的应用[J]. 微生物学通报,2010,37(6):894-903.
[21]许睿娉. 枯草芽孢杆菌HG-15菌体发酵全可溶培养基配方与条件优化[D]. 泰安:山东农业大学,2020:21-35.
[22]董 文,黄 朝,李艳鹏,等. 响应曲面法优化铜绿假单胞菌DN1的产鼠李糖脂条件[J]. 基因组学与应用生物学,2017,36(12):5179-5186.
[23]Sen R,Swaminathan T. Response surface modeling and optimization to elucidate and analyze the effects of inoculum age and size on surfactin production[J]. Biochemical Engineering Journal,2004,21(2):141-148.
[24]王 伟. 荧光嗜铁素的发酵条件及其应用初探[D]. 上海:上海师范大学,2006:51-55.
[25]夏清强,汪劲松,潘继承. 产荧光嗜铁素菌株P11的发酵条件优化[J]. 化学与生物工程,2019,36(10):47-50.
