嘉宝果叶片多酚提取物的微生物转化及其对抗氧化活性的影响
2021-01-07吴妙鸿邱珊莲林宝妹李海明张帅郑开斌
吴妙鸿 邱珊莲 林宝妹 李海明 张帅 郑开斌
摘要:对嘉宝果叶片多酚提取物进行微生物转化,以期获得一种提高其抗氧化能力的方法。以总抗氧化能力(total antioxidant capacity,简称T-AOC)提高率为指标,研究菌种类型、底物浓度和转化时间对微生物转化的影响,并用高效液相色谱法(HPLC)分析底物的变化情况。结果表明,嘉宝果叶片多酚提取物经过黑曲霉转化后,T-AOC提高最明显,底物浓度、转化时间对转化效果的影响显著,最佳底物浓度为1.0 mg/mL,最佳轉化时间为2 d。在最佳转化条件下,嘉宝果叶片多酚提取物的T-AOC由0.506 mmol/L提高至0.818 mmol/L,而多酚含量由0.686 mg/mL下降至0.463 mg/mL。HPLC分析发现,黑曲霉转化嘉宝果叶片多酚提取物后产生了新的强极性物质。
关键词:嘉宝果叶片;多酚;微生物转化;抗氧化活性;黑曲霉
中图分类号: S667.901文献标志码: A
文章编号:1002-1302(2021)24-0184-05
收稿日期:2021-03-29
基金项目:福建省自然科学基金(编号:2020J011369);福建省公益类科研院所专项(编号:2019R1030-4)。
作者简介:吴妙鸿(1991—),女,福建漳州人,硕士,研究实习员,主要从事植物天然产物提取与利用研究。Tel:(0596)2122840;E-mail:miaohongwu@qq.com。
通信作者:邱珊莲,博士,副研究员,主要从事天然产物提取及功效研究。Tel:(0596)2122840;E-mail:slqiu79@163.com。
嘉宝果(Myrciaria cauliflora)是桃金娘科拟爱神木属热带亚热带常绿灌木,原产于南美洲,又名珍宝果、树葡萄[1],目前在我国仍被视为一种新型水果,主要种植地区为福建、广东、浙江等地。嘉宝果有很高的营养价值[2],具有消炎、抗氧化、降血糖等生物活性[3]。有研究发现,嘉宝果根、茎、叶、果实中都富含多酚类物质,以其叶片中的多酚含量最高,抗氧化和降糖活性最强[4],Duarte等研究发现,嘉宝果叶片中的总酚含量可达136.68 mg/g,单宁含量可达60.72 mg/g,嘉宝果叶片是开发抗氧化、降血糖保健食品药品潜在的理想天然来源[5],因此研究提高其提取物生物活性的方法具有实际意义。
多酚类化合物是一类以苯酚为基本骨架、具有多羟基结构的植物次生代谢产物,包括小分子量的多酚单体和具有高聚合结构的单宁物质,多数情况下酚类化合物是与单糖或多糖相结合,结构复杂,具有多种生物活性[6]。有研究发现,对酚类分子进行改性,如加入—CH3、—OCH3和—NH2等取代基团能够提高酚类的抗氧化活性[7]。微生物转化是一种修饰天然产物结构的方法,其利用微生物代谢过程中产生的一种或多种酶对底物进行催化反应,根据酶体系的转化效果可细分为羟基化、氢化、脱乙酰化、糖苷化、糖苷键水解、酯键水解、支链降解、酯化、酰基转移等反应类型[8]。利用微生物转化酚类物质,能选择性地改变其分子结构,显著提高生物活性[9],还能通过改变分子的极性、分子大小解决其溶解性差、生物利用度低等局限性[10-11]。胡丽云等利用霉菌对荔枝果肉中的多酚进行转化,发现11.2%结合酚被降解为游离酚,提高了多酚的生物利用度[12]。李东晓利用黑曲霉、棘孢曲霉转化八角金盘的酚酸类化合物,发现咖啡酰奎尼酸被水解为咖啡酸[13]。
目前,通过结构修饰提高嘉宝果叶片多酚提取物生物活性的相关研究还未见报道,而微生物转化法因无污染、高酶活、低成本等优点被广泛应用于天然产物结构修饰和分子改性[14-15],在提高提取物生物活性方面具有较大潜力。本研究利用微生物对嘉宝果叶片的多酚提取物进行转化,筛选最佳转化菌种,研究不同转化条件的影响,分析转化前后总抗氧化能力和成分的变化,以期获得提高嘉宝果叶片多酚提取物抗氧化活性的微生物转化方法,为其在食品、药品中的应用提供更多途径。
1 材料与方法
1.1 材料、菌种和试剂
试验材料:嘉宝果叶片于2020年8月在福建省农业科学院亚热带农业研究所嘉宝果苗圃采摘。
试验菌种:黑曲霉(Aspergillus niger),购自中国医学微生物菌种保藏管理中心;酿酒酵母(Saccharomyces cerevisiae)、构巢曲霉[Aspergillus nidulans (Eidam) Winter)]、红曲霉(Monascus anka)、青霉菌(Penicillium sp.),购自北纳创联生物技术有限公司。
试验试剂:沙氏葡萄糖培养基、麦芽汁培养基、查氏培养基、琼脂粉,购自广东环凯微生物科技有限公司;总抗氧化能力测定试剂盒(FRAP法),购自南京建成生物工程研究所;福林酚试剂,购自美国Sigma公司;没食子酸(纯度>98%),购自日本东京化成工业株式会社;色谱纯甲醇、色谱纯磷酸、分析纯硫酸镁七水合物,购自上海麦克林生化科技有限公司;分析纯无水乙醇、磷酸二氢钾、葡萄糖,购自西陇科学股份有限公司;分析纯碳酸钠、硫胺素,购自国药集团化学试剂有限公司。
1.2 仪器与设备
THZ-100B型恒温培养摇床,上海一恒科学仪器有限公司;LDZF-75L-Ⅲ型高压灭菌锅,上海申安医疗器械厂;YS-840-1型洁净工作台,上海博迅实业有限公司;CR22N型高速冷冻离心机,日本日立公司(HITACHI Limited);UPW-20N型超纯水机,北京历元电子仪器有限公司;BS110S型分析天平,德国赛多利斯集团;RE-52AA型旋转蒸发仪,上海亚荣生化仪器厂;GZX-9246MBE型电热鼓风干燥箱,上海博迅实业有限公司;SPX-150B-Z型生化培养箱,上海博迅实业有限公司;L5S型紫外分光光度计,上海仪电分析仪器有限公司;iMark酶标仪,美国伯乐(Bio-Rad公司;Ultimate 3000型高效液相色谱仪,美国Thermo Fisher公司。
1.3 试验方法
1.3.1 嘉宝果叶片多酚提取物的制备 嘉宝果叶片多酚的提取参考林宝妹等的方法[16],并作适当修改。将新鲜叶片于60℃烘干至恒质量,用中药研磨机粉碎后过40目筛。称取嘉宝果叶片粉末至离心管中,按1 g ∶80 mL的料液比加入体积分数为70%的乙醇溶液,充分混匀后于200 W、40 ℃超声处理10 min,随后继续振摇提取1 h。将提取悬浮液于 4 ℃、6 000 r/min离心15 min,收集上清液,在 50 ℃ 下减压旋蒸至无醇味,最后通过真空冷冻干燥得到嘉宝果叶片的多酚提取物粉末。
1.3.2 微生物活化和培养 用无菌水将菌种冻干粉末充分溶解成菌悬液,分别将黑曲霉、酿酒酵母、构巢曲霉、红曲霉、青霉接种于沙氏葡萄糖琼脂培养基、麦芽汁琼脂培养基、查氏琼脂培养基、PDA培养基(1 L,含20%马铃薯汁、20 g葡萄糖、15 g琼脂)、综合PDA培养基(1 L,含20%马铃薯汁、20 g葡萄糖、3 g KH2PO4、1.5 g MgSO4·7H2O、微量硫胺素、15 g琼脂)平板上,置于生化培养箱中,在30 ℃下活化培养 3~5 d,直至长出明显菌落。用无菌水将真菌洗下,将菌悬液浓度稀释为1×107 CFU/mL,用于微生物转化。
1.3.3 微生物转化 量取100 mL转化培养基于三角锥瓶中,高压灭菌15 min。采用适合菌種生长的液体培养基作为转化培养基(黑曲霉采用沙氏葡萄糖液体培养基,酿酒酵母采用麦芽汁培养基,构巢曲霉采用查氏液体培养基,红曲霉采用马铃薯液体培养基,青霉采用综合马铃薯液体培养基)。分为空白组、对照组和试验组,向空白组、试验组中分别加入1 mL的1×107 CFU/mL菌悬液,向对照组中加入 1 mL 无菌水,将各组三角锥瓶置于恒温振荡器中,于28 ℃、180 r/min培养1 d。用无菌水将叶片多酚提取物冻干粉末配制为一定浓度的溶液,分别在对照组、试验组中加入10 mL叶片提取物溶液,在空白组中加入10 mL无菌水,置于恒温振荡器中,于 28 ℃、180 r/min继续培养一定时间,最后滤去菌体即得微生物转化产物。
1.3.4 转化条件的测定 (1)转化菌种的影响:固定底物浓度为1.0 mg/mL,转化时间为3 d,研究黑曲霉、酿酒酵母、构巢曲霉、红曲霉、青霉转化对底物总抗氧化能力的影响。
(2)底物浓度的影响:以上述单因素试验确定的最佳菌种为转化菌种,固定转化时间为3 d,设置底物浓度为0、0.5、1.0、2.0 mg/mL,研究底物浓度对转化底物总抗氧化能力的影响。
(3)转化时间的影响:以最佳菌种为转化菌种,固定底物浓度为1.0 mg/mL,设置转化时间为0、1、2、3、4、5 d,研究转化时间对底物总抗氧化能力的影响。
1.3.5 总抗氧化能力的测定 总抗氧化能力测定采用总抗氧化能力测定试剂盒(FRAP法)。
1.3.6 总多酚含量的测定 总多酚含量的测定参考Tohidi等的方法[17]。将样品稀释15倍后,精确量取0.5 mL样品于玻璃试管中,随后依次加入 2.5 mL 0.1 mol/L福林酚试剂、2 mL 75 g/L碳酸钠溶液,用漩涡振荡器充分混匀后置于45 ℃水浴锅中反应15 min,最后于765 nm下测定吸光度。用质量浓度为0.01~0.08 mg/mL的没食子酸标准溶液代替样品绘制标准曲线,样品中的多酚浓度以单位体积样品中含有的没食子酸质量计,mg/mL。
1.3.7 多酚提取物转化前后的HPLC分析 转化前后的多酚提取物用水饱和乙酸乙酯按1 ∶2的体积比振摇萃取3次,合并乙酸乙酯层,减压旋蒸除去乙酸乙酯,用色谱纯甲醇复溶,过0.22 μm有机相滤膜后用高效液相色谱仪检测。色谱条件参考NY/T 2741—2015《仁果类水果中类黄酮的测定 液相色谱法》[18]并做适当修改。色谱柱:月旭Ultimate AQ-C18柱,5 μm,4.6 mm×250 mm;柱温为40 ℃;流速为0.8 mL/min;进样量为10 μL;检测波长为280、350 nm;流动相为0.4%磷酸水溶液(A)和100%甲醇(B);梯度洗脱(0~10 min,0~25% B;10~25 min,25%~40% B;25~55 min,40%~60% B;55~60 min,60%~0 B)。
1.4 数据分析
每个样品做3次重复,用Excel、Origin软件进行数据统计分析并作图,采用SPSS软件进行统计检验分析。
2 结果与分析
2.1 微生物转化条件的优化
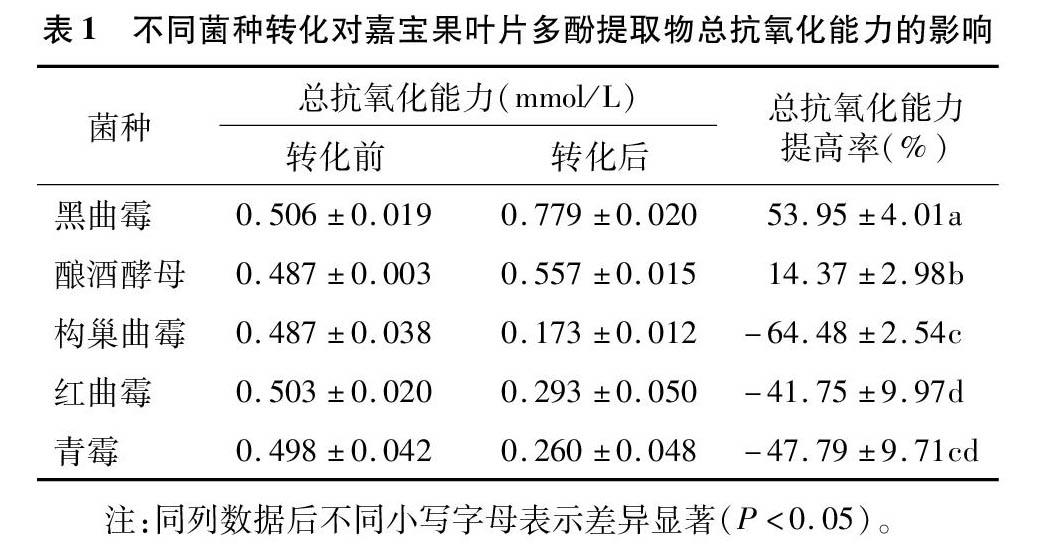
2.1.1 转化菌种的筛选 不同菌种转化对嘉宝果叶片多酚提取物总抗氧化能力的影响见表1。Xiao等利用黑曲霉转化甘草黄酮,发现生成了10种新成分,分别为氢化代谢产物、双羟基化代谢产物、环氧化代谢产物和糖基化代谢产物[19];Jin等研究了14个不同菌株利用糖苷键水解将虎杖苷转化为白藜芦醇的能力,结果表明,酵母菌CICC1912的转化能力最强[20];Savinova等则利用构巢曲霉VKPM F-1069使黄体酮发生羟基化,生成了3种新的化合物[21];丛悦怡等利用红曲霉将人参皂苷转化为生物活性更强的稀有人参皂苷Rg3[22];苏龙等则利用青霉发酵产生的酶将黄岑苷水解得到黄岑素[23]。本研究以上述几种常用于微生物转化且易于获得的菌种为研究对象,比较其转化嘉宝果叶片多酚提取物的能力。由表1可知,经过黑曲霉、酿酒酵母转化后,嘉宝果叶片多酚提取物的总抗氧化能力有所提高,提高率分别为53.95%、14.37%;经过构巢曲霉、红曲霉、青霉转化后,叶片多酚提取物的总抗氧化能力却显著下降,分别下降了64.48%、41.75%、47.79%。由此可见,黑曲霉是嘉宝果叶片多酚提取物转化的最佳菌种。
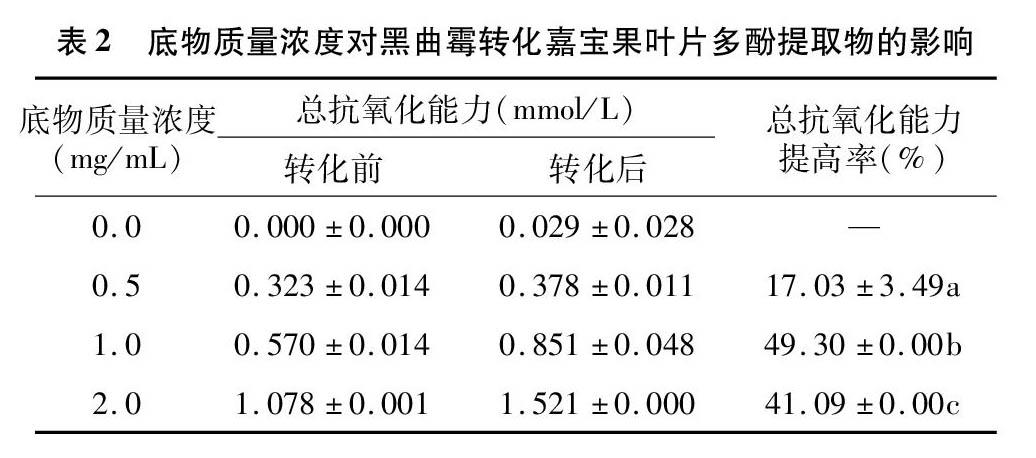
2.1.2 底物浓度的影响 由表2可见,当底物质量浓度由0.5 mg/mL增加到1.0 mg/mL时,嘉宝果叶片多酚提取物的总抗氧化能力显著提高,这是因为适当增加底物浓度可增加底物与酶的结合位点,提高酶促反应速率。而当底物质量浓度由1.0 mg/mL增加至2.0 mg/mL时,嘉宝果叶片多酚提取物的总抗氧化能力却有所下降,这是因为黑曲霉代谢过程中产生的酶量有限,底物质量浓度过高时,酶已经被底物完全饱和,多余的底物无法与酶结合发生酶促反应,使反应速率下降,因此总抗氧化能力有所降低。综上所述,1.0 mg/mL为最佳底物质量浓度,此时总抗氧化能力提高率为49.30%。
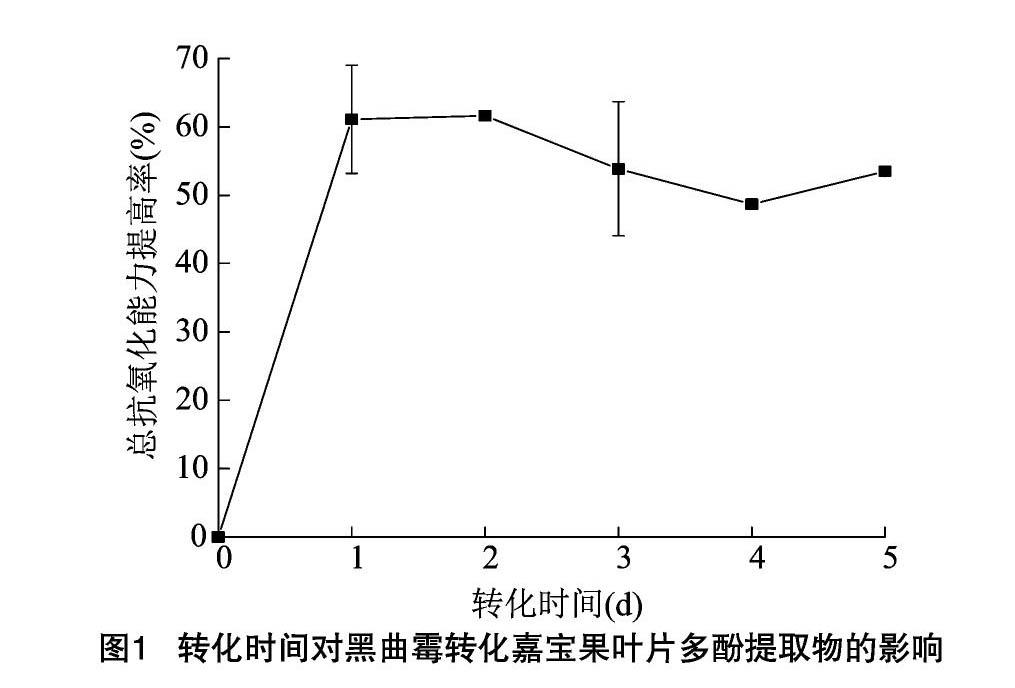
2.1.3 转化时间的筛选 本研究结果表明,转化时间对嘉宝果叶片多酚提取物总抗氧化能力提高率的影响极显著(P<0.01)。由图1可知,随着转化时间的延长,嘉宝果叶片多酚提取物的总抗氧化能力呈现先升高后下降的趋势。本试验在加入底物前,先将黑曲霉培养1 d,其在生长过程中产生了酶,因此加入底物后转化1 d,其总抗氧化能力明显提高。转化时间为2 d时,嘉宝果叶片多酚提取物的总抗氧化能力达到最高,说明此时黑曲霉产生的酶量最大,酶促反应速率最高。继续延长转化时间,总抗氧化能力有所下降,这可能是因为转化时间过长会使多酚发生降解,导致活性降低,而且大部分植物多酚本身不稳定,在贮藏和加工过程中易出现降解的现象[24]。
2.2 转化前后主要成分的变化
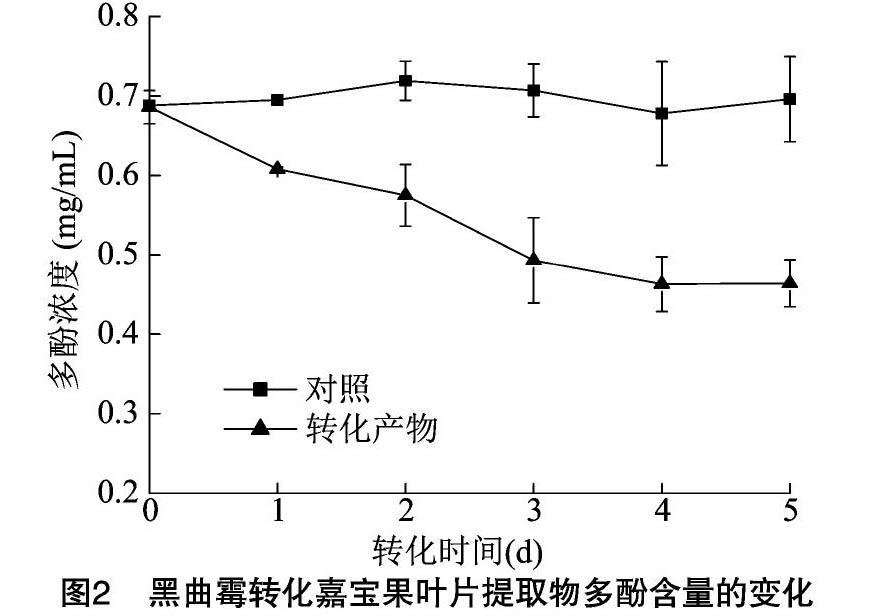
2.2.1 嘉寶果叶片提取物转化过程中多酚含量的变化 由图2可见,黑曲霉转化过程中嘉宝果叶片总多酚含量显著下降(P<0.01),从0.686 mg/mL下降至0.463 mg/mL,而对照的多酚含量变化不明显,表明在转化过程中,酚类物质结构在酶的作用下发生了变化,使多酚含量明显降低。
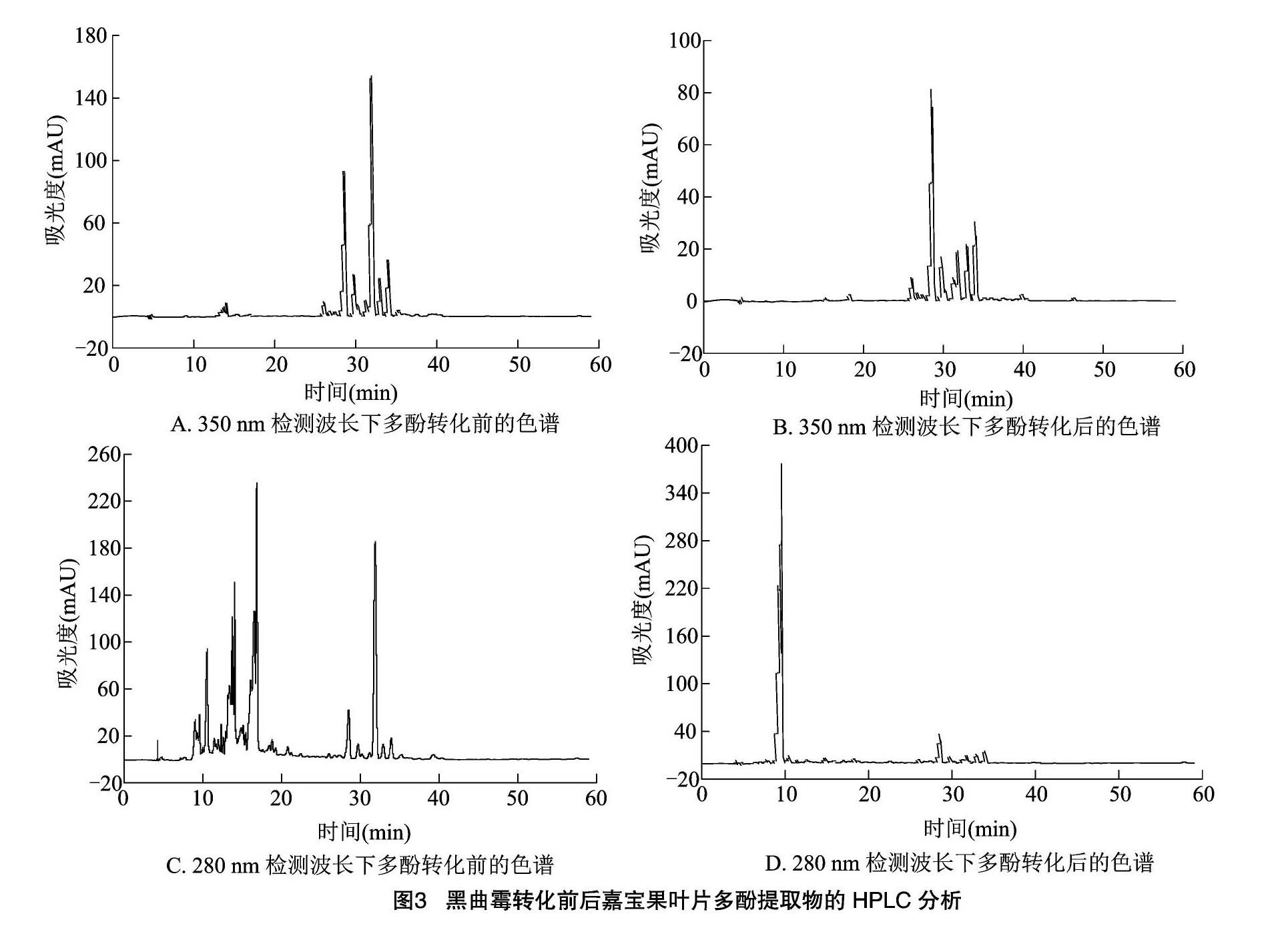
2.2.2 嘉宝果叶片多酚转化前后的HPLC分析 黑曲霉转化嘉宝果叶片多酚提取物2 d后,通过HPLC分析转化前后多酚含量的变化情况(图3)。通过对比谱图中峰的保留时间可知,350 nm下的多酚底物转化后,极性较强的峰相对强度变大,极性较弱的峰相对强度变小;而280 nm下的多酚底物转化后,峰发生了明显变化,弱极性的物质明显减少,新生成的物质均为强极性物质。
3 讨论与结论
本研究对比了几种微生物转化对嘉宝果叶片多酚提取物总抗氧化能力的影响,结果发现,经黑曲霉转化的多酚提取物的总抗氧化能力提高最明显。黑曲霉在生长过程中能代谢产生丰富的酶体系,是产酶的宝库[25],也是世界公认的在食品药品中具有较高安全性的真核生物[26]。黑曲霉的转化机制是利用其产生丰富的酶系,催化底物发生去糖基化、羟基化、甲基化、脱氢化等过程而形成转化产物[27]。黑曲霉代谢过程中产生大量葡萄糖苷酶,因此在转化天然产物的过程中极易发生糖基键水解反应。陈箐筠等利用黑曲霉发酵产β-葡萄糖苷酶、芸香苷-α-鼠李糖苷酶,催化芸香苷二元糖苷键发生水解得到苷元槲皮素[28]。吴秀丽等利用黑曲霉对人参皂苷Re进行微生物转化发现,黑曲霉产生的α-鼠李糖苷水解酶、β-葡萄糖苷酶有催化作用,将人参皂苷Re转化为Rg1、Rg2和Rh1[29]。
嘉宝果叶片多酚提取物的底物质量浓度与转化效果密切相关,当底物质量浓度过低时,无法充分利用微生物代谢产生的酶,质量浓度过高时则会导致酶结合位点缺失,还可能由于多酚的抑菌性[30]抑制了菌株生长,从而使转化效率下降。本研究发现,最佳转化底物质量浓度为1.0 mg/mL。王晓玲研究芍药苷的微生物转化条件发现,转化率随着底物浓度的提高先上升后下降[31],这与本研究结果一致。本研究还分析了转化时间对转化效果的影响,优化得到黑曲霉转化嘉宝果叶片多酚提取物的最佳转化时间为2 d。Knockaert等研究了2种乳杆菌转化阿魏酸的能力,发现植物乳杆菌在对数生长期时开始转化阿魏酸,而丘状乳杆菌则在稳定期才开始转化[32],说明不同菌种转化植物提取物时所处的生长阶段不同,因此选择能确保转化反应充分进行的转化时间至关重要,同时还应考虑酚类物质在反应体系中易发生降解,导致活性降低,转化时间也不宜过长。
嘉宝果叶片多酚提取物经过黑曲霉转化后多酚含量明显下降,且生成了强极性的物质,说明黑曲霉分泌的酶催化产生一系列化学反应,改变了多酚物质的结构,并显著提高了嘉宝果叶片提取物的总抗氧化能力。通过优化底物质量浓度、转化时间,可以使抗氧化能力提高率显著增大,本研究对嘉宝果叶片在食品药品中的应用具有一定的指导意义。
参考文献:
[1]邱珊莲,林宝妹,张少平,等. 嘉宝果果实不同部位营养成分分析[J]. 福建农业科技,2018(1):1-3.
[2]唐 丽,袁婷婷,钟秋平. 嘉宝果营养成分分析[J]. 经济林研究,2014,32(2):120-124.
[3]Zhao D K,Shi Y N,Petrova V,et al. Jaboticabin and related polyphenols from Jaboticaba (Myrciaria cauliflora) with anti-inflammatory activity for chronic obstructive pulmonary disease[J]. Journal of Agricultural and Food Chemistry,2019,67(5):1513-1520.
[4]邱珊莲,林宝妹,洪佳敏,等. 树葡萄植株不同部位醇提物抗氧化及抑制α-葡萄糖苷酶活性的比较研究[J]. 果树学报,2018,35(3):311-318.
[5]Duarte A R,Santos S C,Seraphin J C,et al. Environmental influence on phenols and essential oils of Myrciaria cauliflora leaves[J]. Journal of the Brazilian Chemical Society,2010,21(9):1672-1680.
[6]吴建华,吴志瑰,裴建国,等. 多酚类化合物的研究进展[J]. 中国现代中药,2015,17(6):630-636.
[7]陈金祥. 酚酸抗氧化活性的构效关系及抗氧化机制的研究[D]. 太原:中北大学,2020:41.
[8]李 艳,周 剑,何东贤,等. 微生物转化在现代中药研发中的应用[J]. 中国抗生素杂志,2020,45(5):418-422.
[9]王珊珊,胡 萍,余少文. 天然产物微生物转化的研究进展[J]. 中国新药杂志,2016,25(1):71-75.
[10]Dupas C,Baglieri A M,Ordonaud C,et al. Chlorogenic acid is poorly absorbed,independently of the food matrix:a Caco-2 cells and rat chronic absorption study[J]. Molecular Nutrition & Food Research,2010,50(11):1053-1060.
[11]薛海洁,王 颖,李 春. 植物天然产物的微生物合成与转化[J]. 化工学报,2019,70(10):215-225.
[12]胡丽云. 荔枝果肉多酚在贮藏褐变和微生物转化过程中的变化规律研究[D]. 南昌:江西农业大学,2016:45.
[13]李东晓. 甜茶和八角金盘天然产物分析及微生物转化研究[D]. 南京:南京师范大学,2015:60-61.
[14]Zhang H C,Yu H N. Enhanced biotransformation of soybean isoflavone from glycosides to aglycones using solid-state fermentation of soybean with effective microorganisms (EM) strains[J]. Journal of Food Biochemistry,2019,43(4):12804-12814.
[15]Joyeau R,Planchon M,Abessolo J,et al. Combinatorial approach to the selection of active microorganisms in biotransformation:Application to sinomenine[J]. Journal of Molecular Catalysis B Enzymatic,2013,85/86:65-70.
[16]林宝妹,邱珊莲,郑开斌,等. 嘉宝果叶片总多酚提取工艺优化及其体外降糖活性[J]. 福建农业学报,2019,34(5):587-594.
[17]Tohidi B,Rahimmalek M,Arzani A. Essential oil composition,total phenolic,flavonoid contents,and antioxidant activity of Thymus species collected from different regions of Iran[J]. Food Chemistry,2017,220:153-161.
[18]仁果类水果中类黄酮的测定 液相色谱法:NY/T 2741—2015[S]. 北京:中国标准出版社,2015.
[19]Xiao Y,Han F B,Lee I S. Microbial transformation of licochalcones[J]. Molecules,2020,25(1):60-73.
[20]Jin S,Luo M,Wang W,et al. Biotransformation of polydatin to resveratrol in Polygonum cuspidatum roots by highly immobilized edible Aspergillus niger and yeast[J]. Bioresource Technology,2013,136:766-770.
[21]Savinova O S,Solyyev P N,Vasina D V,et al. Biotransformation of progesterone by Aspergillus nidulans VKPM F-1069 (wild type)[J]. Steroids,2019,149:108421-108429.
[22]丛悦怡,孙 佳,于 恩,等. 红曲霉发酵转化人参皂苷Rg3的研究[J]. 中草药,2018,49(6):1298-1303.
[23]苏 龙,梁广波,龙文英,等. 黄芩苷微生物转化菌的筛选鉴定及发酵条件优化[J]. 湖北农业科学,2017,56(8):1483-1488.
[24]林国荣,杨丽洪. 加工条件对葡萄多酚稳定性影响的研究[J]. 食品科技,2019,44(11):267-272.
[25]姚善泾,蔡礼年,林东强. 黑曲霉作为分泌蛋白细胞工厂的研究进展[J]. 化工学报,2019,70(10):3690-3703.
[26]Schuster E,Dunn-Coleman N,Frisvad J,et al. On the safety of Aspergillus niger—A review[J]. Applied Microbiology & Biotechnology,2002,59(4):426-435.
[27]王智磊,刘素娟,张 鑫,等. 黑曲霉生物转化黄酮类成分研究进展[J]. 中国实验方剂学杂志,2017,23(21):220-228.
[28]陈箐筠,张迎庆,干 信,等. 黑曲霉As3.4309发酵转化芦丁的研究[J]. 生物技术,2009,19(2):88-91.
[29]吴秀丽,刘 成,陈 靖. 黑曲霉Aspergillus niger对人参皂苷Re的微生物转化[J]. 中国当代医药,2011,18(33):7-9.
[30]張兆英,王 君,宋立立,等. 金丝小枣多酚的提取及抗氧化性和抑菌活性研究[J]. 中国调味品,2020,45(3):42-47.
[31]王晓玲. 芍药苷的微生物转化研究[J]. 西南民族大学学报,2011,37(3):425-430.
[32]Knockaert D,Raes K,Wille C,et al. Metabolism of ferulic acid during growth of Lactobacillus plantarum and Lactobacillus collinoides[J]. Journal of the Science of Food & Agriculture,2012,92(11):2291-2296.
