基于MIRA技术的霍乱弧菌胶体金试纸条快速检测方法的建立
2021-01-07李盛杰江海涛吴雨龙
李盛杰 江海涛 吴雨龙







摘要:为了建立一种快速、灵敏、便捷的针对霍乱弧菌的检测方法,利用多酶恒温核酸快速扩增技术,对不同引物组在胶体金试纸条检测中的特异性和灵敏度进行研究。研究结果表明,在以质粒为模板的特异性试验中,Probe1+引物对2、Probe1+引物对3、Probe2+引物对5这3组引物组均显示出较高的特异性。但在灵敏度试验中,仅有Probe2+引物对5能够检出浓度为0.1 fg/μL的质粒模板。在后续以核酸为模板的特异性和灵敏度试验中,Probe2+引物对5的引物组合同样显示出较强的特异性,并对核酸模板的检出限可达到10 fg/μL,均显示出优于另外2种组合的特异性和灵敏度。本研究所建立的基于MIRA技术的霍乱弧菌检测方法具有较高的特异性和灵敏度,对于推进霍乱弧菌及其他致病菌的现场快速检测具有重要意义。
关键词:霍乱弧菌;多酶恒温核酸快速扩增技术;胶体金试纸
中图分类号:S182 文献标志码: A
文章编号:1002-1302(2021)24-0167-05
收稿日期:2021-09-27
基金项目:国家重点研发计划(编号:2019YFC1605800);江苏省高校自然科学研究重大项目(编号:20KJA416003);江苏省高校重点建设实验室项目(编号:苏教科[2016]8)。
作者简介:李盛杰(1988—),男,江苏徐州人,博士,讲师,从事特殊生物质资源利用研究。E-mail:lishengjie@njxzc.edu.cn。
通信作者:吴雨龙,博士,高级实验师,从事动物生理生化相关研究。E-mail:wuyl_8080@163.com。
霍乱弧菌(Vibrio cholera)是一种革兰氏阴性菌,是霍乱的病原体。霍乱可作为散发性、流行性或地方病发生,以引起严重腹泻和脱水而闻名,如果不及时治疗,可在48 h内导致死亡[1]。研究表明,霍乱弧菌可以通过人类宿主形成高度传染性状态,经排泄到自然环境中,引发霍乱的流行[2]。霍乱弧菌广泛存在水生动物中或受污染的食物中,特别是贝类和甲壳類动物[3]。因此,建立霍乱弧菌快速、高效的检测手段,对于保障食品质量安全,维护人民生命健康,加强公共卫生防疫方面具有极其重要的意义。由于霍乱弧菌可以以2种形式存在:活的可培养的和活的但不可培养的(VBNC),使用传统培养法进行检测具有一定的局限性[4]。目前,针对霍乱弧菌检测的方法虽然很多,包括免疫检测法、生化鉴定法、实时荧光聚合酶链式反应、环介导恒温扩增(LAMP)等方法,但这些方法均无法同时解决操作烦琐耗时长、检测效率与检测灵敏度低、检测目标单一、快速现场检测等问题[5-10]。
MIRA(Multi-enzyme Isothermal Rapid Amplification,简称MIRA)是一种近年来发展起来的多酶恒温核酸快速扩增技术。作为一种新型的等温核酸扩增技术,MIRA不需要复杂的热循环仪,而是通过简单的水浴或加热工具即可在37~42 ℃的恒定温度条件下进行反应。整个反应过程主要依赖于3种必需的酶:重组酶,促进特异性引物与模板DNA 配对;单链 DNA 结合蛋白,无需加热即可形成单链DNA;DNA 聚合酶,负责扩增和延伸[11]。一旦反应开始,模板DNA的扩增就会迅速进行,并且在不到 20 min的时间内达到可检测的水平。通过设计带有修饰基团的引物与探针,配合胶体金试纸条,可以极大地实现便携式的现场快速核酸检测技术。
霍乱毒素(CT)、毒素共调节菌毛(TCP)和外膜蛋白W(OmpW)是霍乱弧菌的3个主要毒力因子[12]。外膜蛋白W的ompW基因也是霍乱弧菌菌株鉴定中常用的特异性检测基因。本研究主要针对该基因设计多个引物和探针组,并在多酶恒温核酸快速扩增体系中通过胶体金试纸条对霍乱弧菌的特异性和灵敏度检测进行评价。
1 材料与方法
1.1 材料与试剂
霍乱弧菌ompW基因质粒(参考GenBank:MF100045.1序列信息构建);Tiosbio超快速核酸释放剂、DNA恒温快速扩增试剂盒、HybriDetect试纸条均购自潍坊安普未来生物科技有限公司;霍乱弧菌、小肠耶尔森氏菌的核酸提取物购自潍坊安普未来生物科技有限公司;副溶血性弧菌、拟态弧菌、河弧菌分离株、创伤弧菌、鲍氏志贺菌、鼠伤寒沙门氏菌、大肠杆菌、金黄色葡萄球菌、坂崎克罗诺菌均来自笔者所在实验室保藏。
1.2 仪器
PCR扩增仪,T100TM,Bio-rad生命医学产品有限公司生产。
1.3 试验方法
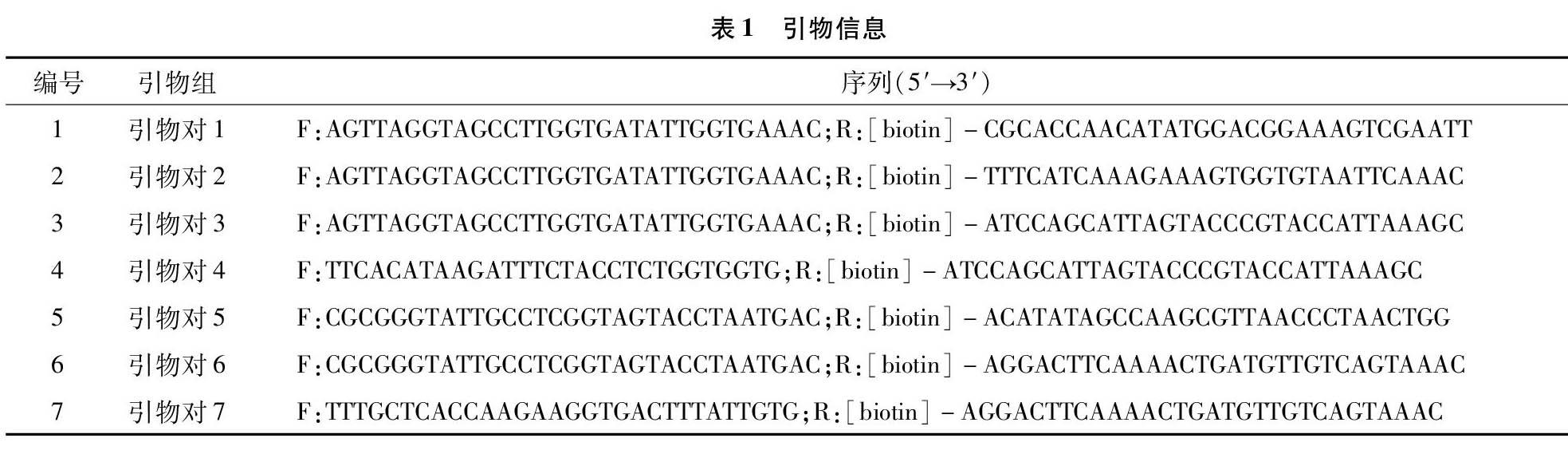
1.3.1 引物设计 试验于2021年3—6月在南京晓庄学院实验室内进行。根据MIRA技术引物设计原则,建议扩增片段长度在150~500 bp之间,下游引物的5′端需要标记1个修饰基团(如生物素,biotin)。结合霍乱弧菌ompW基因(GenBank:MF100045.1)序列信息,采用PrimerPremier 5.0软件进行引物设计,委托广州擎科生物技术有限公司进行合成,具体序列见表1。
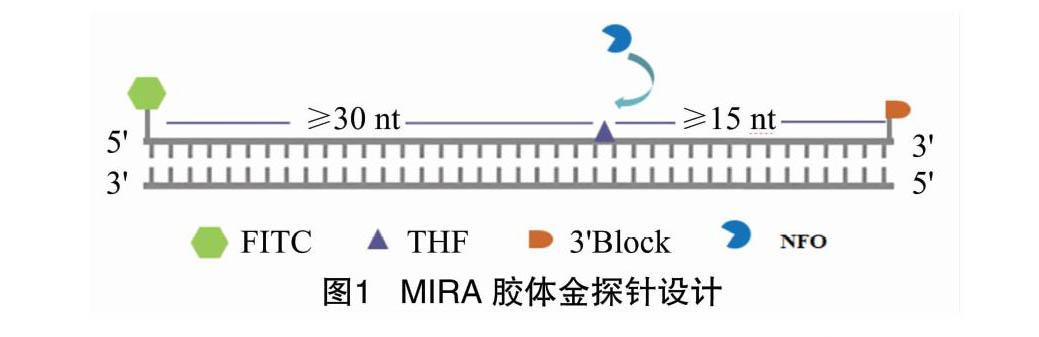
1.3.2 探针设计 根据MIRA技术探针设计原则(图1),探针为位于上下游引物中间,长度在46~52 nt之间,并与目的片段互补的序列;同时在5′端修饰1个抗原标记(如羟基荧光素,FAM);在距5′端约30 nt序列位置上标记1个dSpacer(四氢呋喃,THF),作为大肠杆菌核酸外切酶(NFO)的识别位点;THF距离3′末端约15 nt,并且在3′末端标记1个修饰基团(如胺基、磷酸基团、C3-spacer)。结合7对引物信息,设计得到符合引物对1、2、3、4的探针Probe1([6FAM]AACATTTGCCACCTACCTTTATGGTCCAAT[THF]CTACTTTGGTGAAGC[C3spacer])和符合引物对4、5、6的探针Probe2([6FAM]AGTAGCGATAAAGTGTTAAACACTCAAAGT[THF]AGTTGGCAGTTAATA[C3spacer])。
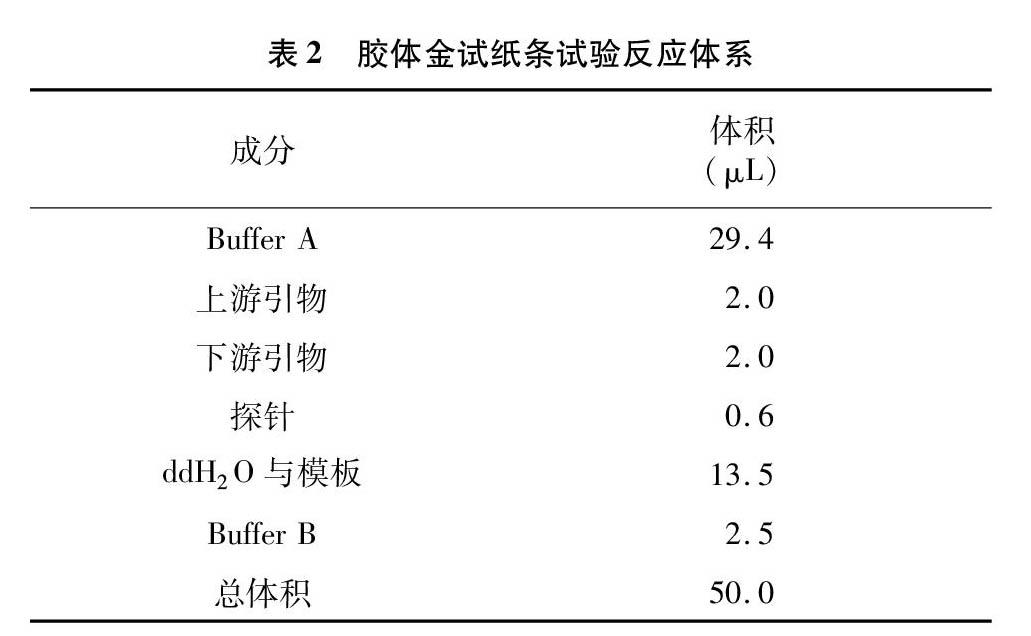
1.3.3 膠体金试纸条试验反应体系 胶体金试纸条试验反应体系见表2。
1.3.4 胶体金试纸条试验操作步骤 在每个反应管中加入适量的Buffer A、上下游引物、探针(探针引物浓度均为10 μmol/L)、ddH2O、核酸模板、BufferB,并充分混合,短暂离心后立即将反应管放入恒温设备中37 ℃孵育8~12 min;反应结束后,取10 μL反应液加入含有190 μL ddH2O的离心管中,混合均匀后将胶体金试纸条的样品端插入离心管中3~5 min,观察质控线与检测线判读结果。
2 结果与分析
2.1 质粒模板试纸条特异性
选择7组引物和对应的探针,将霍乱弧菌ompW基因质粒作为模板,进行胶体金试纸条特异性反应的初筛。胶体金试纸条初筛结果显示,每组检测线均出现了条带,说明不同的引物探针组均能检出质粒浓度10 fg/μL以上的目标分子,其中2、3、5组条带最为明显(图2)。因此,选择这3对引物及对应探针进行后续胶体金试纸条的灵敏度试验。
2.2 质粒模板试纸条灵敏度
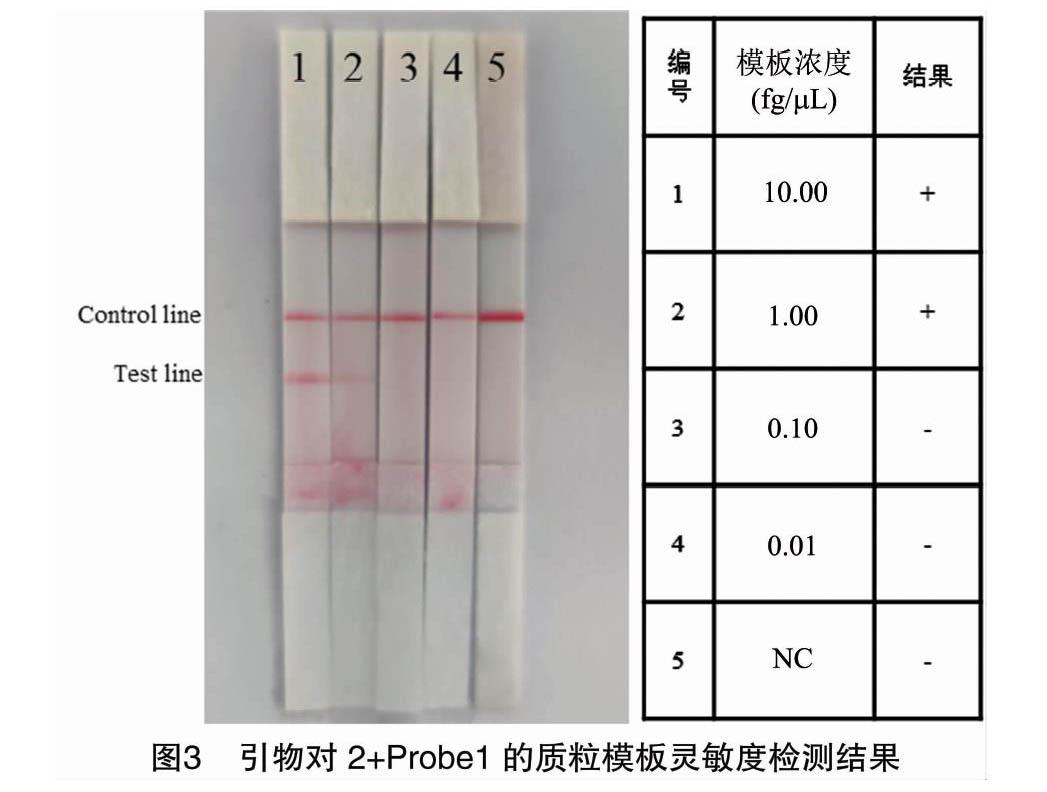
选择引物对2和探针Probe1的组合,将质粒模板稀释为10.00、1.00、0.10、0.01 fg/μL 4个梯度浓度进行胶体金试纸条的灵敏度检测。检测结果显示,第2组检测线有微弱条带出现,表明该探针引物组合可以检出浓度为1 fg/μL的质粒模板(图3)。
选择引物对3和探针Probe1的组合,将质粒模板稀释为相同的4个梯度浓度进行胶体金试纸条的灵敏度检测。检测结果显示,该探针引物组合在第2组检测线同样可以看到微弱条带,也可检出浓度为1 fg/μL的质粒模板(图4)。
选择引物对5和探针Probe2的组合,利用同样稀释后的质粒模板进行胶体金试纸条的灵敏度检测。检测结果显示,该探针引物组合在第3组检测线可以看到微弱条带,表明其可以检出浓度为 0.1 fg/μL 的质粒模板(图5)。
2.3 核酸模板试纸条灵敏度
为进一步验证该方法在真实检测环境中的效率,选择从霍乱弧菌中提取的核酸作为模板进行灵敏度检测试验。选择引物对2和探针Probe1的组合,设置1 pg/μL、100 fg/μL、10 fg/μL 3个梯度核酸模板浓度进行胶体金试纸条的灵敏度检测。检测结果显示,第1、2组检测线有明显条带出现,表明该探针引物组合可以检出浓度为100 fg/μL的核酸模板(图6)。
选择引物对3和探针Probe1的组合,将核酸模板稀释为相同的3个梯度浓度进行胶体金试纸条的灵敏度检测。检测结果显示,该探针引物组合在第1组、第2组检测线有明显条带出现,在第3组检测线可以看到微弱条带,表明可以检出浓度为 10 fg/μL 的核酸模板(图7)。
选择引物对5和探针Probe2的组合,利用同样稀释后的核酸模板进行胶体金试纸条的灵敏度检测。检测结果显示,该探针引物组合在第1组、第2组、第3组检测线均可以看到明显条带,表明其可以检出浓度为10 fg/μL的核酸模板(图8)。
根据以上试验结果,无论是在ompW基因质粒模板的灵敏度检测试验中还是在霍乱弧菌核酸模板的灵敏度检测试验中,引物对5+Probe2的组合均表现出最优的灵敏度检测结果。因此,选择该探针引物组合进行不同物种间的特异性检测试验。
2.4 不同致病菌核酸模板试纸条特异性试验结果
在不同致病菌核酸模板的特异性检测试验中,本研究选择了4种其他弧菌(副溶血性弧菌、拟态弧菌、河弧菌、创伤弧菌)和6种可致消化系统疾病的常见细菌(鲍氏志贺菌、鼠伤寒沙门氏菌、小肠耶尔森氏菌、大肠杆菌、金黄色葡萄球菌、坂崎克罗诺菌)进行检测。结果表明,引物对5+Probe2的组合对于其他致病菌核酸模板的检出结果均为阴性,只有对霍乱弧菌核酸的检出结果为阳性,说明该探针引物组合可以特异性地检出霍乱弧菌而不检出其他微生物(图9)。
3 讨论与结论
通过对全部7对引物探针组进行初筛,显示引物对2+Probe1、引物对3+Probe1和引物对5+Probe2的组合在试纸条检测线均出现显著明亮的条带。在后续通过质粒模板和核酸模板进行灵敏度检测的过程中,引物对5+Probe2的组合均表现出最优的灵敏度,检出限分别可达到0.1 fg/μL和 10 fg/μL。在不同致病菌核酸模板的特异性检测试验中,引物对5+Probe2的组合同样表现出良好的特异性,在所有11种检测对象中,仅能检测出霍乱弧菌而不检出其他微生物。综上判断,我们认为引物对5+Probe2的探针引物组通过胶体金试纸条在多酶恒温核酸快速扩增条件下,能够特异性好和灵敏度高地完成霍乱弧菌的快速检测。本试验所建立的检测方法,无需依赖细菌培养、生化鉴定、血清学分群等周期长、操作繁琐的手段,比常规PCR和实时荧光PCR技术有更短的反应时间,比环介导恒温扩增方法具有更低的反应温度,适用于食品安全检测、病原体临床诊断等领域,应用前景广阔,具有较高的实用价值。
本研究建立了一种基于MIRA技术的霍乱弧菌胶体金试纸条快速检测方法,试验结果表明,引物对5+Probe2的探针引物组具备准确可靠、特异性强、灵敏度高等优点。该探针引物组可以通过后期开发成便携且操作简单便利的一体化检测试剂盒,用于实际生产和监测环节中对霍乱弧菌的现场快速检测。
参考文献:
[1]Qadri F,Khan A I,Faruque A S G,et al. Enterotoxigenic Escherichia coli and Vibrio cholerae diarrhea,Bangladesh,2004[J]. Emerging Infectious Diseases,2005,11(7):1104-1107.
[2]Peterson K M,Gellings P S.Multiple intraintestinal signals coordinate the regulation of Vibrio cholerae virulence determinants[J]. Pathogens and Disease,2018,76(1):126-147.
[3]Bhandari M,Jennison A V,Rathnayake I U,et al. Evolution,distribution and genetics of atypical Vibrio cholerae-A review[J]. Infection,Genetics and Evolution,2021,89:104726.
[4]Conner J G,Teschler J K,Jones C J,et al. Staying alive:Vibrio cholerae’s cycle of environmental survival,transmission,and dissemination[J]. Microbiology Spectrum,2016,4(2):1-32.
[5]韓 辉,毕玉国,祁 军,等. 霍乱弧菌和拟态弧菌双重荧光PCR检测方法的建立[J]. 中国国境卫生检疫杂志,2015,38(3):153-156.
[6]郭 容,董晓妹,别闯南,等. 五种重要致病性弧菌高通量液相芯片检测方法的建立[J]. 中国兽医科学,2021,51(7):805-813.
[7]周霞霞,邱晶磊,杨 广,等. 传统培养法与荧光PCR法检测弧菌的方法评价[J]. 食品安全质量检测学报,2021,12(4):1550-1556.
[8]万 莹,陈永军,任亚玲,等. 霍乱弧菌三重荧光定量PCR检测方法的建立与应用[J]. 中国兽医科学,2019,49(9):1143-1151.
[9]母润红,聂丹丹,李明成,等. 水产品中食源性病原菌多重PCR快速检测方法的建立[J]. 北华大学学报(自然科学版),2020,21(6):756-760.
[10]魏 霜,马新华,汪天杰,等. 双重DPO-PCR检测副溶血弧菌和霍乱弧菌[J]. 食品工业科技,2016,37(22):80-83.
[11]Tu F,Yang X T,Xu S K,et al. Development of a fluorescent probe-based real-time reverse transcription recombinase-aided amplification assay for the rapid detection of classical swine fever virus[J]. Transboundary and Emerging Diseases,2021,68(4):2017-2027.
[12]Taheri F,Nazarian S,Ahmadi T S,et al. Protective effects of egg yolk immunoglobulins (IgYs) developed against recombinant immunogens CtxB,OmpW and TcpA on infant mice infected with Vibrio cholerae[J]. International Immunopharmacology,2020,89:107054.
