铜离子对花鳅急性毒性研究
2021-01-06赵云龙李琳琪乔淑芬张东鸣张宇柔
赵云龙,李琳琪,乔淑芬,张东鸣,张宇柔
(1.通化师范学院,吉林 通化 134000;2.吉林农业大学,吉林 长春 130118)
花鳅Cobitis taenia 属鲤形目鳅科,为一种多年生小型淡水冷水鱼。花鳅味道鲜美、肉质紧致细腻,脂肪含量高,香味突出,营养和药用价值很高,具有较高的经济价值和开发潜力。花鳅主要生活在砂石底、清澈的流水环境中,对水质条件要求高。
铜作为生物必需微量元素之一,参与鱼类体内多种物质代谢,对造血、生长、繁殖等具有重要作用,适量的铜离子有利于水产动物内环境稳定[1]。过量铜离子会导致水产动物机体结构和生理功能异常,发生各种病变和疾病;鱼类的抗氧化系统也会受到伤害,并具有一定的遗传毒性[2,3]。
铜离子是河流中常见的重金属之一,鱼类通过呼吸和取食等活动摄入体内。铜离子对鱼类的急性毒性研究很多,而冷水条件下,铜离子对花鳅的急性毒性却尚未见报道。本研究采用静水生物测试法研究了铜离子对花鳅的急性毒性,评价了铜离子对花鳅的安全性,可为花鳅生态毒理学指标提供基础数据,有利于花鳅养殖业的发展。
1 材料与方法
1.1 材料
实验用水为全自动逆渗透纯水机处理的纯净水,pH6.8~7.2,水温(15±1)℃。实验用鱼为野生花鳅,2018 年5 月中旬采自通化市向阳村(E 126.033449°,N 41.691667°)河流中,使用0.1%高锰酸钾溶液消毒后,于通化师范学院冷水鱼养殖实验室暂养池中暂养7 d。随机选取540 尾健康、无伤病,体长(90±20)mm,体质量(4.1±0.6)g 个体,随机分为6 组,每组3 个重复,每个重复30 尾。实验容器为75 cm×60 cm×50 cm 的聚乙烯塑料水族箱,每箱盛放药液容量180 L。
1.2 方法
中毒症状观察及LC50测定:采用静水法生物测试[4,5],根据预实验结果运用等对数间距法设置5 个浓度组:0.10 mg/L、0.17 mg/L、0.30 mg/L、0.51 mg/L和0.90 mg/L,对照组0 mg/L,重复3 次,实验所用硫酸铜(CuSO4·5H2O)为分析纯(天津市致远化学试剂有限公司)。实验期间不投喂,不充气。实验中每8 h 观察观察花鳅的行为、中毒症状、死亡等情况,记录24 h、48 h、72 h 和96 h 的存活情况,采用线性回归法求出LC50,安全浓度=96hLC50×0.1。
铜离子含量测定:实验24 h 时,分别从各组中随机取3 尾花鳅,经MS-222 麻醉后,用超纯水将体表冲洗干净,解剖取其鳃和肝脏,用超纯水清洗,再用滤纸吸干,样品在105℃烘箱中干燥24 h 至恒重待用[6]。铜离子含量参照《食品中铜的测定》方法[7],使用石墨炉原子光谱吸收仪(4510F,上海仪电)检测。
酶活性测定:实验24 h 时,各浓度组和对照组分别随机取3 尾花鳅,快速解剖取出脑、肝脏,称取适量的样品,按质量∶体积=1∶10 加入4℃预冷的生理盐水,在冰浴下,用JY92-Ⅱ超声波细胞破碎仪进行匀浆。匀浆液在4℃下4 000 r/min 冷冻离心10 min,取上清液备用。采用考马斯亮蓝G-250 法测定蛋白质含量,POD(过氧化物酶,U/mgprot)、GDH(谷氨酸脱氢酶,U/mgprot) 活性和Glu (谷氨酸,μmol/gprot)浓度测定采用南京建成生物工程研究所试剂盒,按说明书测定。
1.3 数据处理
数据以(平均值±标准误)表示,用SPSS 19.0软件进行单因素方差分析(ANOVA)和Duncan 多重比较,显著水平为P<0.05。
2 结果与分析
2.1 花鳅在铜离子下的症状变化及LC50 测定
花鳅在不同浓度铜离子溶液中反应不同:低浓度出现中毒的症状比高浓度晚。刚投入含铜离子的水中,低浓度组的花鳅与对照组无明显差别;3 h时,高浓度组(0.51 mg/L、0.90 mg/L)的花鳅局促不安、急剧游动,有时在水中侧翻、打转;9 h 时,高浓度组(0.51 mg/L、0.90 mg/L)的花鳅游动速度减慢,反应迟缓,逐渐失去运动能力,躺卧在水族箱底部,出现死亡。中毒初期,花鳅体色稍变浅,体表黏液较少,随着中毒时间延长,体表分泌黏液逐渐增多。72 h 时,最高浓度组(0.90 mg/L)花鳅全部中毒死亡,胸鳍充血,口张开,身体侧翻,鳍条均下垂。低浓度组(0.17 mg/L、0.30 mg/L)花鳅在胁迫24 h 时出现中毒症状,一旦中毒,症状基本相同。最高浓度组(0.90 mg/L)胁迫3 h 后,出现轻微的中毒症状,9 h 出现死亡,24 h 死亡率达(81.67±2.05)%(表1)。24 h 内0.51 mg/L 组接近半数死亡,其他低浓度组(0.10 mg/L、0.17 mg/L、0.30 mg/L)未出现死亡。随着铜离子浓度的递增,其毒性逐渐加大,花鳅死亡率上升;铜离子对花鳅的24 h、48 h、72 h 和96 h LC50分别为0.6040 mg/L、0.5148 mg/L、0.3812 mg/L 和0.298 mg/L,安全质量浓度为0.02398 mg/L(表2)。
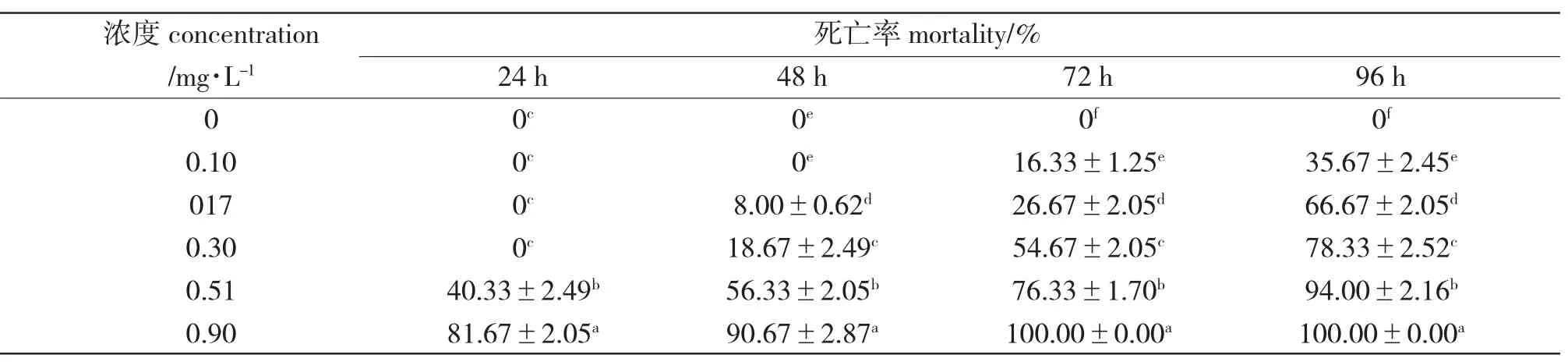
表1 花鳅在不同铜离子浓度的死亡率Tab.1 Mortality of spined loach C.taenia exposed to different Cu2+concentrations
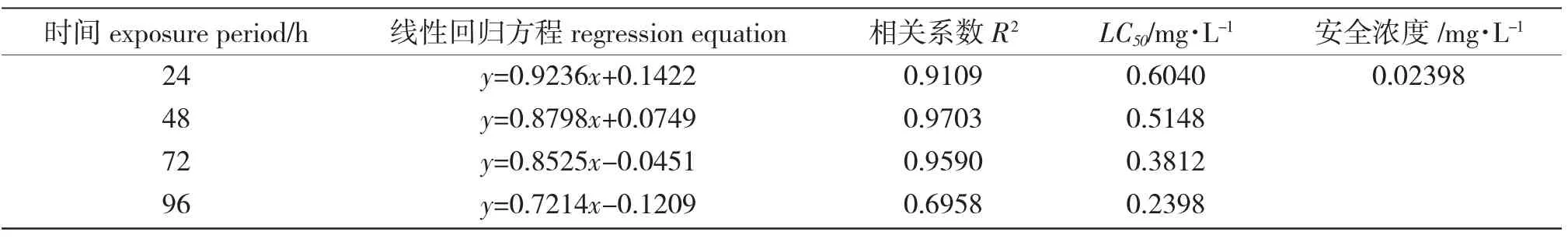
表2 铜离子对花鳅的急性毒性的线性回归方程、LC50 及安全浓度Tab.2 The linear regression equation,LC50 and safe concentration of Cu2+to pined loach
2.2 花鳅肝脏及鳃中铜离子含量变化
随着水中铜离子浓度的增加,肝脏和鳃中铜离子的浓度也增加,且肝脏中的铜离子浓度小于鳃中的铜离子浓度(图1);24 h 时肝脏中高浓度组(0.17 mg/L、0.30 mg/L、0.51 mg/L 和0.90 mg/L)与对照组差异显著(P<0.05),而鳃中0.30 mg/L、0.51 mg/L 和0.90 mg/L 组与对照组差异显著(P<0.05)。
2.3 花鳅在不同浓度的铜离子溶液中24h 时POD、GDH 活性和Glu 浓度变化
由图2 可知:铜离子胁迫24 h 时,花鳅肝脏中POD 和GDH 活性随铜离子浓度的增大而上升,不同浓度组间存在显著差异,且最高浓度组(0.9 mg/L)的活性最大。花鳅脑中Glu 浓度随水体中铜离子浓度增加呈相同趋势(图3),不同浓度组间亦存在显著差异,最高浓度组(0.9 mg/L)的浓度最大。
3 讨论
3.1 铜离子对花鳅毒性
花鳅Cu2+中毒症状为局促不安、急剧游动,水中侧翻、打转,游动速度减慢,反应迟缓,失去运动能力,躺卧在水族箱底部;花鳅中毒初期,肉眼可见体色稍变浅,体表黏液较少,但随着中毒时间延长,分泌黏液逐渐增多,与中华鲟Acipenser sinensis 幼鱼[8]、中国花鲈Lateolabrax maculatus 幼鱼[9]、中华倒刺鲃Spinibarbus sinensis 幼鱼[10]、细鳞鲑Brachymystax lenok 幼鱼[11]、泥鳅Misgurnus anguillicaudatus[12]、金 鱼Carassius auratus[13]、黄河鲤Cyprinus carpio[14]和锦鲤Cyprinus carpio[15]的急性毒性实验的表现症状基本一致。铜离子浓度影响了花鳅体表黏液蛋白组分及含量,而黏液细胞在一定限度内对外界的铜离子胁迫具有保护性反应作用,但当超过其最大限度时,黏液细胞将遭到破坏,失去其生物活性功能。
3.2 铜离子对花鳅的致死效应及安全浓度评价
根据危险化学品鱼类急性毒性分级实验方法(GBT 21281-2007)[16],铜胁迫96 h,花鳅的安全浓度为0.02398 mg/L,毒性分级为急性Ⅰ,铜对花鳅是剧毒物质,花鳅对水体铜污染敏感。已有研究表明:铜离子毒性受到水环境的理化因素、被检测水生生物的种类、规格、生长等多种因素影响,如天然水体中有机质、悬浮物、钙离子和镁离子等多种物质都能降低硫酸铜的毒性,提高铜离子的安全浓度。本实验中,铜离子对花鳅的半致死浓度和安全浓度是在铜离子单独作用下的结果,对养殖具有一定参考价值,但在养殖生产过程中仍需根据实际情况进行具体分析和处理。
3.3 铜离子对花鳅鳃、肝脏、POD、GDH 和Glu 的影响
鳃是花鳅气体交换的主要场所,由磷脂组成的鳃膜能直接吸附游离铜离子[17]。肝是鱼类是富集和解毒重金属的主要场所[18],故本实验选取鳃和肝脏检测铜离子含量,发现花鳅鳃和肝脏铜离子浓度与水中铜离子浓度直接相关。铜离子胁迫会降低肝脏中酶的活性、增加脂质过氧化作用,引起脂肪肝[19];损伤神经系统,造成脑机能障碍,尤其是小脑机能的障碍,使中毒鱼失去平衡[20],故本实验选取肝脏中POD、GDH 活性和脑中Glu 浓度进行研究。
POD 是一种氧化还原酶,具有使毒性物质失活、调节氧浓度的作用,可分解细胞内的脂质过氧化物,减少细胞内过氧化物的积累,有助于缓解重金属离子胁迫的伤害[13,21]。当花鳅受铜离子胁迫时,产生大量的自由基,攻击细胞膜,使细胞膜发生脂质过氧化,导致细胞损伤,肝脏中的POD 活性上升,以期修复铜离子对花鳅肝脏组织的损伤。
谷氨酸脱氢酶(GDH)在肝细胞中含量最为丰富,是肝线粒体特异性酶,还与转氨酶联合参与完成肝脏氨基酸分解代谢,可作为肝脏损伤程度及急性肝坏死的判断指标[22],即肝脏重度损伤时肝细胞中的线粒体酶,如GDH 会被释放出来。肝脏中的GDH 活性呈上升趋势,表明铜离子对花鳅肝脏组织的损伤越来越严重。
Glu 作为兴奋性神经递质,分泌过多会导致神经元损伤。花鳅脑中的Glu 浓度上升,Glu 的摄取及转运会发生障碍,引起Glu 堆积,而突触间隙中的Glu 的大量堆积会导致神经元的毒性作用,最终导致中枢神经系统神经元的凋亡或坏死,造成脑损伤。
