克氏原螯虾肠道产植酸酶菌的筛选、鉴定、酶学性质及固态发酵研究
2021-01-06张紫娟郑苗欣邓威饶俊辉赵青凌洁玉
张紫娟,郑苗欣,邓威,饶俊辉,赵青,凌洁玉
(武汉设计工程学院食品与生物科技学院,湖北 武汉 430205)
植酸是多种植物组织中磷的主要储存形式,不能被单胃动物消化。饲料中没有被充分利用的磷,排泄进入环境会导致水体富营养化[1]。植酸还可以螯合金属离子,降低矿物元素在动物肠道中的利用率[2],影响胃肠道消化酶的活性和蛋白质的利用率[3]。向饲料中添加植酸酶可以有效解决上述问题,目前由真菌所产酸性植酸酶已较好地应用于陆生动物中,但细菌所产中性植酸酶在水产养殖中并未广泛应用[3,4]。这些产植酸酶细菌一般分离自土壤而并非动物,不同水产动物的胃肠道具有差异性[3]。
克氏原螯虾Procambarus clarkii(俗称小龙虾)是重要的淡水特色水产品,经济价值较高。本研究从小龙虾肠道中分离产植酸酶菌株,筛选出了产酶兼抑菌特性的潜在益生菌,通过固态发酵制成同时含有植酸酶和菌体活细胞的产品,促进开发小龙虾新型饲料添加剂以及植酸酶在水产中的运用。
1 材料与方法
1.1 材料
主要原料及试剂:小龙虾购于某农贸市场;麸皮购于淘宝绿牧生态养殖店;植酸钙、植酸钠、钼酸铵、偏钒酸铵、无水乙酸钠等化学试剂均购于国药集团化学试剂有限公司;胰蛋白胨、酵母膏等培养基成分购于北京奥博星生物技术有限公司;细菌基因组DNA 提取试剂盒购于天根生化科技有限公司。
(1)产酶固体筛选培养基:葡萄糖30 g,胰蛋白胨25 g,植酸钙5 g,琼脂20 g,NH4NO35 g,MgSO4·7H2O 0.5 g,MnSO40.01 g,FeSO40.03 g,KCl 0.5 g,水1 000 mL,pH7.0~7.4。121℃灭菌20 min。
(2)液体发酵培养基:葡萄糖30 g,酵母膏5 g,胰蛋白胨20 g,NH4NO35 g,MgSO4·7H2O 0.2 g,Mn-SO40.03 g,KCl 0.1 g,NaCl 0.3 g,CaCl22 g,K2HPO40.04 g,水1 000 mL,pH7.0。121℃灭菌20 min。
(3)固体发酵培养基:麸皮50 g,蒸馏水35 mL,胰蛋白胨0.75 g,NH4NO30.25 g,CaCl20.1 g,MgSO4·7H2O 0.015 g,K2HPO40.002 g;混合均匀,装入500 mL 锥形瓶中,以4 层纱布封口,121 ℃灭菌15 min。
1.2 方法
1.2.1 小龙虾肠道产植酸酶菌的筛选及鉴定
无菌解剖小龙虾,取消化道剪碎后制成悬液,涂布在筛选平板上,37℃培养48~72 h。挑取有水解圈的菌落进行复筛、纯化和保藏,进行革兰氏染色和分子生物学鉴定。采用细菌基因组DNA 提取试剂盒提取DNA,通用引物为27F 与1492R,PCR 条件为:94℃预变性5 min;30 个循环(94℃变性1 min,53℃退火1 min,72℃延伸1.5 min);72℃延伸10 min。产物测序结果于NCBI 数据库进行对比。
1.2.2 植酸酶活性测定
按照GB/T 18634-2009[5]方法测定无机磷的标准曲线。采用偏钒酸铵法测定植酸酶活性[6]。以37℃、pH5.5 条件下,1 min 从2.5 mmol/L 植酸钠溶液中水解释放l nmol 无机磷所需要的酶量定义为一个酶活单位,以U 表示。
1.2.3 抑菌试验
副溶血弧菌Vibrio parahaemolyticus 和嗜水气单胞菌Aeromonas hydrophila 培养液稀释10 倍,分别取400 μL 涂布平板。分别取Z4、Z11 无细胞上清液以及发酵菌液,以250 μL 注入牛津杯,于合适温度下培养48 h,测定其抑菌圈直径。以无菌蒸馏水作为对照。
1.2.4 植酸酶的酶学性质
液体发酵培养22 h 的Z11 菌液,10 000 r/min 离心10 min,取上清液即为粗酶液。将粗酶液与底物分别在不同温度(30℃、35℃、37℃、40℃、45℃和50℃)及不同pH(4.5、5.0、5.5、6.0、6.5、7.0、7.5 和8.5)条件下反应,测定其酶活力,其中pH4.5~6.5 采用乙酸-乙酸钠缓冲液,pH7.0~8.5 采用Tris-HCl 缓冲液。
将不同金属盐(CaCl2、MgSO4·7H2O、KCl、NaCl、MnSO4、FeSO4·7H2O)加入酶促反应体系,使得各金属离子终浓度为5 mmol/L,测定各金属离子对酶活力的影响。
1.2.5 固态发酵条件的优化
(1)单因素试验:初始条件为:添加0.03%的MgSO4·7H2O,接种量7%,30℃发酵36 h。分别改变发酵时间为16 h、24 h、36 h、48 h 和60 h,发酵温度为25℃、30℃、34℃和37℃,接种量为3%、5%、7%、9%和11%,MgSO4·7H2O 添加量为0.01%、0.03%、0.05%、0.07%和0.09%。测定各条件下产植酸酶活性和芽孢杆菌数。
(2)正交试验:在单因素试验基础上,每个因素选取3 个水平,采用L9(34)正交表进行正交试验。
2 结果与分析
2.1 小龙虾肠道产植酸酶菌的筛选、鉴定及比较
从小龙虾肠道中共分离出8 株产植酸酶菌株,其水解圈直径/菌落直径(D/d)见表1。16S rDNA 分析显示:Z2 为寡养单胞菌属Stenotrophomonas,Z5为头状葡萄球菌Staphylococcus capitis,Z3、Z6、Z8、Z9 为 克 雷 伯 氏 菌 属Klebsiella pneumoniae,Z4 与Z11 为蜡样芽孢杆菌Bacillus cereus。已有研究表明,蜡样芽孢杆菌为水产养殖中的潜在益生菌[7,8]。分离自凡纳滨对虾Litopenaeus vannamei 肠道的蜡样芽孢杆菌PC456 能显著降低对虾肠道及养殖环境中细菌总数及弧菌数[8];而张洪玉等[9]的急性毒性试验表明,蜡样芽孢杆菌D7 未对凡纳滨对虾产生明显毒性。故选择Z4 与Z11 进行后续研究。
由表2 可知:在菌体浓度为109CFU/mL 时,Z11产植酸酶的酶活远高于Z4。抑菌试验表明,Z11 对副溶血弧菌和嗜水气单胞菌两种病原菌[10]的抑制能力均高于Z4,且Z11 的活菌菌液作用要优于其发酵上清液,提示该蜡样芽孢杆菌主要通过占位效应成为优势菌群,通过竞争营养物质和生存空间等来抑制病原菌的生长[7]。综上所述,Z11 为最优候选菌株。
2.2 Z11 所产植酸酶的酶学性质
由图1 可知,无机磷浓度与吸光度间线性关系良好,回归方程为y=0.2703x-0.0341,R2=0.9903。
由图2 可知,Z11 所产植酸酶的最适温度为35~37℃,与大部分报道的芽孢杆菌植酸酶最适温度在55℃左右不同[11]。小龙虾的最适生长水温在20~32℃,该酶的最适温度较低,能更好地发挥作用。由图3 可知,该植酸酶的最适pH 为5.5,不同于报道中绝大部分细菌植酸酶的最适pH 在6.0~7.5之间[11]。与大多数无胃淡水鱼类不同,虾类的消化道前肠部分具有胃的结构,但其几乎不分泌胃酸。有研究表明:虾的消化道pH 呈弱酸性[12],南美白对虾胃组织内pH 为5.2 左右,肝胰脏pH 为6.0 左右,中肠道pH 为6.8 左右[12],。由此推测,小龙虾摄食该植酸酶与饲料后,能在胃中较好地发挥作用,降解饲料中的植酸盐,而到达肝胰脏和肠道时也能保持45%以上的酶活。
由图4 可知,与大量研究一致[11],Ca2+能提高植酸酶的酶活,而Mg2+对该酶激活作用更强烈,能提高酶活80%以上,这在报道中比较少见,显示该酶具有一定特殊性。Mn2+、Fe2+、K+和Na+抑制了该植酸酶的活性,在固态发酵培养基中不再添加这些金属盐。

表1 各菌株的产酶鉴定及16S rDNA 分析结果Tab.1 Identification and 16S rDNA analysis of each phytase-producing bacterium strain
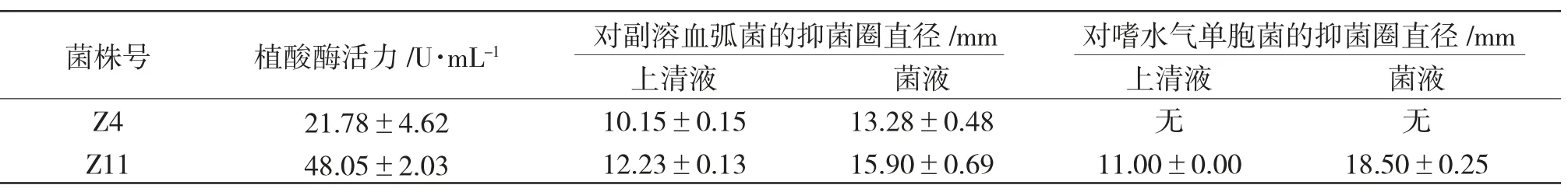
表2 Z4 与Z11 酶活力及抑菌效果比较Tab.2 Comparison of enzyme activities and antibacterial effects between Z4 and Z11 strains
2.3 Z11 固态发酵的单因素试验
由图5 可知,发酵36h 时,Z11 菌数和所产酶的活性达最高值。发酵前期营养条件充足,细胞生长繁殖迅速,开始产植酸酶,并随着菌数增长植酸酶活性也增长,而36h 后,细菌逐渐进入衰亡期,菌数和酶活迅速下降,其产酶模式为同步合成型。与其他芽孢杆菌的固态发酵不同[13],该菌生长繁殖十分迅速,发酵时间对其生长繁殖影响显著,在正交试验选择时间水平时,应缩短其时间间隔。
由图6 可知,34℃时Z11 菌数达最大值,而酶活在30℃最高,到34℃略有下降,这与许多报道一致,细菌的最适产酶温度略低于其最适生长温度[6]。
由图7 可知,接种量为3%~7%时,酶活力平缓上升,而菌数则显著上升,接种量为7%时菌数和酶活力最优。接种量过高时,其所需营养大于培养基所能提供的营养,菌体活力下降,酶产量也随之减少。
由图8 可知,硫酸镁添加量对Z11 菌数影响不大,基本都维持在109CFU/g 以上,低浓度添加量时菌数更高,而添加量为0.01%时酶活最高。该添加量与王文君等[14]所报道的培养基中加入5 mmol/L Mg2+能提高植酸酶产量基本吻合。当Mg2+过高时,酶活反而会下降,这表明,尽管Mg2+对该酶有较明显的激活作用,但并不是浓度越高越好,在发酵培养基中其最适添加量低于在酶促反应中的添加量。
2.4 Z11 固态发酵的正交试验
综合单因素试验结果,对发酵时间、发酵温度、接种量、硫酸镁添加量4 个因素各选择3 个水平,设计了L9(34)正交试验(表3),结果见表4。
由表4 可知,以植酸酶活力为考察指标,极差R 值大小顺序为:RA>RB>RD>RC,即各因素对酶活的影响次序为:发酵时间>发酵温度>硫酸镁添加量>接种量。由表5 方差分析可知,发酵时间对酶活力影响极显著(P<0.01),发酵温度影响显著(P<0.05),其他两因素影响均不显著(P>0.05)。K 值分析显示,产酶最优组合为A2B1C3D1,该组合不在9 组正交试验中,需要进行验证。以菌数为考察指标,影响次序为发酵时间>发酵温度>接种量>硫酸镁添加量,但表5 显示,四个因素对菌数的影响均不显著(P>0.05)。K 值表明,菌数的最优组合为A3B3C2D1,即正交试验第9 组,其菌数最高,但其酶活却非常低,故不合适。
综合酶活力与菌数两个指标考虑,由于发酵时间与温度对酶活力影响均显著,而对菌数影响均不显著,故选择其对酶活的最优组合A2B1。硫酸镁对菌数和酶活力的影响,最优组合均为D1,接种量对菌数影响更大,故选择C2,形成组合A2B1C2D1,将该组合与产酶最优组合A2B1C3D1一起进行验证试验。
由表6 可知:A2B1C3D1酶活为(220.80±5.55)U/g,菌数为1.6×109CFU/g,均高于所有组合,故最佳固态发酵条件为:发酵36 h,发酵温度30℃,接种量7%,MgSO4·7H2O 添加量为0.01%。
麸皮富含植酸盐,有利于诱导产生细菌植酸酶[6],是小龙虾饲料的常用原料,其发酵物将可作为生物饲料[15]。该发酵物含有丰富的植酸酶及Z11 活菌,对副溶血弧菌及嗜水气单胞菌有较好的抑制作用(表6),有利于小龙虾消化饲料中的植酸,以及抵抗病原菌。

表3 正交因素水平表Tab.3 The factors and levels in the orthogonal test

表4 正交试验结果及分析Tab.4 Results and analysis of the orthogonal test

表5 正交试验结果方差分析Tab.5 Analysis of variance of orthogonal test results

表6 验证试验Tab.6 Results of verification test
3 讨论
我国微生态制剂在水产养殖中的发展和应用滞后于陆生动物,其菌种受陆生动物的产品制约,缺乏针对性,很多菌株并不适合在水产动物消化道及养殖水体中增殖[16,17]。如虾类的消化道既不同于陆生动物呈酸性,也不同于无胃鱼类呈中性,因此迫切需要针对特定的水产动物,挖掘宿主来源的土著菌群[18]。目前报道,水产动物大多适合采用芽孢杆菌所产中性植酸酶,但这些芽孢杆菌大都分离自土壤[3],极少从水产动物的胃肠道分离获得。本研究首次从小龙虾消化道分离鉴定得到产植酸酶的蜡样芽孢杆菌Z11,其最适温度为37℃,最适pH 为5.5,Mg2+对其有很强激活作用。这些性质均不同于以往分离自土壤的产中性植酸酶芽孢杆菌,推测其能更好适应小龙虾的胃肠道。Z11 对小龙虾的主要病原菌副溶血弧菌和嗜水气单胞菌均有较强抑制作用。本研究室研究还表明,Z11 能较好地降解模拟小龙虾养殖水体中的淀粉、蛋白质、氨氮及亚硝氮,预计能进行综合应用。本研究对水产动物土著菌群的发掘具有一定指导作用。
优化微生物发酵产酶的发酵条件时,通常只评价酶活一个指标[13,14]。事实上,微生物活细胞数量与产酶大都呈现一致性[15],而产酶菌株大多数都是益生菌,兼具其他益生特性。本研究中,Z11 除了具有良好产酶能力,其活菌还对小龙虾的病原菌有较强抑制作用,为此笔者对固态发酵设置植酸酶活与活菌数两个指标,这在以往的发酵中也较少见。综合评定后得到最优发酵条件为:发酵时间36 h,温度30 ℃,接种量7%,MgSO4·7H2O 添加量为0.01%,所得产品酶活为220.80 U/g,活菌数为1.6×109CFU/g,对副溶血弧菌和嗜水气单胞菌的抑菌圈分别为15.25 mm、11.25 mm,为兼具酶活与抗菌活性的新型微生态制剂。当然,其添加进饲料后能否对小龙虾的消化以及抵制病原菌产生显著效应,还有待于后续进一步研究。本研究对小龙虾新型饲料添加剂的开发具有重要意义。
