二球悬铃木凋落叶分解初期对水体总氮和总磷的影响研究
2021-01-04李艳晖王瑜李砧麻秋团
李艳晖, 王瑜, 李砧, 麻秋团
二球悬铃木凋落叶分解初期对水体总氮和总磷的影响研究
李艳晖, 王瑜, 李砧, 麻秋团
太原师范学院生物系, 山西 晋中 030619
为研究凋落叶在小型水体分解初期对水体N、P含量变化的影响, 在实验室内模拟了秋季二球悬铃木()凋落叶在水体中短期分解的过程, 研究了不同质量凋落叶分解对水体总氮(TN)、总磷(TP)的影响。结果表明: 二球悬铃木凋落叶中磷(P)在10 h内淋溶作用明显, 水体TP含量在10 h内持续上升; 而凋落叶质量不同, 氮(N)快速淋溶时间不同, 1—2 g凋落叶发生在6 h内, 3 g凋落叶在24 h内持续释放N。二球悬铃木凋落叶在水体分解4 d过程中, 均表现为N、P的整体释放, 但N、P变化特征不同, 1—2 g凋落叶水体中TN峰值出现在48 h, 3 g凋落叶峰值在72 h; 而TP峰值分别为10 h(1 g)、72 h(2 g)和96 h(3 g)。随凋落叶质量增加, 水体TN、TP含量升高且差异显著, 1 g、2 g和3 g凋落叶水体中的TN含量平均值分别为0.217 mg·L–1、0.475 mg·L-1和0.644 mg·L–1, TP含量平均值分别为0.132 mg·L–1、0.192 mg·L–1和0.302 mg·L–1。二球悬铃木凋落叶水体TP显著高于白蜡凋落叶水体TP, TN波动变化但整体上也高于白蜡落叶水体。
二球悬铃木; 凋落叶; 分解初期; 总氮; 总磷
0 前言
凋落物的分解是森林生态系统和流域生态系统中养分循环和能量流动的重要过程。相较于陆地生态系统[1-3], 凋落物在水体中分解的研究相对薄弱, 现已有关于岷江上游高山森林河流[4-7]、长白山森林源头溪流[8-9]、帽儿山溪流[10]、亚布力山涧溪流[11]、三峡香溪河流域[12-14]、九寨沟国家自然保护区高山湖泊[15]、太湖流域上游西苕溪源头溪流[16]、三江平原沼泽湿地[17-18]、纳帕海湿地[19]等凋落叶分解速率、营养元素动态变化特征及其影响因素的报道。影响凋落叶分解的因素主要有落叶自身性质[19-20]、水体理化性质如pH[21]、湿度[19, 22]、温度[23]、水体冻融[4-6]、水流速度[6]、底栖无脊椎动物[8-11, 16], 甚至氮沉降、全球变暖、臭氧层破坏等全球变化[1]。
不同于陆地生态系统的是, 水域环境中水温相对稳定、水分供给充足、营养元素循环、交换速度快[4, 7], 因此, 凋落叶在水体中的分解速率均高于陆地生态系统[6, 13, 15, 24]。对于流动水体来说, 一定的水流速度使得营养元素的循环速度加快, 有利于细菌和真菌的定殖, 同时具有一定的冲刷作用, 加快了流动水体中叶片凋落物的分解。凋落叶在溪流中的分解一般可分为3个阶段, 短暂的淋溶过程、微生物定殖与分解、底栖动物定殖与取食活动[8-10]。凋落叶浸泡在水中, 由于较强的淋溶作用, 可溶性物质在分解初期(第1 d)的快速流失使得凋落叶干重损失率显著[25], 在短期内(3天), 凋落物干重流失率较高[13]且干物质中磷含量降低[14]。因此, 落叶进入水体后在较短时间内就可能释放出大量的可溶性碳(C)、氮(N)、磷(P)等物质, 进而影响水体生态系统的营养盐水平、生物群落组成与结构以及重要生源要素的地球化学物质循环。
目前, 水生态系统中凋落叶分解研究多集中在河流、溪流等流动水体中[4-14, 25], 对于水流缓慢或相对封闭如湖泊、池塘、人工湖等水体中凋落物分解研究较少, 且主要关注凋落叶在水体中的分解速率及其影响因素[24-26], 鲜有关于凋落叶在快速分解期(0—4 d), 尤其是1 d内的分解特征及其对水体水质影响[27]的报道。人工景观水体是一类特殊的小型水生态系统, 其周边常分布有大面积的草坪及观赏树种。这类水体往往由于其自身容量小、水流速度缓慢、自净能力有限, 多处于人口密集区等而受到了严重的污染。秋季是我国北方大量树种树叶集中凋落的时期, 尤其在遭遇大风、降温、降雨天气时, 树叶会大量掉入水中或随地表径流进入水体。而秋末的凋落物往往具有丰富的可溶性组分[6], 进入水体后通过淋溶作用在短期内释放大量的溶解性物质, 研究表明, 凋落叶在流动或静止水体中的淋溶阶段均主要出现在第1天[25], 这些于短期内暴发性进入水体的外源性营养物将可能对小型水体生态系统的结构、物质循环和能量流动产生显著影响, 进一步加剧水体污染或造成水质恶化。
悬铃木()为悬铃木科落叶乔木, 包括一球悬铃木()、二球悬铃木()和三球悬铃木(), 大型单叶互生, 叶被树枝状及星状绒毛[28], 是典型的阔叶速生树种, 树形优美且抗逆性强, 被誉为“行道树之王”, 在我国被广泛种植。二球悬铃木是太原市常见的行道和园林绿化树种, 也是太原师范学院校园内主要的行道绿化树木, 本文以二球悬铃木凋落叶为研究材料, 在实验室内模拟了北方秋季小型水体中落叶N、P营养元素的短期动态释放过程和对水质的影响, 并同白蜡落叶释放特征进行比较, 以探究二球悬铃木凋落叶养分在水体中的快速释放特征及可能造成的水体污染程度, 为小型水体富营养化的防治和城市园林绿化树种选种提供一定的理论指导。
1 材料与方法
1.1 材料
为减少大气尘埃、虫害等因素对落叶分解的影响, 于2019年秋季, 收集太原师范学院(39°91′N, 116°41′E)校园内新鲜凋落的二球悬铃木()树叶, 去除落叶上泥沙等杂质, 于通风、阴凉处自然晾干, 105 ℃杀青15 min, 60 ℃烘干至恒重, 收集入密封袋中, 密封袋口于室温、黑暗处保存, 以供后续实验所需。
1.2 实验设计和处理方法
选取5个长30 cm、宽20 cm、高20 cm的玻璃水缸(容积为12 L)作为模拟小型水体的装置, 一个作为对照组, 加入7 L蒸馏水, 不加落叶; 其余4个水缸中各装入7 L蒸馏水, 分别准确称取上述烘干至恒重的二球悬铃木凋落叶1 g、2 g、3 g以及白蜡凋落叶(经上述同样处理)2 g, 放于4个水缸中, 用玻璃棒将落叶搅匀。实验期间实验室内温度为(16±1) ℃ (山西省秋季平均气温), 于处理后的2 h、4 h、6 h、8 h、10 h、12 h、24 h和96 h, 分别取各水缸中适量体积水样用于总氮(TN)和总磷(TP)的测定。另外, 分别于处理后36 h、48 h、60 h、72 h、84 h和36 h、48 h、72 h、120 h, 取二球悬铃木落叶水体中适量体积水样用于TN和TP的测定。实验期间, 对照组水体中TN含量(0.061±0.01) mg·L-1和TP含量(0.012±0.00) mg·L-1稳定。用蒸馏水补足因蒸发或取样造成的水量损失。
1.3 测定方法
按照《水和废水监测分析方法》(第四版)[29], 分别采用过硫酸钾氧化—紫外分光光度法和钼锑抗分光光度法测定水体总氮(TN)和总磷(TP)含量。
1.4 数据分析
数据统计与分析采用Excel 2010和SPSS16.0软件, 利用单因素方差分析(One-way ANOVA)中最小显著性差异法(LSD)和Duncan法比较不同时间水体TN和TP变化差异; 采用Pearson相关分析法分析TN和TP之间的相关性; 利用独立样本t检验, 比较不同二球悬铃木凋落叶和白蜡凋落叶释放物对水体TN、TP影响的差异。
2 结果与分析
2.1 不同质量二球悬铃木凋落叶分解对水体TN的影响
不同质量的二球悬铃木凋落叶在水体分解过程中对水体TN的影响如图1所示。可知, 不同质量的凋落叶分解释放物质到水体中, 引起水体TN含量变化的整体趋势不同。1 g落叶的水体中, TN呈波浪型的波动变化(0.096—0.334 mg·L-1), 快速释放高峰在2—6 h, 释放物相对增长率为91.7%。2 g落叶体系中, 水体TN在0.205—0.670 mg·L-1间波动, 快速释放高峰在8—10 h间, 释放物相对增长率为130.2%; 在36 h内水体TN呈上升—下降—上升—下降—上升的变化, 于48—60 h达峰值后下降并逐渐趋于稳定, 叶片中N元素的变化为释放—吸收—释放—吸收—释放。而3 g落叶体系中, 水体TN在0.195—0.878 mg·L-1范围内波动, 呈上升—下降—上升—下降的变化, 快速释放发生在2—4 h内, 释放物相对增长率达167.7%, 之后在4—12 h内缓慢上升, 于24 h和72 h时分别达到第2次和第3次释放小高峰, 但相对释放增长率低于30%。1 g和2 g凋落叶水体在1—4 d内TN变化为先上升后下降, 而3 g水体中TN为持续下降。
二球悬铃木凋落叶在水体0—4 d分解过程中氮元素整体上表现为释放, 且随凋落叶质量增加, 水体TN含量显著升高(如图1所示), 导致水质下降, 1 g、2 g和3 g凋落叶水体中的TN含量平均值分别为(0.217±0.07) mg·L-1、(0.475±0.17) mg·L-1和(0.644±0.17) mg·L-1, 凋落叶水体TN为Ⅱ—Ⅲ类地表水环境质量标准(GB38382—2002); 但释放特征有所不同, 具体表现在: 1)1—2 g落叶快速释放发生在进入水体10 h内, 而3 g落叶的快速释放发生在进入水体4 h内; 2)释放物达峰值时间不同, 1—2 g落叶的水体中TN最大值均出现在48 h, 而3 g落叶水体中TN于72 h时达最高值。
2.2 不同质量二球悬铃木凋落叶分解对水体TP的影响
不同质量的二球悬铃木凋落叶在水体中分解不同时间后对水体TP的影响如图2所示。1 g凋落叶水体中TP含量在0.046—0.216 mg·L-1间波动变化, 表现为上升—下降—上升—下降; 2 g和3 g落叶水体中TP含量分别在0.096—0.281 mg·L-1和0.121— 0.456mg·L-1间变化, 并且在0—3 d内变化趋势基本一致, 均表现为上升—下降—上升—下降—上升的动态变化, 对应于凋落叶中P元素的释放—吸收—释放—吸收—释放变化。3种质量凋落叶水体中, TP含量都于10 h时达24 h内高峰, 其中, 1 g凋落叶在2—10 h内的TP相对增长率最高, 达369.6%。
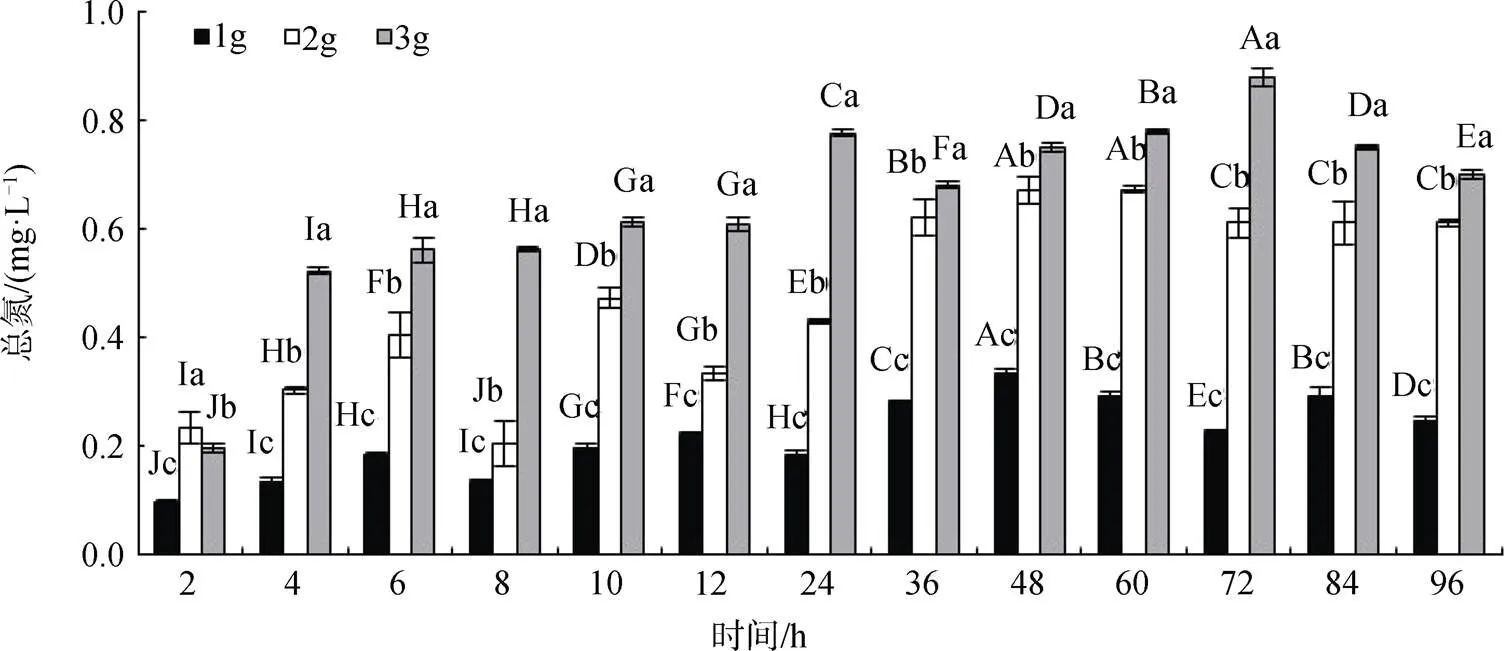
注: 柱状图上不同小写字母表示同一时间不同质量间的差异显著性(P<0.05); 不同大写字母表示同一质量不同时间的差异显著性(P<0.05)。下同。
Figure 1 Effects of foliar litter decomposition ofwith different mass on total nitrogen in water

图2 不同质量二球悬铃木凋落叶分解对水体TP的影响
Figure 2 Effects of foliar litter decomposition ofwith different mass on total phosphorus in water
从整体上看, 不同质量的二球悬铃木凋落叶在水体中均呈现P释放状态。随水体中凋落叶质量增加, TP含量增高显著(除12 h外), 水质明显下降, 1 g、2 g和3 g凋落叶水体中的TP含量平均值分别为(0.132±0.04) mg·L-1, (0.192±0.06) mg·L-1和(0.302±0.09) mg·L-1, 凋落叶水体TP为Ⅲ—Ⅴ类地表水环境质量标准。但不同质量落叶的释放特征不同, 表现在: 1 g质量凋落叶体系中TP在10 h时(24 h内)达到峰值(0.216 mg·L-1), 随后呈现连续吸附—连续释放的波动变化; 2—3 g质量凋落叶连续释放10 h后, 呈现出明显的吸附—释放—吸附—释放态势, 2 g落叶体系中, TP于72 h时达到最大值, 而3 g落叶水体TP含量继续升高, 于120 h时达高峰, 即随落叶质量升高, 水体TP峰值出现时间后移。
Pearson相关性分析结果表明, 二球悬铃木凋落叶在分解过程中, 水体TN和TP两者之间有显著的正相关关系(=0.816,=0.01)。因P元素多存在于易溶性组分中, 在0—10 h内持续升高, 随着微生物生长消耗且P释放量低于N, 在12—36 h内P呈现整体吸附, P在一定程度上制约着N的吸收和释放。
2.3 二球悬铃木和白蜡凋落叶分解对水体TN、TP影响的差异
为进一步阐明二球悬铃木凋落叶在水体分解过程中的特征, 比较了相同实验条件和体系下, 相同质量(2 g)的二球悬铃木和白蜡凋落叶在分解过程中对水体TN(图3)和TP(图4)含量影响的差异。如图3所示, 二球悬铃木凋落叶水体中TN含量在2 h、10 h和96 h时均极显著(<0.01)高于白蜡凋落叶水体中TN, 在6 h和12 h显著(<0.05)高于白蜡凋落叶水体TN含量, 仅8 h显著低于白蜡凋落叶水体TN含量, 4 h和24 h则无明显差异。二球悬铃木和白蜡凋落叶水体TN含量平均值分别为0.374±0.12 mg·L-1和(0.298±0.11) mg·L-1, 均属于Ⅱ类地表水环境质量标准。
从图4可知, 除6 h时TP含量差异为显著外, 二球悬铃木凋落叶水体的TP含量均极显著高于白蜡凋落叶水体中TP, 2种凋落叶在进入水体24 h内释放量达峰值时间不同, 二球悬铃木凋落叶于10 h, 而白蜡凋落叶于12 h出现峰值。二球悬铃木和白蜡凋落叶的分解使得水体TP平均含量分别为(0.186±0.05) mg·L-1和(0.070±0.01) mg·L-1, 前者为Ⅲ类、后者为Ⅱ类地表水标准。
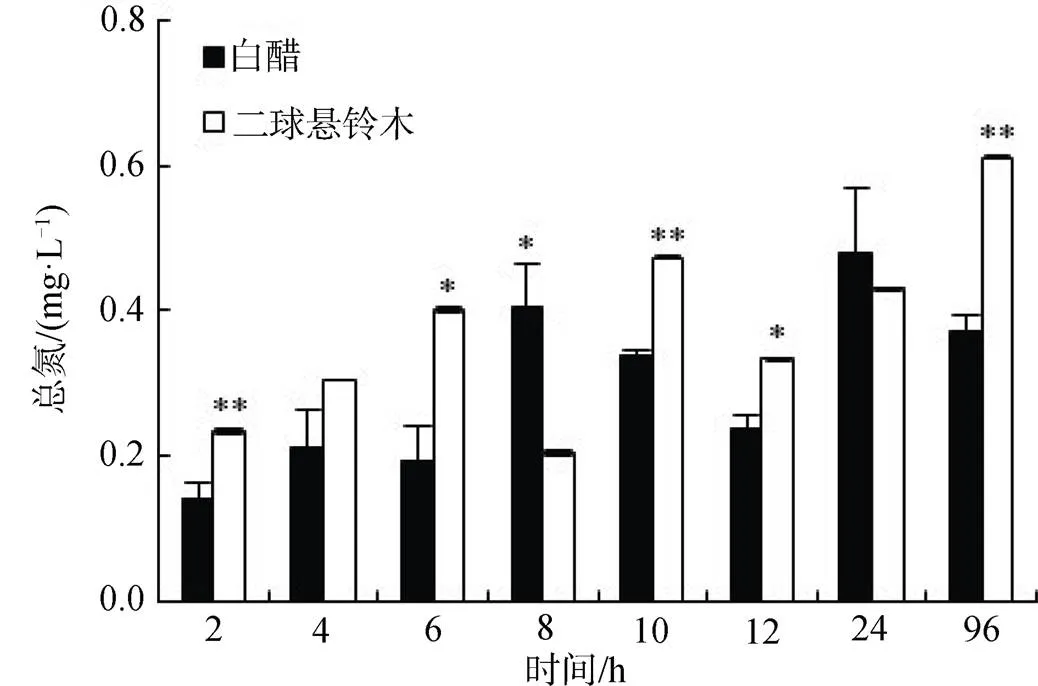
注: 柱状图中*表示差异显著(P<0.05), **表示差异极显著(P<0.01), 下同。
Figure 3 Effects of foliar litter decomposition.andon total nitrogen in water
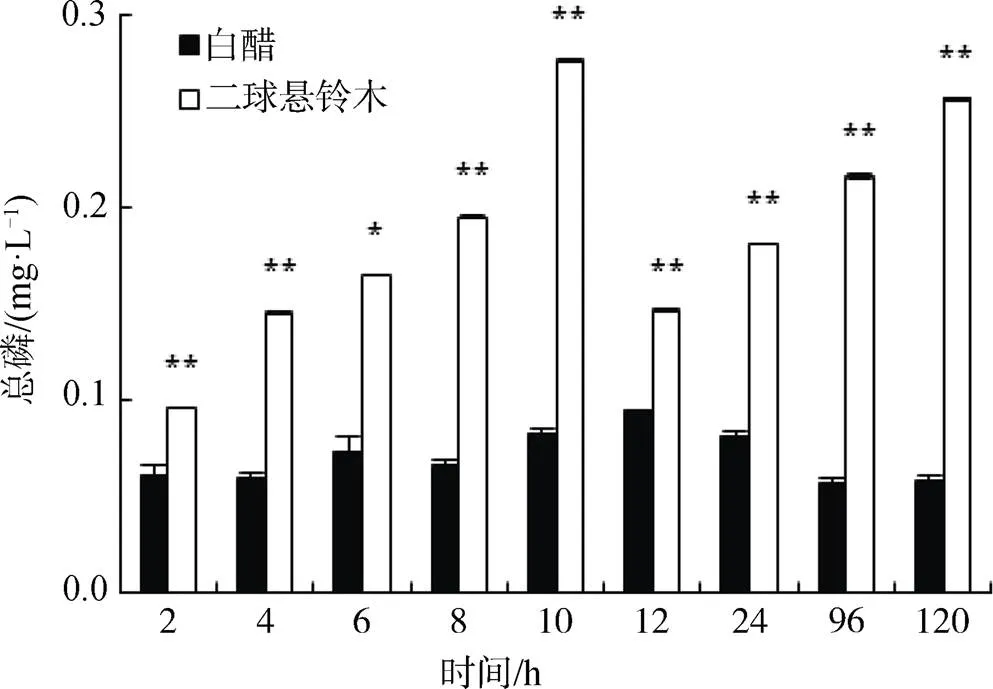
图4 二球悬铃木和白蜡凋落叶分解对水体TP的影响
Figure 4 Effects of foliar litter decomposition ofandon total phosphorus in water
综上, 二球悬铃木和白蜡落叶释放氮、磷元素的动态变化特征不同, 说明两个不同树种凋落叶本身叶结构和初始养分含量存在着显著差异。
3 讨论
大多学者认为凋落物的分解可分为两个过程, 第一阶段是短暂的物理过程, 植物体内易溶组分(有机酸、糖类、蛋白质等)的快速溶解; 第二阶段是微生物及酶对难溶性物质的缓慢分解[13, 30–33]。淋溶阶段是在凋落叶分解过程中具有重要作用, 对后续生物定殖起着重要影响[25]。研究表明, 五裂槭()、扇叶槭()和黄栌(var.)叶片在河流中前3 d内的干重流失率较高[13], 一些水生植物如芦苇()、马来眼子菜()和荇菜()在冬季(水温9.01—18.38 ℃)快速分解阶段为前4 d[32], 茭草()、莲()、菹草()和狐尾藻()在20 ℃左右快速分解阶段为前4 d[33], 亚热带地区8种常见树种在流水(23.58 ℃)和静水(28.58 ℃)水体中淋溶阶段主要出现在第1天[25], 说明不同凋落叶在不同温度的水体中淋溶作用发生的时间存在差异。本研究中二球悬铃木落叶16℃、浸泡6 h内, 水体TN、TP含量显著上升, 表明发生了明显的淋溶作用, N、P等营养元素迅速释放, 但氮、磷淋溶作用持续时间不同。3种质量凋落叶浸泡于水中, 水体TP含量均在0—10 h内持续上升而后下降, 磷的淋溶阶段主要在0—10 h内; 而1—2 g凋落叶水体中TN含量在0—6 h内上升后即下降, 淋溶主要发生在0—6 h, 3 g凋落叶水体中TN含量在24 h内持续升高, 淋溶阶段主要在第1 d。这可能与N、P元素在植物体内的化学形式、所组成物质的结构以及它们的初始质量不同有关, P在植物组织中主要以磷酸根离子或化合物的形态存在, 而N是构成蛋白质、核酸、磷脂、叶绿素等活细胞赖以生存的结构或功能成分, 磷的释放优先于氮[23, 30, 33], 在淋溶期即使是同种落叶, 随质量变化, N的变化也是无规律的[5]。
凋落物分解是一个复杂的过程, 受到诸多因素的影响, 例如凋落物初始C、N、P含量、木质素含量和C/N值等, 不但影响凋落物的分解速率[23, 31, 33–35],而且在很大程度上决定了落叶养分的固定和矿化[36–37], 导致其释放量的不同。从整体上看, 水体TN和TP含量随二球悬铃木凋落叶质量增加而显著增加, 但不同质量的二球悬铃木凋落叶分解释放N、P特征存在差异。在1—4 d分解期间, 1—2 g二球悬铃木落叶同菹草分解中氮含量变化过程一致, 先上升后下降[30], 而3 g水体中TN为先下降后上升, 可能原因是3 g落叶中其初始可溶性氮物质含量高, 在24 h内一直处于快速淋溶释放阶段, 而随着微生物的生长需求, 发生了N的吸附。而磷经过10 h的快速淋溶损失后, 1 g凋落叶水体中呈现明显的连续吸附—释放过程, 2—3 g落叶体系中10—72 h内变化趋势一致, 下降—升高—下降再升高的波浪式变化。随凋落叶质量增加, 1—4天内, 水体TP峰值出现时间依次为10 h、3 d和4 d, TN峰值依次为2 d、2 d和3 d。表明同一种树木的凋落叶, 其分解过程中N、P释放特征随质量的不同呈现出不同的变化, 同落叶初始基质含量存在差异有关外, 还存在着其他影响因素。
温度被认为是影响凋落物分解的重要物理因素, 本模拟研究在16 ℃下进行, 温度不是主要的影响因子, 但稳定的水温为模拟体系中微生物的生长、繁殖提供了一定有利条件。1—2 g二球悬铃木凋落叶中N在6—8 h时表现为吸附, 可能是由于微生物在落叶中定殖、生长, 当枯落物营养供给不能满足微生物生长所需时, 微生物就会从外界环境中吸收, 表现为对N的需求; P的明显吸附发生在12 h和36 h, 说明随着N的动态变化, 微生物生长的限制因子在不断地变化, 而P释放量整体上小于N, 因此, P的释放与吸附成为落叶分解的限制因子, 在起始的36 h内, 微生物处于初期建群阶段, 对营养元素的需求受到落叶初始基质质量、比例的限制, 这可能也是二球悬铃木凋落叶N、P元素释放的相关性的原因之一[38–41]。当水体微生物和真菌固定的养分满足其生长繁殖所需、群落基本稳定后, 就开始了微生物对落叶的生物分解作用, 导致N、P等释放, 表现为在36—48 h内水体中TN、TP含量的一致升高, 48 h之后不同质量悬铃木落叶水体中TN、TP变化的不同。3 g凋落叶水体中, TN和TP变化基本一致, 拐点出现在72 h后, 进一步说明不同质量凋落叶分解过程中营养元素含量变化不同除了同其初始质量相关外, 与微生物的分解活动有着密不可分的联系, 但具体的影响机制目前还尚未明确, 需进一步深入研究, 以期揭示不同树种凋落叶分解过程中细菌、真菌群落的发生、发展和演替过程和机制。
凋落叶在水体中的分解还受叶片自身性质的影响, 例如叶片厚度、比叶面积等, 石栎()叶片N、P含量高于山胡椒(), 但石栎叶片厚度显著大于山胡椒, 使得分解初期石栎叶分解速率低于后者[16]。二球悬铃木凋落叶在水体0—4 d分解过程中, 氮、磷整体上表现为动态变化的释放过程, 结果同赵勇等[31]一致, 法国梧桐落叶(又称三球悬铃木,)在0—9 d内向水中释放氮素, 0—4 d落叶中磷含量呈下降趋势, 表明同属植物间物种差异较小。而对比二球悬铃木和白蜡凋落叶分解特征, 整体上前者释放氮、磷量都高于白蜡, 两者凋落叶分解过程中N、P元素的释放存在明显的物种差异。可能的原因是: 1)两种凋落叶初始基质成分N、P 含量、C/N、C/P、木质素和纤维素等存在差异, 不同凋落叶分解速率的主控因子存在差异[42–43]; 2)凋落物本身性质, 如叶结构、质地等。二球悬铃木叶片大, 较薄, 非革质, 而白蜡叶表面具角质层。研究表明, 叶表面角质层的有无及其厚度是影响凋落叶分解速度的原因之一, 木荷()凋落叶分解较青冈()慢, 其原因之一是其叶表面角质层较青冈厚[43]。黧蒴锥()凋落物失重率小于尾叶桉()的可能原因为其叶表面存在的角质层对真菌菌丝入侵有阻滞作用[2], 同时对水进入叶内起到了阻滞作用, 导致凋落物分解减慢。
4 结论
(1)二球悬铃木凋落叶中N、P快速淋溶的时间不同, P发生在凋落叶进入水体0—10 h内, 同凋落叶质量无关; 而N的快速淋溶同凋落叶质量有关, 1—2 g落叶在0—6 h内, 而3 g落叶在1 d内。
(2)随二球悬铃木凋落叶质量增加, 水体TN、TP含量显著升高, 表现为N、P的整体释放, 但N、P元素释放特征存在差异, 同凋落叶的初始基质质量、微生物生长繁殖对营养元素的需求等有关。
(3)二球悬铃木凋落叶N、P释放量整体上高于白蜡凋落叶, 物种间差异显著。
[1] 曾锋, 邱治军, 许秀玉. 森林凋落物分解研究进展[J]. 生态环境学报, 2010, 19(1): 239–243.
[2] 刘姝媛, 胡浪云, 储双双, 等. 3种林木凋落物分解特征及其对赤红壤酸度及养分含量的影响[J]. 植物资源与环境学报, 2013, 22(3): 11–17.
[3] 谌贤, 刘洋, 唐实玉, 等. 川西亚高山森林凋落物不同分解阶段基质质量特征[J]. 西北植物学报, 2017, 37(3): 586–594.
[4] 张川, 杨万勤, 岳楷, 等. 高山森林溪流冬季不同时期凋落物分解中水溶性氮和磷的动态特征[J]. 应用生态学报, 2015, 26(6): 1601–1608.
[5] 岳楷, 杨万勤, 彭艳, 等. 岷江上游高山森林冬季河流中凋落叶碳、氮和磷元素动态特征[J]. 应用与环境生物学报, 2015, 21(2): 301–307.
[6] 张川, 杨万勤, 岳楷, 等. 高山森林溪流凋落叶冬季水溶性碳含量动态[J]. 环境科学学报, 2016, 36(3): 792–801.
[7] 岳楷, 杨万勤, 彭艳, 等. 高寒森林溪流对凋落叶分解过程中木质素降解的影响[J]. 植物生态学报, 2016, 40(9): 893–901.
[8] 王璐, 杨海军, 李玲, 等. 长白山地区溪流冻结初期凋落叶分解与底栖动物定殖的关系[J]. 应用生态学报, 2017, 28(11): 3775–3783.
[9] 陈鸽, 王璐, 宫雨薇, 等. 季节性冻融期长白山森林溪流中凋落叶N、P的释放动态[J]. 生态环境学报, 2019, 28(12): 2341–2348.
[10] 何凡, 寇冀蒙, 曾旖志, 等. 帽儿山溪流中大型底栖动物的定殖对两种树叶分解速率的影响[J]. 东北林业大学学报, 2016, 44(1): 85–89.
[11] 阚春梅, 刘曼红, 王令刚, 等. 亚布力山涧溪流2种树叶的分解速率与大型底栖动物定殖关系[J]. 东北林业大学学报, 2013, 41(9): 103–112.
[12] 江明喜, 邓红兵, 唐涛, 等. 香溪河流域河流中树叶分解速率的比较研究[J]. 应用生态学报, 2002, 13(1): 27–30.
[13] 陈书秀, 江明喜. 三峡地区香溪河流域不同树种叶片凋落物的分解[J]. 生态学报, 2006, 26(9): 2905–2912.
[14] 刘昕, 江明喜, 邓红兵. 三峡地区香溪河流域叶片凋落物分解过程中N、P含量动态研究[J]. 武汉植物学研究, 2008, 26(6): 613–619.
[15] 徐波, 朱忠福, 李金洋, 等. 九寨沟国家自然保护区4个典型树种叶片凋落物在林下及高山湖泊中的分解及养分释放特征[J]. 植物生态学报, 2016, 40(9): 883–892.
[16] 卢东琪, 张勇, 刘东晓, 等. 太湖流域上游西苕溪源头溪流中毛竹、石栎和山胡椒落叶分解比较[J]. 湖泊科学, 2012, 24(3): 371–377.
[17] 刘景双, 孙雪利, 于君宝. 三江平原小叶樟、毛果苔草枯落物中氮素变化分析[J].应用生态学报, 2000, 11(6): 898–902.
[18] 杨继松, 刘景双, 于君宝, 等. 三江平原沼泽湿地枯落物分解及其营养动态[J]. 生态学报, 2006, 26(5): 1297– 1302.
[19] 王行, 闫鹏飞, 展鹏飞, 等. 植物质量、模拟增温及生境对凋落物分解的相对贡献[J]. 应用生态学报, 2018, 29(2): 474–482.
[20] 伍琪, 任世奇, 项东云, 等. 四种南方常见速生树种凋落叶浸泡实验研究[J]. 生态科学, 2018, 37(6): 60–66.
[21] 童晓立, 颜玲, 赵颖, 等. 树叶凋落物在受酸性矿山废水污染溪流中的分解[J]. 生态学报, 2006, 26(12): 4033– 4038.
[22] 马志良, 高顺, 杨万勤, 等. 亚热带常绿阔叶林凋落叶分解过程中氮和磷在不同雨热季节的释放动态[J]. 应用与环境生物学报, 2015, 21(2): 308–315.
[23] 戚美侠, 王红萍, 陈杰. 冬、春季芦苇()和狭叶香蒲()的腐解过程及其对水质的影响[J]. 湖泊科学, 2017, 29(2): 420–429.
[24] 迟国梁, 王军, 王建武, 等. 两种树叶在华南地区陆地与水环境中的分解速率比较[J]. 生态科学, 2009, 28(4): 299–304.
[25] 迟国梁, 童晓立. 亚热带地区树叶凋落物在流水和静水环境中的淋溶规律[J]. 生态科学, 2010, 29(1): 50–55.
[26] 刘若思, 彭芳, 童晓立. 两种树叶在华南地区贫营养型池塘中的分解速率研究[J]. 生态科学, 2007, 26(1): 27–29.
[27] 王桢桢, 潘杨, 黄勇, 等. 枯落物腐烂分解对封闭景观水体的影响[J]. 安全与环境学报, 2016, 16(3): 305–309.
[28] 中国科学院中国植物志编辑委员会. 中国植物志(第三十五卷·第二分册) [M]. 北京: 科学出版社, 1979: 118.
[29] 国家环境保护总局. 水和废水监测分析方法(第四版)[M]. 北京: 中国环境科学出版社, 2002: 243–258.
[30] 张菊, 邓焕广, 吴爱琴, 等. 东平湖菹草腐烂分解及其对水环境的影响[J]. 环境科学学报, 2013, 33(9): 2590– 2596.
[31] 赵勇, 苗蕾, 孙聪楠, 等. 树木枯落叶在河流水体中的分解及氮、磷释放动态[J]. 水土保持学报, 2010, 24(1): 172–175.
[32] 曹勋, 韩睿明, 章婷曦, 等. 冬季水生植物分解过程及其对水质的影响研究[J]. 农业环境科学学报, 2015, 34(2): 361–369.
[33] 曹培培, 刘茂松, 唐金艳, 等. 几种水生植物腐解过程的比较研究[J]. 生态学报, 2014, 34(14): 3848–3858.
[34] APONTE C, GARCIA L V, MARANON T. Tree species effect on litter decomposition and nutrient release in Mediterranean oak forests changes over time [J]. Ecosystems, 2012(15): 1204–1218.
[35] 王静, 徐广平, 曾丹娟, 等. 岩溶区和非岩溶区两种优势植物凋落叶分解的比较研究[J]. 广西植物, 2013, 33(3): 338–345.
[36] PARTON W, SILVER W L, BURKE I C, et al. Global-scale similarities in nitrogen release patterns during long-term decomposition[J]. Science, 2007(315): 361–364.
[37] OSONO T, AZUMA J, HIROSE D. Plant species effect on the decomposition and chemical changes of leaf litter in grassland and pine and oak forest soils[J]. Plant and Soil, 2014(376): 411–421.
[38] AERTS R, WALLEN B, MALMER N. Growth-limiting nutrients in-dominated bogs subject to low and high atmospheric nitrogen supply[J]. Journal of Ecology, 1992, 80(1): 131–140.
[39] ENRIQUEZ S, DUARTE C M, SAND-JENSEN K. Patterns in decomposition rates among photosynthetic organisms: the importance of detritus C: N: P content[J]. Oecologia, 1993, 94(4): 457–471.
[40] VEHOEVEN J T A, KEUTER A, van LOGTESTIJN R, et al. Control of local nutrient dynamics in mires by regional and climatic factors: a comparison of Dutch and Polish sites[J]. Journal of Ecology, 1996, 84(5): 647–656.
[41] GESSNER M O. Breakdown and nutrient dynamics of submergedshoots in the littoral zone of a temperate hardwater lake[J]. Aquatic Botany, 2000, 66(1): 9–20.
[42] 邓仁菊, 杨万勤, 张健, 等. 季节性冻融期间亚高山森林凋落物的质量变化[J]. 生态学报, 2010, 30(3): 830–835.
[43] 仲米财, 王清奎, 高洪, 等. 中亚热带主要树种凋落叶在杉木人工林中分解及氮磷释放过程[J]. 生态学杂志, 2013, 32(7): 1653–1659.
Effects of early decomposition ofleaf litters on water TN, TP
LI Yanhui, WANG Yu, LI Zhen, MA Qiutuan
Biology Department of Taiyuan Normal University, Jinzhong, Shanxi 030619, China
In order to study the effects of foliar litter decomposition in early stage on water total nitrogen (TN) and total phosphorus (TP), short-term decomposition process ofleaf litters in autumn was simulated in the lab, the decomposition influence of different leaf masses on TN and TP was studied. The results showed that TP content continuously increased in 10 hours as a result of obvious phosphorus eluviation within 10 hours. The eluviation time of nitrogen varied with foliar leaf mass, for 1-2 g of litter, eluviation occurred within 6 hours, and 3 g of litter continuously released nitrogen within 24 hours. On the whole, the nitrogen and phosphorus were released obviously during the decomposition ofdeciduous leafin water for 4 days, but the nitrogen and phosphorus release dynamics varied. TN content peaked at 48 hours and 72 hours in the water of 1-2 g and 3 g leaf litters respectively, while maximal TP appeared at 10 hours, 72 hours, and 120 hours in the water of 1 g, 2 g, and 3 g leaf litters, respectively. TN and TP in water significantly increased simultaneously with the rise of leaf mass, average value of TN content was 0.217 mg·L-1, 0.475 mg·L-1, and 0.644 mg·L-1, and that for TP was 0.132 mg·L-1, 0.192 mg·L-1, and 0.302 mg·L-1, respectively in the water of 1 g, 2 g, and 3 g foliar litters. TP content in water ofleaf litters was significantly higher than that of, TN fluctuated and also higher than that of.
; foliar litter; early decomposition; TN; TP
10.14108/j.cnki.1008-8873.2020.06.024
S719
A
1008-8873(2020)06-191-08
2020-02-05;
2020-03-08基金项目:国家自然科学基金项目(51709197); 山西省大学生创新创业训练计划项目(2019500)
李艳晖(1977—), 女, 山西阳泉人, 博士, 讲师, 主要从事淡水污染生态学, E-mail: liyh7822@163.com
李艳晖, 王瑜, 李砧, 等. 二球悬铃木凋落叶分解初期对水体总氮和总磷的影响研究[J]. 生态科学, 2020, 39(6): 191–198.
LI Yanhui, WANG Yu, LI Zhen,et al. Effects of early decomposition ofleaf litters on water total nitrogen and total phosphorus[J]. Ecological Science, 2020, 39(6): 191–198.
