功能微生物菌剂对泰来草生长的促生效应研究
2021-01-04林丽云王聪凌娟杨清松林显程张颖彭秋颖张燕英董俊德
林丽云, 王聪, 凌娟,3, 杨清松,3, 林显程, 张颖, 彭秋颖, 张燕英,3, 董俊德,3,*
功能微生物菌剂对泰来草生长的促生效应研究
林丽云1,2, 王聪1,2, 凌娟1,2,3, 杨清松1,2,3, 林显程1,2, 张颖1,2, 彭秋颖1,2, 张燕英1,2,3, 董俊德1,2,3,*
1. 中国科学院南海海洋研究所, 中国科学院热带海洋生物资源与生态重点实验室, 广州 510260 2. 中国科学院大学, 北京 100049 3. 中国科学院海南热带海洋生物重点实验站, 三亚 572000
目前海草床衰退严重, 海草生态系统的修复是海洋生态修复面临的重要问题。利用海洋喜盐草根际固氮菌(星箭头菌,)和喜盐草根际溶磷菌(芽孢杆菌,)制成海洋微生物复合菌剂, 研究菌剂的添加对泰来草生长的影响。根据泰来草根的生长速率、叶片的生长速率、叶绿素含量、最大光量子产率(/)监测泰来草的生长情况。结果表明, 单纯加入固氮菌剂对泰来草叶片的生长速率、/、叶绿素含量具有显著促进作用, 其中叶绿素a、叶绿素b、总叶绿素浓度比对照组分别提高39.75%、39.46%、39.67%, 叶片的生长速率比对照组增加44.26%; 复合菌剂处理后的泰来草根的长度和数量、/、叶片的生长速率都显著增加。研究表明海草养殖缸中加入固氮菌剂影响泰来草叶片生长速率和光合作用, 但不影响泰来草根的生长; 加入固氮溶磷复合菌剂同时促进泰来草根和叶的生长和光合作用。
微生物菌剂; 海草泰来草; 促生效应; 固氮; 溶磷
0 前言
海草床是生物多样性丰富、生产力很高的热带和亚热带典型海洋生态系统, 它不仅为人类提供多样的海洋生物资源, 且具有巨大的环境调控、修复功能。海草是生物圈中最具生产力的水生生态系统之一[1], 海草床生态系统初级生产力最高可以达到500—1000 g C /m·a, 是珊瑚礁生态系统的3倍, 全球海草床初级生产力总量达0.6×1015g C y r-1, 约占全球海洋总生产力的1.13%[2]。自1800年以来, 全球29%的海草已经消失[3], 全球大约三分之二的海草和湿地栖息地已被人类活动破坏, 直接或间接导致水质恶化和物种入侵增加[4]。20世纪末海草床生态系统才开始大面积的修复[5]。海草床的健康状况、可持续维持高生产能力和海草床生态系统联合共生附生的微生物及其营养循环密切相关[6]。微生物固氮菌群和溶磷菌群与海草的氮、磷供给密切相关, 是驱动海草高初级生产力的重要菌群[7-9]。国内外的调查研究发现海草的根际中有大量可培养固氮微生物菌群, 如从海草大叶藻()根际分离得到了固氮螺菌属(spp.)[10]和脱硫弧菌属(spp.)[11], 大绳草() 根际分离得到的弯曲杆菌菌落(spp.)[12], 二药藻() 根际分离得到的克雷伯菌属(spp.)[13]。国内外的调查研究发现海草的根际中有可培养溶磷微生物菌群, 喜盐草(芽孢杆菌属(, 柠檬杆菌属(sp.), 志贺氏菌属(sp.)和克雷伯菌属(sp.), 环状芽孢杆菌(, 并发现环状芽孢杆菌对磷酸盐具有增溶效果[14]。海洋微生物资源丰富, 可以利用原生态系统的促生菌来改善海草床生态系统的微生物群落结构, 提高海洋浅层土壤的元素含量, 安全有效的促进海草生态系统的恢复。
植物根际促生菌(Plant Growth-Promoting Bacteria, PGPB)是指自由生活在植物根际土壤中或定植于植物根表面、根内或叶片上的一类能够促进植物的生长, 并且提高种子的存活率, 增加植物对病原菌的抵抗性的有益微生物[15]。目前国内外对利用PGPB发酵生产微生物菌剂, 并运用于陆地农作物的研究趋于成熟。Egamberdiyeva[16]在玉米上接种产碱假单胞菌()、芽孢杆菌(), 以未接菌种种植玉米作对照, 发现接菌种组能够显著提高玉米芽和根的N、P含量16%- 85%。陶加法等在玉米上接种耐氨固氮菌, 发现每亩均比对照增长52.8 kg玉米, 平均增产率为11.89%[17]。Suarez等在高盐浓度下生长的大麦接种PGPB-E19T发现, E19T可以促进大麦在高盐土壤中生长[18]。然而, 目前国内外对PGPB应用于海洋生态系统的研究较少。Kathiresan等[19]比较了芽孢杆菌()和固氮菌()施用于红树林幼苗, 根的增长率分别为171.6%和123.9%。张晓君等[20]优化了红树林促生菌剂, 并应用于木榄和秋茄幼苗, 结果显示植株的茎高、茎径、根干重、叶干重、茎干重、总干重都有不同程度的增加。但目前尚无发现PGPB应用于海草促生长的相关研究。
本文试探索利用实验室自制的固氮溶磷微生物促生菌剂, 开展菌剂对泰来草的促生效应研究。泰来草是海南新村湾的典型海草, 复合菌剂对海草的促生长试验在中国科学院海南热带海洋生物重点实验站内进行。试验所用复合菌剂包括固氮菌和溶磷菌, 固氮溶磷菌均筛自大亚湾喜盐草根际。复合菌剂所用固氮菌为星箭头菌(), 菌种保藏于武汉菌种保藏中心, 保藏编号为CCTCC NO: M 2016691; 溶磷菌为芽孢杆菌(), 菌种保藏于武汉菌种保藏中心, 保藏编号为 CCTCC NO: M 2016692。
1 材料和方法
1.1 海草样品采集、处理
海草样品采集于海南省三亚市(18°12’58"N, 109°28’42"E), 采集过程中保持植株的完整, 尽量不破坏海草的根叶。在原位海水中适应5 d后, 每个实验组开始添加菌剂并开始计实验样品培养时间。每个实验组每个重复一个缸(长宽高为65 cm×45 cm×35 cm)分装20株泰来草(根长10 cm, 叶嫩绿, 长度随机), 进行编号固定, 在饱和光照强度(250 μmol photons m-2·s-1), 室温(30℃)下培养。
1.2 菌剂的制备与添加
实验室自制的功能微生物菌剂, 保存一个月后, 用于添加实验。实验共设三个实验组(T1、T2、CK), 每个实验组做3个重复。实验组T1为每个缸中加入固氮菌剂2 g(星箭头菌剂); 实验组T2加入混合固氮溶磷菌剂2 g(1 g星箭头菌剂+1 g芽孢杆菌剂); 对照组CK正常培养不添加菌剂。每个缸隔7 d换原位海水, 每次换水实验组重新加入菌剂, 持续培养7周。
1.3 植株指标测量
1.3.1 泰来草叶片的生长速率
第20 d时, 随机选取6株泰来草, 用铜线圈在距离根部1 cm位置处标记海草主茎位置(图1), 铜线圈标定位置以上测量植株的长度。实验组添加菌剂1周后, 测量植株增长的的长度新增叶片的长度由公式1计算。
()公式1
其中为生长速率, cm·d-1。为标记增长的长度, cm;为新增叶片和小叶片的长度, cm。
1.3.2 光合作用强度测定
光合作用强度由Diving-PAM测定, 测量随机标记的植株叶片最大荧光产量, 光合作用强度由最大光量子产率代表(/), 测量重复三次。计算公式如公式2所示。

图1 泰来草叶片标记图
Figure 1 Leaf marking of
(-F)公式2
其中为在暗适应下打开饱和脉冲时得到的最大荧光;为在暗适应下打开饱和脉冲时得到的最小荧光。
1.3.3 根的生长状况
培养42 d后, 记录新根的条数, 测量所有根的长度并计算所有根的平均长度。
1.3.4 叶绿素测量
培养42 d后, 选取标记的植株测量叶绿素含量, 重复三次。叶绿素含量测定参考《植物生理生化实验原理与技术》。
1.3.5 统计分析
应用SPSS 19.0对实验数据进行统计分析, 应用Origin 8.0作图。
2 结果
2.1 叶片的生长速率
叶片的生长速率结果如图2所示, T1组加入固氮菌剂2 g, 植株的生长速率为0.88 cm·d-1, T2组加入混合固氮溶磷菌剂2 g的植株生长速率为0.69 cm·d-1, 对照组的植株生长速率为0.61 cm·d-1。选用单因素方差分析, 方差齐性检验为=0.111>0.05, 方差齐。LSD法两两比较结果为T1组与CK组存在显著差异; T2组与CK组也存在显著差异, 且T2组对泰来草的促生长作用效果最好。T1组与T2组之间差异不显著。结果表明, 加入2 g固氮菌剂对泰来草叶子的生长具有显著促进作用, 而加入混合菌剂对泰来草叶子的生长影响不显著, 但和对照组相比, 叶子生长速率快13.1%。
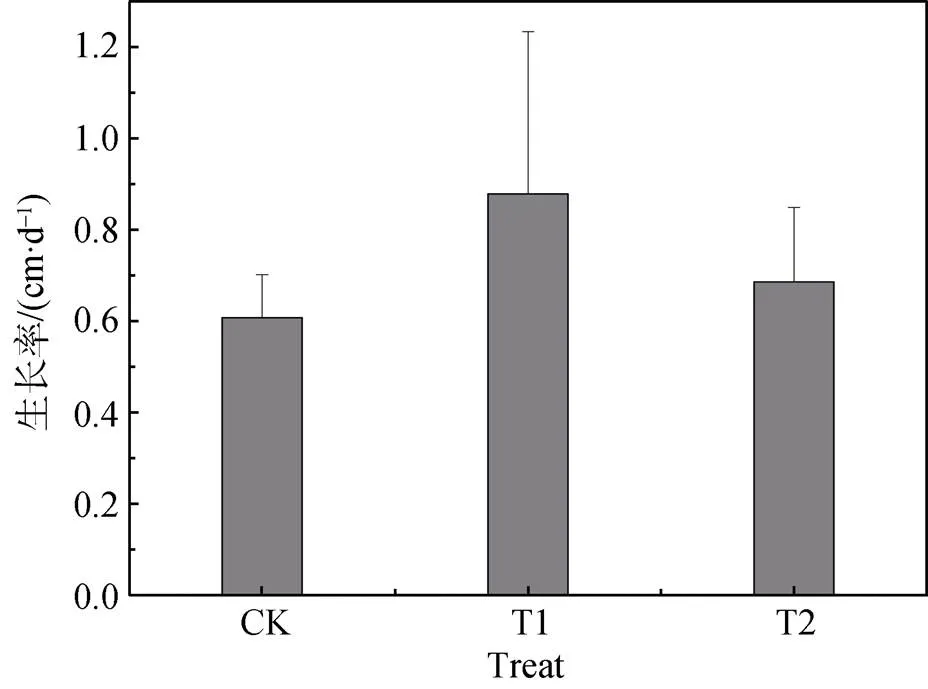
注:CK为对照组; T1加入2 g固氮菌剂组; T2加入2 g混合菌剂组(1 g固氮菌剂, 1 g溶磷菌剂)。
Figure 2 Growth rate (GR) ofunder different treatments
2.2 光合作用强度
光合作用强度由最大光量子产率表示,/= (–F) /,为在暗适应下打开饱和脉冲时得到的最大荧光产量, F为打开饱和脉冲前的初始荧光产量,/反映了植物潜在最大光合能力。/结果如图3所示,协方差分析结果显示方差不齐, 因此用非参数检验(个相关样本检测)得到秩均值, T22.72>T12.00>CK 1.28, 三者之间=0.000< 0.05, 存在显著性差异。处理组T1表示加入固氮菌剂、处理组T2表示加入混合菌剂、CK表示对照组。结果表明, 加入混合菌剂后对泰来草叶片的光合作用有显著的增强作用, 单独加入固氮菌剂和对照组相比也显著增强了泰来草的光合作用。
2.3 根的生长情况
各实验组和对照组加入菌剂对泰来草根的影响如表1所示, 加入菌剂42 d后, T2组的新根数量明显比CK组和T1组的多; T1组(单独加入固氮菌)新根数量最少。所有根的平均长度是CK组的最长, T1组的最短。

注:CK为对照组; T1加入2 g固氮菌剂组; T2加入2 g混合菌剂组(1 g固氮菌剂, 1 g溶磷菌剂)。
Figure 3 Photosynthetic quantum yield ofunder different treatments

表1 泰来草根的生长情况
注:CK为对照组; T1加入2 g固氮菌剂组; T2加入2 g混合菌剂组(1 g固氮菌剂, 1 g溶磷菌剂)
2.4 泰来草叶绿素含量
叶绿素的含量和光合作用速率的结果如图4所示, 加入混合菌剂后, 泰来草的叶绿素a浓度、叶绿素b浓度、总叶绿素浓度比对照组高24.58%、24.95%、24.64%, 但略低于加入固氮菌剂组。加入固氮菌剂组叶绿素a、叶绿素b、总叶绿素浓度比对照组分别提高39.75%、39.46%、39.67%, 说明固氮菌的添加能够促进植株叶片叶绿素含量的积累。
3 讨论
3.1 海洋微生物菌剂对泰来草叶片的影响
实验表明, 单独加入固氮菌剂后, 泰来草叶片的叶绿素含量以及光合作用强度都显著增加, 也能促进新叶的生长, 延缓老叶的枯萎。氮是植物体内很多重要有机化合物的组分, 如蛋白质、核酸、叶绿素等。有研究表明, 随着植株的生长, 地上部分的氮素向上部转移, 叶片是积累氮素最多的植物器官, 达到整个植株积累氮素的60%以上[21]。植株下部叶片失绿变黄、叶脉间失绿或出现坏死斑点甚至早衰时, 通常是植物缺氮的表现, 因此植物缺氮最先表现在植株的叶片[22]。Barea[23]认为加入固氮菌改变了植物的生长和发育并显著增加了植株根叶的生长是由于植物生长调节剂的作用。Sudhakar[24]研究发现经过三种混合固氮菌添加后, 增加了植株叶片产量, 有潜力用于桑叶的叶面肥料生产。这些结果与本文实验结果类似, 通过固氮菌剂使体系中氮素含量增加, 从而促进植株叶片的生长以及叶绿素浓度的累积。也有研究结果表明, 根据乙炔还原法结果显示玉米根际固氮菌的固氮酶活性只与玉米根系有关[25]。本实验中加入固氮菌剂并未明显增加泰来草根际的生长, 相反根的长度和数量略少于对照组, 可能由于培养体系营养结构不全面, 导致海草根部生长缓慢。

注:CK为对照组; T1加入2 g固氮菌剂组; T2加入2 g混合菌剂组(1 g固氮菌剂, 1 g溶磷菌剂)
Figure 4 Chlorophyll content of Thalassia hemprichii under different treatments
3.2 海洋微生物菌剂对泰来草根的影响
磷素参与植物光合作用、呼吸作用、能力储存与转移、细胞分裂等生理生化过程, 也是植物体内核酸、蛋白质、磷脂以及ATP的重要组成元素, 是植物生长必须的营养元素。有研究表明, 磷缺乏在一定程度内不仅不会引起根部生长阻滞, 反而会显著促进植物小径级根部的生长, 以及根毛的密度和数量、根系分支量[26]。也有研究表明水稻在磷满足自身生长的情况下, 会促进水稻吸收微量元素硒[27]。
本研究实验表明添加海洋芽孢杆菌菌剂能够显著增加海草根的数量及长度, 也在一定程度增加海草的叶绿素a浓度、叶绿素b浓度以及总叶绿素浓度。海洋芽孢杆菌由于抗逆性能力强, 能够在营养环境恶劣的条件下定植在海草根际周围, 促进难溶性磷的降解, 从而为海草的生长提供磷元素。
3.3 海洋微生物菌剂对泰来草光合作用的影响
植物通过光合作用产生有机物和氧气, 是实现初级生产力固定的主要过程。作为植物生长需要的大量元素, 氮、磷在光合作用过程中至关重要。氮素供给量、氮在植物体内的同化速率和碳水化合物在植物体内的分配格局等均影响植物的初级生产力, 其中氮供给量是光合作用反应最敏感的条件之一; 同时, 当低磷成为限制植物生长的因素时, 植株的叶片大小、表面积、叶片的生长速率和数量、以及光合磷酸化过程就会受到影响, 从而光合作用被抑制[28]。氮磷通过影响光合过程中不同的产物, 从而影响光合作用。当氮满足植物需求而缺乏磷时, 光合作用受到影响, 因而碳固定量下降; 当磷充足而氮缺乏时, 光合作用速率急速下降, 碳固定量上升后迅速下降[29]。/(光化学效率), PS II的最大量子产量, 反映了植物的潜在最大光合能力, 在未受胁迫的条件下硅藻和甲藻/在0.65—0.7之间、高等植物在0.8—0.84之间[30-31]。本研究实验证明, 加入固氮菌剂后, 和对照组相比显著提高了泰来草的光合作用能力, 加入混合固氮溶磷菌剂效果更明显。这些结果可能是由于加入混合菌剂后提高了体系氮磷含量, 在氮磷元素的相互作用下促进了植株的光合作用。
[1] DUARTE C M, KENNEDY H MARBÀ N, et al. Assessing the capacity of seagrass meadows for carbon burial: current limitations and future strategies[J]. Ocean and coastal management, 2013, 83: 32–38.
[2] LARKUM A W D, ORTH R J, DUARTE C. Seagrasses: Biology, Ecology and Conservation[M]. Springer Netherlands, 2006, 691.
[3] WAYCOTT M , DUARTE C M , CARRUTHERS T J B , et al. Accelerating loss of seagrasses across the globe threatens coastal ecosystems[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(30): 12377–12381.
[4] LOTZE H K. Depletion, degradation, and recovery potential of estuaries and coastal seas[J]. Science, 2006, 312(5781): 1806–1809.
[5] WALKER D I, KENDRICK G A, MCCOMB A J. Decline and recovery of seagrass ecosystems—the dynamics of change[J]. Seagrasses Biology Ecology and Conservation, 2007: 551–565.
[6] HAUXWELL J, VALIELA I. Effects of nutrient loading on shallow seagrass-dominated coastal systems: patterns and processes[M]. Estuarine Nutrient Cycling: The Influence of Primary Producers, Springer, Netherlands, 2007.
[7] ALONGI D M, TROTT L A, UNDU M C, et al. Benthic microbial metabolism in seagrass meadows along a carbonate gradient in Sulawesi, Indonesia[J]. Aquatic Microbial Ecology, 2008, 51(2): 141–152.
[8] BURFORD M A, ROTHLISBERG P C, REVILL A T. Sources of nutrients driving production in the Gulf of Carpentaria, Australia: a shallow tropical shelf system[J]. Marine and Freshwater Research, 2009, 60(10): 1044– 1053.
[9] ALONGI D M. The role of bacteria in nutrient recycling in tropical mangrove and other coastal benthic ecosystems[M]. //Ecology and conservation of southeast Asian marine and freshwater environments including wetlands, Springer, Dordrecht, 1994.
[10] BUDIN J M. Nitrogen Fixation Associated with Eelgrass (Zostera Marina) Rhizosphere Systems[D]. Doctoral dissertation, State University of New York at Stony Brook, 1981.
[11] NIELSEN J T, LIESACK W, FINSTER K.sp. nov., a new sulfate reducer isolated from surface-sterilized roots of the seagrass Zostera marina[J]. International Journal of Systematic and Evolutionary Microbiology, 1999, 49(2): 859–865.
[12] MCCLUNG C R, PATRIQUIN D G. Isolation of a nitrogen-fixing Campylobacter species from the roots ofLoisel[J]. Canadian Journal of Microbiology, 1980, 26(8): 881–886.
[13] SMITH G W, KOZUCHI A M, HAYASAKA S S. Heavy metal sensitivity of seagrass rhizoplane and sediment bacteria[J]. Botanica Marina, 1982, 25(1): 19–24.
[14] GHOSH U, SUBHASHINI P, DILIPAN E, et al. Isolation and characterization of phosphate-solubilizing bacteria from seagrass rhizosphere soil[J]. Journal of Ocean University of China, 2012, 11(1): 86–92.
[15] 徐凤花, 孙冬梅, 宋金柱. 微生物制品技术及应用[M].化学工业出版社, 北京: 2007: 1–2.
[16] EGAMBERDIYEVA D. The effect of plant growth promoting bacteria on growth and nutrient uptake of maize in two different soils[J]. Applied Soil Ecology, 2007, 36(2/3): 184–189.
[17] 陶家法, 卢秋雁. 小麦, 玉米接种耐氨固氮菌试验初步分析[J]. 微生物学杂志, 1996(1): 23–25.
[18] SUAREZ C, CARDINALE M, RATERING S, et al. Plant growth-promoting effects of, on summer barley (, L.) under salt stress[J]. Applied Soil Ecology, 2015, 95: 23–30.
[19] KATHIRESAN K, SELVAM M M. Evaluation of beneficial bacteria from mangrove soil[J]. Botanica Marina, 2006, 49(1): 86–88.
[20] 张晓君. 红树林促生菌(PGPB)菌剂优化及应用技术研究[D]. 长沙: 中南林业科技大学, 2014.
[21] 王忠强, 吴良欢, 刘婷婷, 等. 供氮水平对爬山虎(Planch)生物量及养分分配的影响[J]. 生态学报, 2007, 27(8): 3435–3441.
[22] 郭建华, 赵春江, 王秀, 等. 作物氮素营养诊断方法的研究现状及进展[J]. 中国土壤与肥料, 2008(4): 10–14.
[23] BAREA J M, BROWN M E. Effects on plant growth produced byrelated to synthesis of plant growth regulating substances[J]. Journal of Applied Bacteriology, 1974, 37(4): 583.
[24] SUDHAKAR P, CHATTOPADHYAY G N, GANGWAR S K, et al. Effect of foliar application of Azotobacter, Azospirillum and Beijerinckia on leaf yield and quality, of mulberry ()[J]. The Journal of Agricultural Science, 2000, 134(2): 227–234.
[25] TOLEDO M M, GONZALEZ-LOPEZ J, DE LA RUBIA T, et al. Effect of inoculation with, on nitrogenase activity of, roots grown in agricultural soils under aseptic and non-sterile conditions[J]. Biology and Fertility of Soils, 1988, 6(2): 170–173.
[26] MA Z, BIELENBERG D G, BROWN K M, et al. Regulation of root hair density by phosphorus availability in[J]. Plant Cell and Environment, 2001, 24(4): 459–467.
[27] LIU W J, ZHU Y G, SMITH F A, et al. Do phosphorus nutrition and iron plaque alter arsenate (As) uptake by rice seedlings in hydroponic culture?[J]. New Phytologist, 2004, 162(2): 481–488.
[28] MOLLIER A, PELLERIN S. Maize root system growth and development as influenced by phosphorus deficiency[J]. Journal of Experimental Botany, 1999, 50(333): 487–497.
[29] 王琪, 徐程扬. 氮磷对植物光合作用及碳分配的影响[J]. 山东林业科技, 2005(5): 59–62.
[30]BRUNELMUGUET S, PELLERIN S, MOLLIER A. Impact of early growth traits on further genotypic performance during the vegetative growth of maize (L.) in response to phosphorus (P) availability[J]. Australian Journal of Crop Science, 2014, 8(3): 402–412.
[31] 秦红杰, 李敦海. 铜绿微囊藻高温胁迫后的超补偿生长[J]. 环境科学, 2010, 31(7): 1504–1509.
The growth-promoting effect of marine microbial agents in
LIN Liyun1,2, WANG Cong1,2, Ling Juan1,2,3, YANG Qingsong1,2,3, LIN Xiancheng1,2, ZHANG Ying1,2, PENG Qiuying1,2, ZHANG Yanying1,2,3, DONG Junde1,2,3,*
1. Key Laboratory of Tropical Marine Bio-resources and Ecology, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510260, China 2. University of Chinese Academy of Sciences, Beijing 100049, China 3. Tropical Marine Biological Research Station in Hainan, Chinese Academy of Sciences, Sanya 572000, China
At present, the seagrass meadow is under serious degradation status. Restoration of the seagrass ecosystem is an important task in marine ecological restoration.The marine microbial compound agents were developed by the bacterial strains of nitrogen fixation bacteriumand phosphate solubilizing bacterium, and they were isolated from the rhizosphere sediment of seagrassThe compound microbial agents of those two bacterials were used to study the growth-promoting effect on seagrassThe plant growth rate, leaf growth rate, chlorophyll content and maximum photoquantum yield (/) was measured.These results showed that the growth rate,/, and chlorophyll content of the leaves ofwas significantly promoted by the addition of nitrogen fixing bacterial agents. The chlorophyll a, chlorophyll b, and total chlorophyll concentrations were 39.75%, 39.46%, and 39.67% higher than the control group, respectively, and the growth rate of the leaves was 44.26% higher than that of the control group.The length and number of the roots,/and the growth rate of the leavesall significantly increased.This study showed that the addition of nitrogen-fixation bacterial agent intoculture tank could affect the leaf growth rate and photosynthesis rate of, but did not affect the growth of the root.The simultaneous addition of nitrogen fixation and phosphate solubilizing microorganisms compound agents promoted the growth and photosynthesis rate ofroots and leaves.
microbial agent; seagrass; growth-promoting; nitrogen fixation; phosphate solubilizing
10.14108/j.cnki.1008-8873.2020.06.001
S157.2
A
1008-8873(2020)06-001-06
2019-10-20;
2019-11-20
中国科学院战略性先导科技专项A (XDA13020300); 广东省海洋牧场规划、建设与管理工程技术研究 (GML2019ZD0402); 国家自然科学基金(41676163, 41406191); 国家重点研发计划(2017YFC0506301, 2018YFC1406500); 广州市珠江科技新星(201806010017); 广东省科技计划项目( 2017B030314052)
林丽云(1982—), 女,博士研究生,E-mail: leayun_lin@126.com
董俊德, 男, 中国科学院南海海洋研究所, 博士, 教授, 博士生导师, 主要研究方向为微生物生态学, E-mail: dongjunde@vip.163.com
林丽云, 王聪, 凌娟, 等.功能微生物菌剂对泰来草生长的促生效应研究[J]. 生态科学, 2020, 39(6): 1–6.
LIN Liyun, WANG Cong, Ling Juan, et al. The growth-promoting effect of marine microbial agents in[J]. Ecological Science, 2020, 39(6): 1–6.
