本土和外来湿地植物土壤微生物生物量对水、盐胁迫的响应
2021-01-04解丽娜李亚雷李诗华谭立山葛振鸣
解丽娜, 李亚雷, 李诗华, 谭立山, 葛振鸣,2,*
本土和外来湿地植物土壤微生物生物量对水、盐胁迫的响应
解丽娜1, 李亚雷1, 李诗华1, 谭立山1, 葛振鸣1,2,*
1. 华东师范大学河口海岸学国家重点实验室崇明生态研究院, 上海 200241 2. 长江三角洲河口湿地生态系统观测研究站, 上海 202162
研究对比了淹水和盐度升高对长江口滨海湿地本土植物芦苇()和入侵植物互花米草()土壤微生物生物量(生物量碳-MBC、生物量氮-MBN)及其占土壤有机碳(SOC)和总氮(TN)比例的影响。淹水条件下芦苇土壤MBC、MBN、MBC/SOC和MBN/TN显著降低(分别为26.0、46.7、16.5和42.2%)。而淹水条件下互花米草土壤微生物生物量指标变化均不显著。随盐度升高, 芦苇土壤除MBC/SOC外, MBC、MBN和MBN/TN均显著降低(分别为26.4、36.2和30.2%), 而互花米草土壤微生物生物量指标降低程度相对较低。淹水+盐度处理加剧了盐度对两种植物土壤微生物生物量指标的影响。然而, 互花米草土壤微生物与土壤营养因子对水、盐变化的敏感性较低。因此, 在未来海平面上升条件下, 入侵种互花米草与本土种芦苇相比土壤微生物群落更能适应淹水延长和盐水入侵等环境变化, 而且互花米草入侵可能将进一步加剧。
微生物生物量碳; 微生物生物量氮; 滨海湿地; 水文胁迫; 入侵植物
0 前言
滨海湿地是生态服务功能最高的生态系统之一[1]。然而政府间气候变化委员会(IPCC)第五次报告显示, 由于气候变化到2100年全球海平面上升的平均水平将达到440—740 mm[2]。海平面上升引起的潮汐洪水和海水入侵成为对滨海湿地生态系统的重要威胁[3,4]。
土壤微生物是对气候、水文和土壤环境条件变化较为敏感的指标, 虽然土壤微生物仅占土壤有机质的一小部分, 但在凋落物分解、养分循环和能量流动中起着关键作用[5]。已有研究表明, 由于淹水条件下土壤供氧和养分有效性受限, 会影响微生物的生长代谢和养分运送等功能的发挥, 进而降低了土壤微生物生物量[6]。盐度增加会通过改变土壤渗透势对微生物产生胁迫[7]。此外, 水、盐胁迫还通过影响植物生长的方式改变植物根际环境, 以此影响土壤微生物生物量[7-8]。
芦苇()是我国海岸线最典型的原生盐沼植被。然而在上世纪70-80年代互花米草()由北美被引入后, 对本土植被形成了竞争优势并迅速扩散并成为我国海岸带的“优势种”, 显著改变了入侵地的植物群落组成和结构[9]。当海岸带气候与环境条件发生变化, 外来植物可能会通过改变土壤微生物环境等途径减少环境胁迫的限制, 维持其入侵进程[10]。在未来海平面上升条件下, 淹水延长和海水入侵等多种水文环境变化可能以更复杂的方式共同作用于滨海湿地的植物-土壤系统。目前, 国内外学者对淹水或盐度单因素胁迫下土壤微生物的研究不断深入[6-8, 11], 但对淹水和盐度协同作用涉及较少[12], 尤其是对滨海湿地本土和入侵植被群落土壤微生物对水、盐环境变化的响应差异研究有待开展。
本研究针对我国滨海盐沼湿地典型的本土物种芦苇和入侵种互花米草, 比较了两种植被土壤微生物生物量及其在土壤养分中的比例对水、盐条件的响应, 为了解生物入侵和未来海平面上升情景下滨海湿地土壤微生物变化和有机质转化过程提供科学依据。
1 材料与方法
1.1 实验设计
本研究所使用的植物-土壤系统采集于长江口崇明东滩湿地(31°25′—31°38′ N, 121°50′—122°05′ E)。该区域属东亚季风气候, 年均气温为15.3 ℃, 年平均降雨量为1022 mm, 属于非正规浅海半日潮滩, 多年最大潮差和年均潮差分别为4.62-5.95 m和1.96—3.08 m[13]。在互花米草引入前, 长江口滨海湿地植被主要以芦苇()和海三棱藨草()等为主。互花米草快速扩张后目前其分布面积已占长江口滨海湿地植被总面积的40%[14], 极大地改变了区域植被分布格局。
2015年12月底(冬季)在崇明东滩湿地选择了芦苇和互花米草共生潮滩采集植物-土壤系统, 两种植物采样点土壤条件相似并位于同一潮位线, 植被长势和密度较均一。去除冬季已枯萎的地上植物体后完整地挖取两种植物的无性繁殖体(根系)和土壤。采样过程中确保土壤和植物根系的完整性(尺寸为32 cm×24 cm×40 cm), 立刻移置于相同体积的聚乙烯培养箱内, 运至具有自然光照和温度条件的通风透明塑料大棚内培养。
在植物-土壤系统采集后第一个月(2016年1月)通过多次淡水浇灌对土壤盐度进行均一化处理。每个培养箱底部安装带阀门的软管, 以便排水。淡水冲洗完成静置一个月(2016年2月)作为恢复期。2016年3月上旬(春季)植物开始发芽时, 使用相同浓度的Hoagland营养液施肥一次, 随后进行水、盐实验处理[15]。每种植物-土壤系统设置2个水位梯度, 不淹水设置为培养箱50%的水位(空白), 淹水处理设置水位保持淹没土壤表层10—15 cm左右。每种植物-土壤系统设置4个NaCl盐度梯度(0 ppt、5 ppt、15 ppt和30 ppt盐度处理, 其中0 ppt为对照组)。通过单因子和双因子交互处理, 两种植物-土壤系统总共设置8个处理(2个淹水处理× 4个盐度处理), 每个处理设置3个重复。培养箱内的水每两周更新一次, 在非换水期间使用淡水维持水位和土壤表面湿润。所有处理持续至植被生长末期(2016年10月)。
1.2 样品采集与指标测定
于生长季末期(10月), 使用直径5 cm的钢制采土器采集不同水、盐处理下的植株与土壤样品(0—30 cm)各5管, 土壤样品混合均匀后过0.6 mm筛, 以去除植物根系、石块等杂物, 部分新鲜土壤保存于4 ℃冰箱中, 用于测定土壤微生物生物量。剩余样品自然风干磨碎后过0.25 mm筛用以测定土壤理化指标。同时, 过筛的土壤样品再次过0.15 mm网目筛, 收集植物地上部分和所有根系, 清洗干净后在60℃下烘干至恒重, 称重并记录植物生物量。
采用氯仿熏蒸-硫酸钾浸提法分析不同水、盐处理下土壤微生物生物量碳(MBC)、氮(MBN)含量差异, 方法见[16]。测定前将土样适当风干, 以手感湿润疏松但不结块为宜(约为饱和持水量的40%), 在风干过程中适当混匀, 防止边缘土壤风干微生物死亡。用蒸馏水调节土壤湿度至饱和持水量的40%。为消除采样等行为对土壤微生物的影响进行预培养以消除干扰, 将调节好土壤含水量的土壤置于密闭的塑料箱(为保证其气密性, 在箱口用保鲜膜加固密封)内培养7—15 d, 箱内放置两杯200 mL的蒸馏水, 一杯200 ml 1 mol·L-1NaOH溶液吸收土壤呼吸产生的CO2, 在恒温培养箱内25 ℃培养。随后采用硫酸亚铁滴定法测定MBC含量, 其熏蒸提取法转换系数为0.38。采用茚三酮比色法测定MBN含量, 其熏蒸提取法转换系数为0.45。
土壤基础理化指标测定主要包括, 电导率(EC)、有机碳(SOC)、总氮(TN)、碱解氮(AN)、速效磷(AP)和氧化还原电位(ORP)6项指标。土壤化学因子指标测定均采用标准测定方法[17]: SOC和TN测定, 用10%稀盐酸酸化24 h去除土样中无机碳, 再用超纯水(Gradient, Merck Millipore, 德国)多次冲洗去除残酸后烘干, 称取180—200 mg土样, 锡纸包样后用元素分析仪(Vario Macro, Elementar Analysensysteme GmbH, 德国)测定土壤SOC和TN含量; AN采用碱解扩散法测定; AP通过碳酸氢钠浸提-钼锑抗比色法测定; 土壤EC和ORP分别使用英国Delta-T WET土壤三参数速测仪和FJA-6型氧化还原电位去极化法自动测定仪原位测定。
1.3 数据处理
通过MBC、MBN测定进一步计算土壤微生物生物量碳氮比值(MBC/MBN)、土壤微生物生物量碳在有机碳中的比例(MBC/SOC), 以及土壤微生物生物量氮在总氮中的比例(MBN/TN)。采用独立样本T检验分析变量在淹水和未淹水处理(相同盐度水平下)间的差异, 采用单因素方差分析(One-way ANOVA)检验变量在不同盐度处理(相同水分处理下)间的差异显著性。采用双因素方差分析(Two-way ANOVA)和最小显著性差异法(Least significant difference, LSD)多重比较检验淹水和盐度对土壤微生物生物量及其在土壤养分中的比例的主效应和交互影响。实验数据满足正态分布检验(Kolmogorov- Smirnov test)和方差齐性检验(Levene’s test)。以上分析使用 SPSS 19.0 (SPSS, Inc, Chicago, IL, USA)完成。采用冗余分析(RDA, Redundancy analyses)检验环境变量与土壤微生物指标间的相关性, 分析软件为Canoco 4.5 (Microcomputer Power, Ithaca, NY, USA)。
2 结果
2.1 植物生长与土壤因子变化
在相同盐度下, 淹水处理显著(< 0.05)降低了芦苇的地上生物量(6.7%)与地下生物量(13.0%), 互花米草生物量分别降低了2.4%和11.2%(图1)。不考虑淹水处理, 芦苇地上生物量和地下生物量在5、15、30 ppt盐度处理下相比对照组(0 ppt)分别降低了38.0%—93.2%和13.3%—37.2%(< 0.05), 而互花米草降低程度相对较低, 分别为10.4%—25.4%和9.4%—27.4%。淹水及盐度处理下两种植物的土壤因子变化见表1。
2.2 土壤微生物生物量对水、盐环境变化的响应
不考虑盐度梯度, 淹水处理显著(< 0.05)降低了芦苇土壤MBC、MBN含量, 平均为26.0%和46.7%, 而互花米草土壤仅平均降低了7.8%和7.4%(图2a 和2d)。在同一水位下, 5、15、30 ppt盐度处理相比对照组降低了芦苇土壤MBC和MBN含量, 分别为3.4%—49.2%和16.0%—56.4%。互花米草土壤MBC、MBN含量随盐度变化下降程度相对较低, 分别降低了0.9%—36.5%和5.7%—42.0%。相比于未淹水+0 ppt处理, 互花米草土壤MBC、MBN含量在淹水处理+盐度升高处理下的降低程度(11.6%—37.3%、11.3%—46.3%)低于芦苇土壤(31.2%—66.7%、53.4%—79.4%)。两种植物土壤MBC、MBN含量最低值均出现在淹水+高盐度(30 ppt)处理下。方差分析结果显示, 淹水和盐度处理均对芦苇土壤MBC、MBN含量影响显著(< 0.05, 表2), 互花米草土壤MBC、MBN含量仅受盐度变化显著影响(< 0.05)。淹水盐度交互作用显著(< 0.05)影响芦苇土壤MBN含量, 但对两种植物土壤MBC含量的影响不显著。
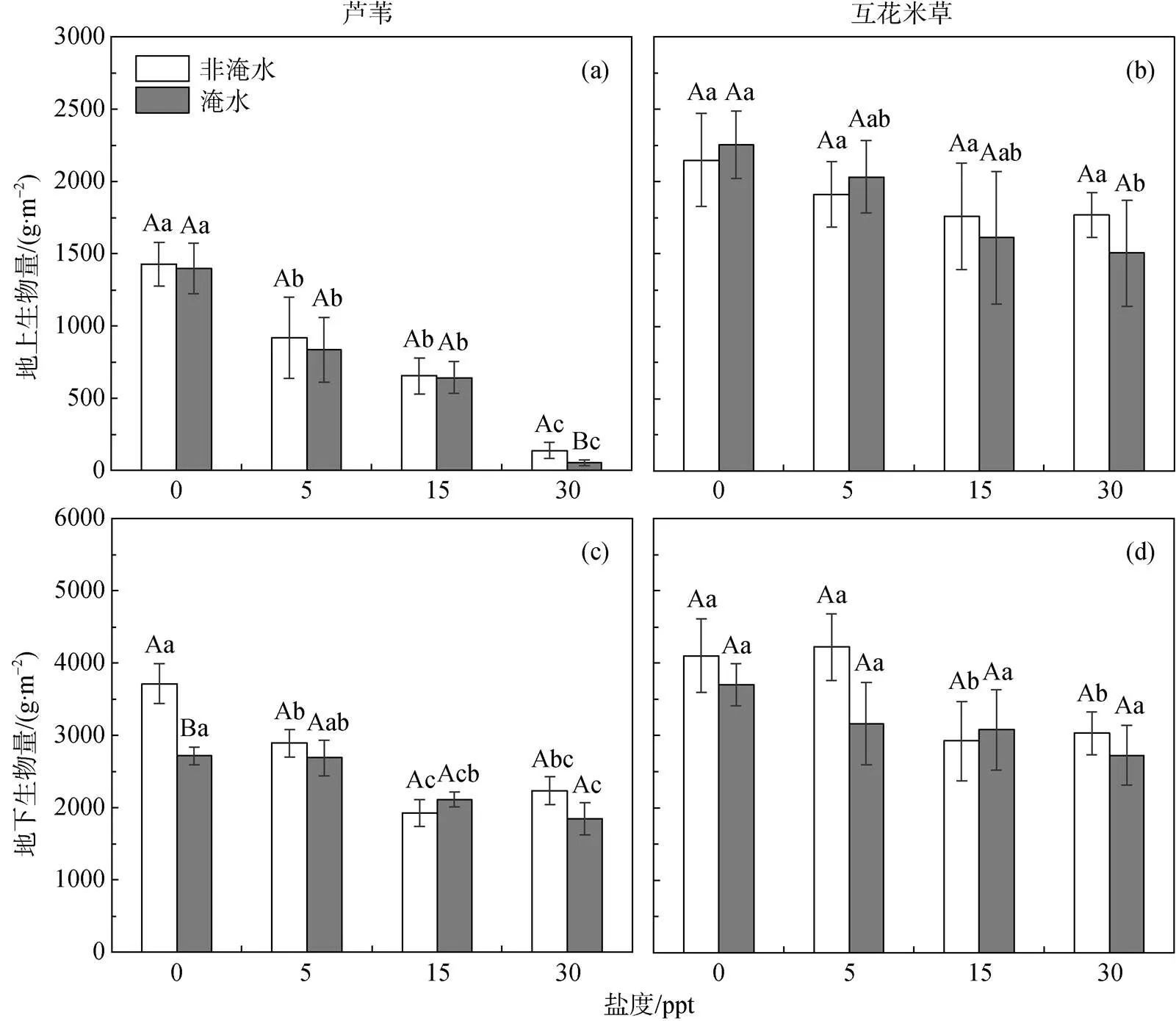
注: 不同大写字母表示变量在淹水与未淹水处理间(同一盐度水平)差异性达到显著性水平(P < 0.05); 不同小写字母表示变量在不同盐度水平下的差异性达到显著性水平(P < 0.05)。
Figure 1 Changes in above-ground biomass and below-ground biomass of theandunder the waterlogging and salinity treatments

表1 淹水和盐度升高条件下芦苇、互花米草土壤参数的变化(Mean±SE)
注: 不同字母表示变量差异性达到显著性水平(< 0.05)。
在同一盐度下, 淹水处理显著(< 0.05, 40.3%)增加了芦苇土壤MBC/MBN(图2e)。而互花米草土壤MBC/MBN几乎不受淹水处理的影响(图2f)。不考虑淹水处理, 5、15、30 ppt盐度相对于对照组平均增加了芦苇土壤MBC/MBN为11.2%、15.3%和16.6%, 而互花米草土壤分别提高了4.7%、13.7%和10.9%。两种植物土壤MBC/MBN最高值均出现在淹水+高盐度(30 ppt)处理下。方差分析结果显示, 淹水处理仅对芦苇土壤MBC/MBN产生显著影响(< 0.05, 表2), 盐度处理和淹水×盐度交互处理对两种植物土壤MBC/MBN的影响均不显著。

注: 不同大写字母表示变量在淹水与未淹水处理间(同一盐度水平)差异性达到显著性水平(P < 0.05); 不同小写字母表示变量在不同盐度水平下的差异性达到显著性水平(P < 0.05)。
Figure 2 Changes in soil microbial biomass C (MBC), microbial biomass N (MBN) and MBC/MBN in theandsoils under the waterlogging and salinity treatments
2.3 微生物生物量占土壤养分比例对水、盐环境变化的响应
不考虑盐度, 淹水处理显著(< 0.05)减少了芦苇土壤MBC/SOC(平均16.5%), 而对互花米草土壤MBC/SOC影响相对较小(平均减少9.1%)(图3a和2b)。在同一水文下, 随着盐度增加, 芦苇和互花米草土壤MBC/SOC分别平均降低了10.3%和14.2%。相比于未淹水+0 ppt处理, 芦苇土壤MBC/SOC在淹水+盐度升高处理下降低了19.9%—36.7%, 而互花米草土壤MBC/SOC降低程度较低(13.6%—23.3%)。方差分析显示, 淹水处理仅对芦苇土壤MBC/SOC有显著影响(< 0.05, 表2),盐度处理和淹水×盐度交互作用对两种植被土壤MBC/SOC的影响均达到显著性水平。
在同一盐度下, 淹水处理显著降低了芦苇土壤MBN/TN(平均42.15%), 而对互花米草土壤MBN/ TN影响较小(平均减少9.8%)(图3c和3d)。不考虑淹水处理, 5、15、30 ppt盐度处理下芦苇土壤MBN/ TN相对于与0 ppt分别降低了13.7%、28.5%和48.4%, 互花米草受影响相对较小, 分别降低了6.2%、24.1%、35.0%。相比于未淹水+0 ppt处理, 互花米草土壤MBN/TN在淹水+盐度升高处理下的下降程度(11.8%—38.3%)显著低于芦苇土壤(48.1%—70.2%)。芦苇和互花米草土壤MBN/TN最低值均出现在淹水+高盐度(30 ppt)处理下。方差分析显示, 淹水与盐度对芦苇和互花米草土壤MBN/TN均有显著影响(< 0.05, 表2), 而淹水×盐度仅对芦苇土壤MBN/TN有显著交互作用(< 0.05)。
2.4 微生物生物量与土壤因子的关系
RDA分析结果显示土壤微生物生物量特征与环境变量间关系的累积解释量为84.3%—98.5 %, 具有较好的代表性。根据图4和图5所示, 在未淹水和淹水两种处理下, 土壤盐度(EC)与芦苇和互花米草土壤MBC、MBN、MBC/SOC、MBN/TN呈负相关, 与MBC/MBN呈正相关关系,但相关性相对较弱。芦苇和互花米草土壤SOC、TN、C/N、AN、AP等养分指标、土壤氧化还原状态以及地下生物量(Root)与MBC、MBN、MBC/SOC、MBN/TN正相关, 与MBC/MBN负相关或相关性较弱。芦苇土壤微生物生物量特征在未淹水条件下主要受土壤SOC和植物根系生长影响, 淹水处理后土壤氮磷养分(TN、AP)和氧化还原状态(ORP)对芦苇土壤微生物生物量特征的影响增强。互花米草未淹水条件下土壤微生物生物量特征的变化主要由土壤氧化还原状态和根系解释, 淹水处理后植物根系对微生物生物量碳、氮及其占土壤养分比例的影响减弱。两种植物根系与MBC/MBN的相关性在未淹水处理下较小, 淹水处理后二者相关性增大。芦苇土壤养分和根系特征值箭头长于互花米草箭头, 表示芦苇微生物生物量指标与与土壤养分和植物地下生物量的相关性较大。此外, RDA排序图也反映出植物地下生物量与土壤养分指标呈正相关关系, 土壤EC和土壤养分指标与植物地下生物量呈负相关关系。
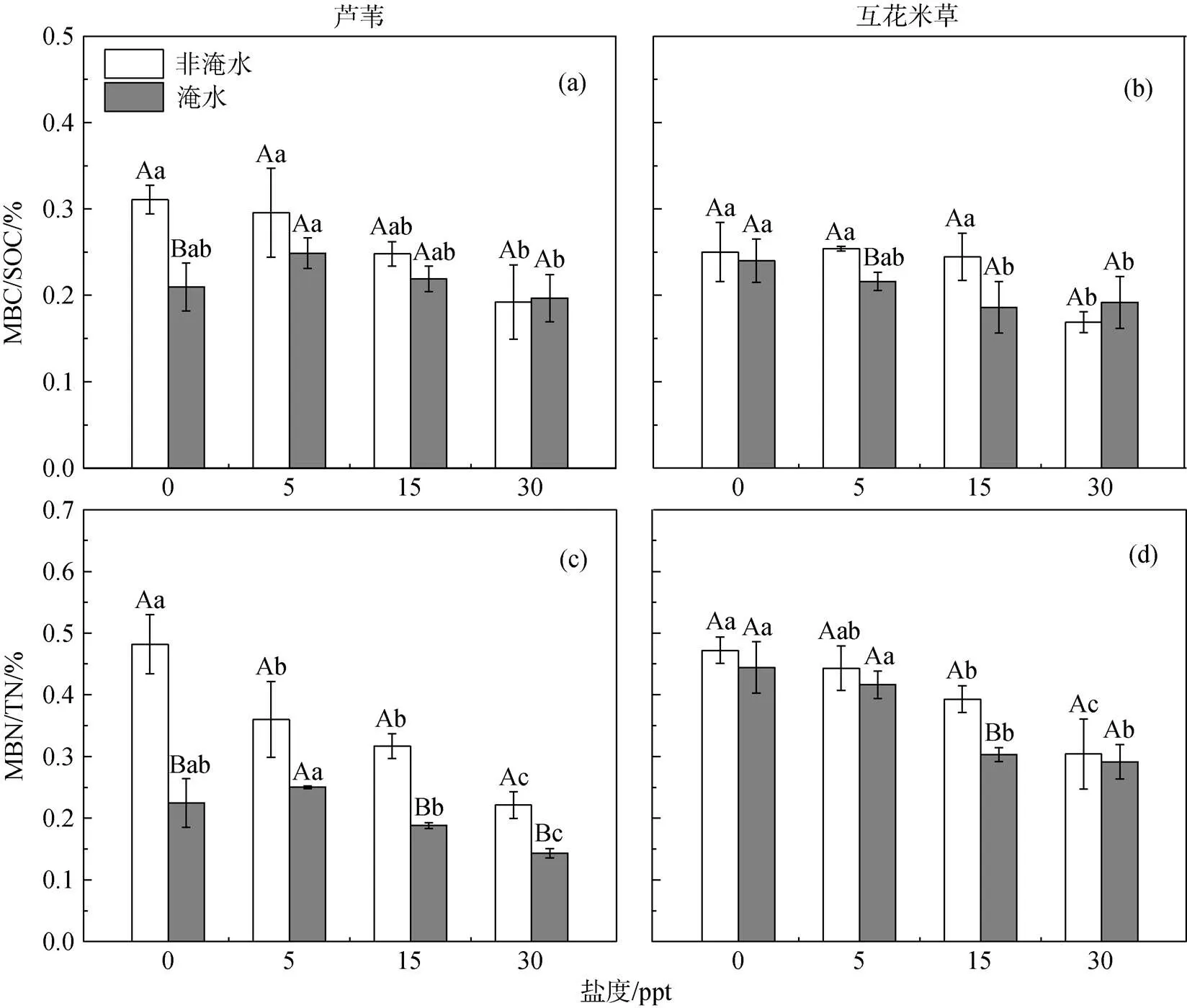
图3 芦苇与互花米草土壤MBC和MBN占土壤有机碳(SOC)与总氮(TN)比例对水、盐处理的响应(Mean±SE)
Figure 3 Changes in MBC/SOC and MBN/TN in theandsoils under the waterlogging and salinity treatments
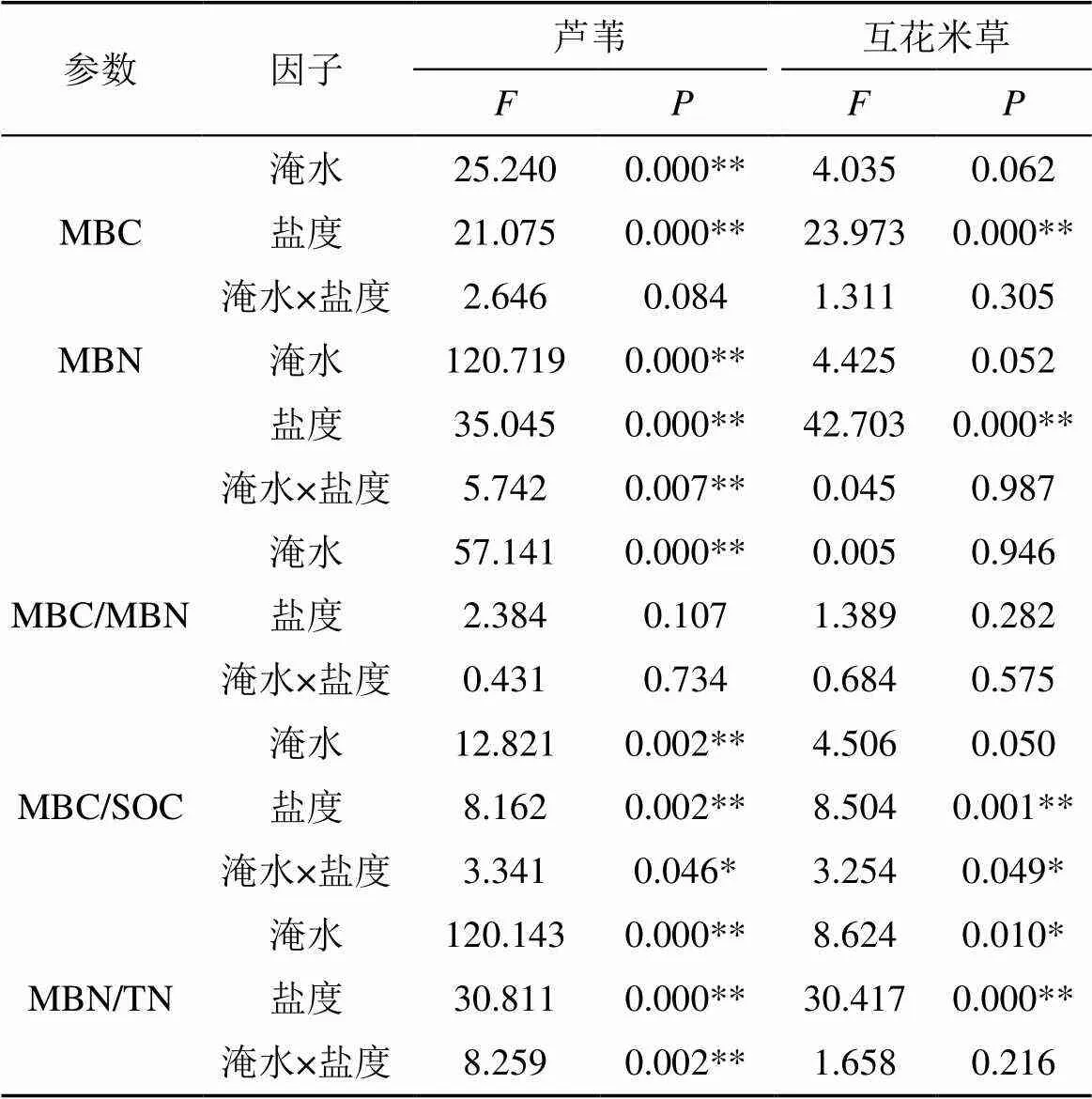
表2 水盐因子对芦苇与互花米草土壤微生物指标的主效应与交互作用分析
3 讨论
3.1 淹水对土壤微生物生物量的影响
本研究发现淹水处理显著降低了芦苇土壤MBC、MBN含量。淹水条件下土壤微生物受到氧气有效性的限制, 这可能减缓有机质的分解速率, 使土壤中微生物可利用养分减少[18]。此外, 低氧环境不利于植物生长, 植物根系生物量和分泌物减少, 进而减少了微生物可利用碳、氮源[7]。RDA分析结果说明土壤养分条件与植物地下生物量是抑制淹水环境中芦苇微生物生物量的主要环境因子。与芦苇相比, 互花米草土壤MBC、MBN没有受到淹水处理的显著影响。这是由于互花米草生长对淹水环境有较好的耐受性, 在淹水条件下仍能保持较高的地下生物量。在根系丰富的土壤中, 微生物可利用养分有效性高, 有利于微生物活性[7]。Tercero等[8]发现土壤养分降低以及较低的ORP会破坏土壤微生物正常的生理代谢, 导致土壤微生物生物量快速下降。虽然两种植被土壤ORP在淹水处理后均下降, 但互花米草土壤较高的土壤养分水平缓解了缺氧环境对微生物的破坏。本研究结果显示, 淹水显著提高了芦苇土壤MBC/MBN, 但对互花米草土壤MBC/ MBN没有显著影响。土壤MBC/MBN与微生物群落的结构和状态有关[19], 也与养分元素的有效性有关[20]。淹水处理对两种植被土壤MBC/MBN影响的差异性可能与土壤中微生物群落结构和状态变化不同有关, 也有可能由于淹水后芦苇土壤MBN较MBC下降幅度更大。
土壤MBC/SOC和MBN/TN比值越大意味着维持相同数量的微生物所需的能量越少, 从而表明土壤微生物生长需要更高质量的土壤有机质[21]。淹水处理下芦苇土壤MBC/SOC、MBN/TN较互花米草土壤随淹水降低程度更高。可以推断出芦苇土壤微生物对淹水的反应可能是将更多的有机养分引导到能量代谢中, 较少养分利用得以维持生物量。而淹水处理下互花米草土壤有机质含量仍较高, 因此MBC/SOC和MBN/TN受影响程度较低。
3.2 盐度对土壤微生物生物量的影响
盐度升高显著降低了芦苇与互花米草土壤MBC、MBN含量。高盐度会对土壤微生物产生渗透胁迫和离子胁迫, 减少微生物数量并抑制微生物活性, 进而对土壤中活性养分状态和周转产生不利影响[22]。此外, 芦苇和互花米草土壤盐度与SOC、TN、SOC/TN、AN、AP和植物地下生物量负相关。盐度升高会导致植物生长(生物量)下降, 从而减少了土壤有机质的输入, 微生物可利用的营养底物也随之减少[23]。比较两种植被土壤微生物生物量对盐度升高的响应差异发现, 互花米草土壤MBC、MBN含量随盐度升高而减少的幅度明显小于芦苇。这说明互花米草土壤微生物对盐分胁迫的耐受性要强于本土物种芦苇。之前的研究发现, 互花米草相比于芦苇在盐分胁迫下表现出更强的种间竞争能力[15], 这主要是由于互花米草具有盐腺, 可以通过泌盐降低植物体内与植物根系周围土壤的盐浓度[24]。较高的植物生长特别是地下生物量能够调节土壤环境来抵御环境压力[7]。盐度升高增加了芦苇和互花米草土壤MBC/MBN, 但未达到显著性水平。两种植被土壤MBC/MBN随盐度的变化也可能与植物和土壤微生物对土壤可利用氮的竞争有关[25], 植物根系对氮素的吸收会抑制土壤微生物氮获取, 进而影响MBN合成。
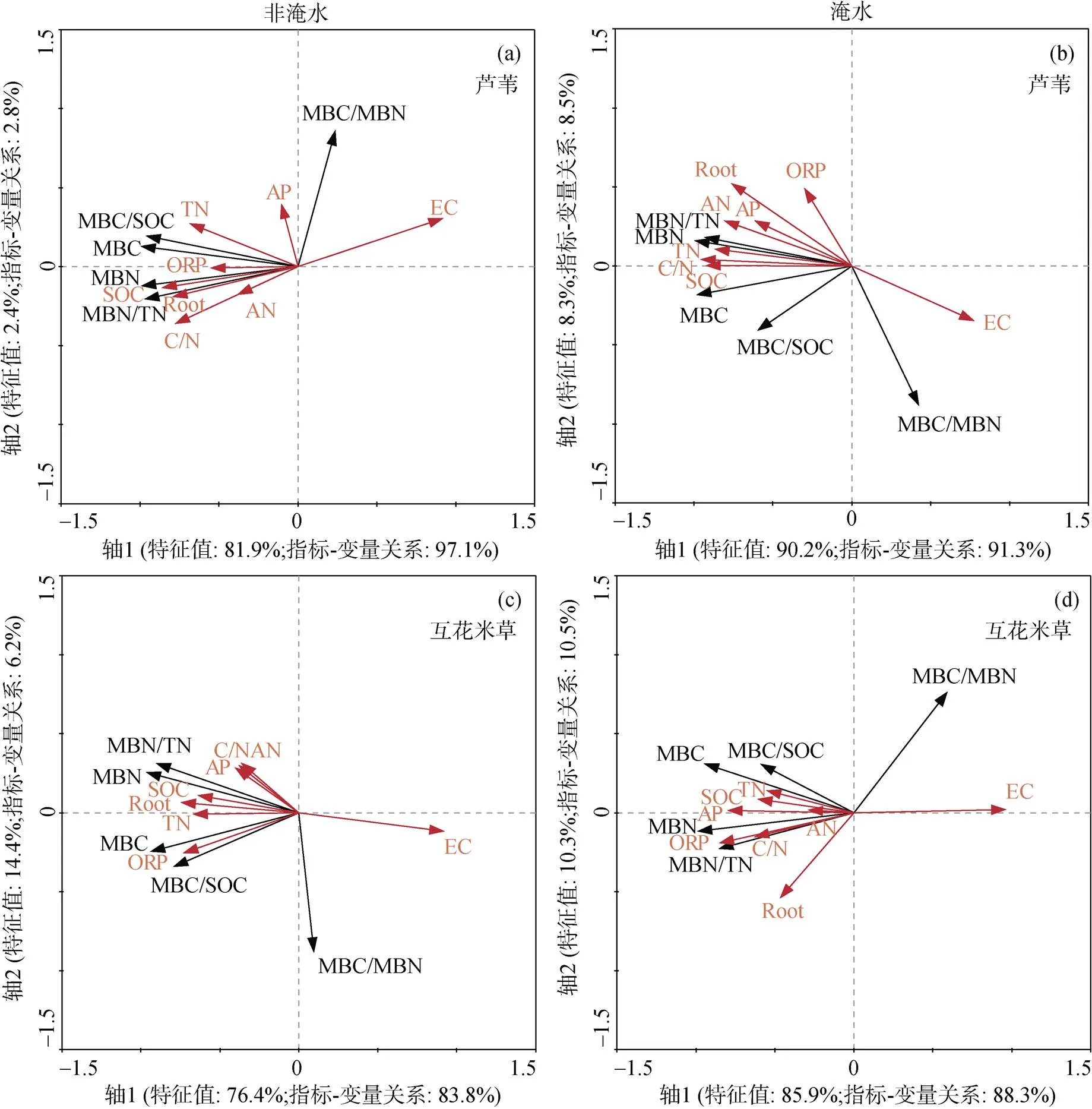
图4 芦苇和互花米草土壤微生物指标与土壤因子(包括根系生物量Root)相关性的RDA排序
Figure 4 Relationships between soil microbial characteristics and the soil variables from redundancy analysis (RDA) for theandsoils.
高盐度影响下土壤微生物生物量占养分的比例(MBC/SOC、MBN/TN)变化与有机质形成和惰性有机质转化为活性有机质的效率有关[23]。在高盐度影响下, 芦苇和互花米草土壤微生物生物量占土壤养分的比例显著降低(除互花米草土壤MBN/TN)。这可能是由于在高盐度下, 微生物生长受到限制, 导致微生物群落结构发生变化[26]。还有研究发现盐分诱导的细菌优势可能会抑制盐渍土中复杂有机物的分解[27], 进而降低微生物生物量。土壤微生物生物量在土壤养分中的比例随盐度升高而降低也反映了两种植被土壤有机质质量均有所降低。
3.3 水盐交互作用对土壤微生物生物量的影响
在淹水+高盐度处理下, 芦苇和互花米草土壤MBC、MBN含量最低, MBC/MBN最高。而芦苇和互花米草土壤微生物生物量占土壤养分的比例(除互花米草土壤MBN/TN)在高盐度的淹水条件下显著降低。盐度升高破坏了土壤团聚体稳定性并增强黏粒的分散性, 原本固定在团聚体中的养分被释放[28], 在淹水的作用下水溶性有机碳更容易溶解矿化[29], 因此淹水+高盐度交互作用可能使土壤结构性能和有机质质量退化。在整个生长季过程中, 随着水、盐处理的时间延长, 土壤中的有效养分不断减少, 并在淹水+高盐度处理下下降到最低值。此外, 淹水+高盐度共同胁迫下, 植物根系的生长和功能降低程度较单因子处理更高, 并影响根系细胞细胞膜的选择透过性, 进而限制了养分向土壤的输送[30], 抑制了土壤中的微生物生物量积累。与芦苇土壤微生物生物量相比, 淹水+盐度交互处理下的互花米草土壤微生物生物量及其占土壤养分比例下降程度明显较低, 而且方差分析结果显示仅MBC/SOC受到水盐交互作用的显著影响。这可能与互花米草对环境压力的适应性较高有关(见上述讨论), 而且其根系生长和土壤养分对淹水和盐度升高的敏感性较低, 这对于在水、盐协同压力下维持土壤微生物生物量相对稳定起到重要作用。
4 结论
本研究通过水、盐模拟实验, 对比了本土植物芦苇和入侵种互花米草土壤微生物生物量及其在土壤养分中比例对淹水与盐度胁迫的响应差异。研究结果发现, 淹水处理下芦苇土壤MBC、MBN、MBC/SOC和MBN/TN显著降低, 而MBC/MBN增加。互花米草土壤微生物生物量指标(除MBN/TN)变化不显著。随盐度增加, 芦苇和互花米草土壤MBC、MBN和MBN/TN均显著降低, 但互花米草土壤微生物生物量指标降低程度相对较低。淹水和盐度交互作用下两种植物土壤MBC、MBN、MBC/ SOC和MBN/TN(除互花米草土壤MBN/TN)均下降到最低值, 而MBC/MBN达到最高值。相对于芦苇, 互花米草土壤微生物对水、盐变化的敏感性较低, 这可能与互花米草对胁迫环境有更高的耐受性有关, 其地下生物量与土壤养分在淹水和盐度处理下仍保持相对稳定。因此, 在未来海平面持续上升条件下, 入侵种互花米草与本土种芦苇相比土壤微生物群落更能适应淹水延长和盐水入侵等环境变化, 而且互花米草入侵可能将进一步加剧。
[1] MILLENNIUM ECOSYSTEM ASSESSMENT. Ecosystems and human well-being: wetlands and water synthesis[M]. Washington DC: World Resources Institute, 2005.
[2] CHURCH J A, CLARK P U, CAZENAVE A, et al. Sea-level rise by 2100[J]. Science, 2013, 342(6165): 1445– 1445.
[3] GE Z M, WANG H, CAO H B, et al. Responses of eastern Chinese coastal salt marshes to sea-level rise combined with vegetative and sedimentary processes[J]. Scientific Reports, 2016, 6(1): 1–10.
[4] KIRWAN M L, MEGONIGAL J P. Tidal wetland stability in the face of human impacts and sea-level rise[J]. Nature, 2013, 504(7478): 53.
[5] SPEDDING T A, HAMEL C, MEHUYS G R, et al. Soil microbial dynamics in maize-growing soil under different tillage and residue management systems[J]. Soil Biology and Biochemistry, 2004, 36(3): 499–512.
[6] PORET-PETERSON A T, JI B, ENGELHAUPT E, et al. Soil microbial biomass along a hydrologic gradient in a subsiding coastal bottomland forest: Implications for future subsidence and sea-level rise[J]. Soil Biology and Biochemistry, 2007, 39(2): 641–645.
[7] BOYRAHMADI M, RAIESI F. Plant roots and species moderate the salinity effect on microbial respiration, biomass, and enzyme activities in a sandy clay soil[J]. Biology and Fertility of Soils, 2018, 54(4): 509–521.
[8] TERCERO M C, ÁLVAREZ-ROGEL J, CONESA H M, et al. Response of biogeochemical processes of the water-soil- plant system to experimental flooding-drying conditions in a eutrophic wetland: the role of[J]. Plant and Soil, 2015, 396(1/2): 109–125.
[9] 赵相健, 赵彩云, 柳晓燕, 等. 不同纬度地区互花米草生长形状及适应性研究[J]. 生态科学, 2015, 34(1): 119– 128.
[10] 郑洁, 刘金福, 吴则焰, 等. 闽江河口红树林土壤微生物群落对互花米草入侵的响应[J]. 生态学报, 2017, 37(21): 7293–7303.
[11] 李新, 焦燕, 杨铭德. 用磷脂脂肪酸(PLFA)谱图技术分析内蒙古河套灌区不同盐碱程度土壤微生物群落多样性[J]. 生态科学, 2014, 33(3): 448–494.
[12] CHAMBERS L G, GUEVARA R, BOYER J N, et al. Effects of salinity and inundation on microbial community structure and function in a mangrove peat soil[J]. Wetlands, 2016, 36(2): 361–371.
[13] GE Z M, GUO H Q, ZHAO B, et al. Spatiotemporal patterns of the gross primary production in the salt marshes with rapid community change: A coupled modeling approach[J].Ecological Modelling, 2016, 321: 110–120.
[14] LI X, REN L, LIU Y, et al. The impact of the change in vegetation structure on the ecological functions of salt marshes: the example of the Yangtze estuary[J]. Regional Environmental Change, 2014, 14(2): 623–632.
[15] LI S H, GE Z M, XIE L N, et al. Ecophysiological response of native and exotic salt marsh vegetation to waterlogging and salinity: implications for the effects of sea-level rise[J]. Scientific Reports, 2018, 8(1): 2441.
[16] VANCE E D, BROOKES P C, JENKINSON D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology and Biochemistry, 1987, 19(6): 703– 707.
[17] 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000.
[18] HAO R, LI Z, CHE Y. Differences in organic C mineralization between aerobic and submerged conditions in paddy soils of southern Jiangsu Province, China[J]. Agricultural Sciences in China, 2011, 10(9): 1410–1418.
[19] JENKINSON D S. Determination of microbial biomass carbon and nitrogen in soil[J]. Advances in Nitrogen Cycling, 1988: 368–386.
[20] DEBNATH S, PATRA A K, AHMED N, et al. Assessment of microbial biomass and enzyme activities in soil under temperate fruit crops in north western himalayan region[J].Journal of Soil Science and Plant Nutrition, 2015, 15(4): 848–866.
[21] WEN L, LEI P, XIANG W, et al. Soil microbial biomass carbon and nitrogen in pure and mixed stands ofanddiffering in stand age[J]. Forest Ecology and Management, 2014, 328: 150– 158.
[22] MAVI M S, MARSCHNER P. Salinity affects the response of soil microbial activity and biomass to addition of carbon and nitrogen[J].Soil Research, 2013, 51(1): 68–75.
[23] FIERER N, STRICKLAND M S, LIPTZIN D, et al. Global patterns in belowground communities[J]. Ecology Letters, 2009, 12(11): 1238–1249.
[24] BRADLEY P M, MORRIS J T. Relative importance of ion exclusion, secretion and accumulation inLoisel[J]. Journal of Experimental Botany, 1991, 42(12): 1525–1532.
[25]FRIEDEL J K, GABEL D, STAHR K. Nitrogen pools and turnover in arable soils under different durations of organic farming: II: Source-and-sink function of the soil microbial biomass or competition with growing plants?[J]. Journal of Plant Nutrition and Soil Science, 2001, 164(4): 421–429.
[26] RIETZ D N, HAYNES R J. Effects of irrigation-induced salinity and sodicity on soil microbial activity[J]. Soil Biology and Biochemistry, 2003, 35(6): 845–854.
[27] BADRAN R A. Cellulolytic activity of some cellulose- decomposing fungi in salinized soils[J]. Acta Mycologica, 1994, 29(2): 245–251.
[28] SHAINBERG I, LEVY G J. Physico-chemical effects of salts upon infiltration and water movement in soils[J]. Interacting Processes in Soil Science, 1992, 38.
[29] WANG F L, BETTANY J R. Influence of freeze-thaw and flooding on the loss of soluble organic carbon and carbon dioxide from soil[J]. Journal of Environmental Quality, 1993, 22(4): 709–714.
[30] BARRETT-LENNARD E G. The interaction between waterlogging and salinity in higher plants: causes, conesquences and implications[J]. Plant and Soil, 2003, 253(1): 35–54.
Responses of soil microbial biomass in the soils of native and exotic wetland plants to waterlogging and salinity
XIE Lina1, LI Yalei1, LI Shihua1, TAN Lishan1, GE Zhenming1,2,*
1. State Key Laboratory of Estuarine and Coastal Research, Institute of Eco-Chongming, East China Normal University, Shanghai 200241, China 2. Yangtze Delta Estuarine Wetland Ecosystem Observation and Research Station, Shanghai, 202162, China
In the soils of nativeand exotic(sampled from the coastal wetland in the Yangtze Estuary), the changes in microbial biomass carbon (MBC), microbial biomass nitrogen (MBN), MBC/MBN ratio and their proportion in soil organic carbon (SOC) and total nitrogen (TN) were investigated under waterlogging and increased salinity treatments. The results showed that the MBC, MBN, MBC/SOC, MBN/TN insoils under waterlogging treatment decreased significantly, by on average 26.0, 46.7, 16.5 and 42.2%, respectively, compared to non-waterlogging treatment. However, insoil, the indices of soil microbial biomass (expect for MBN/TN) did not exhibit notable changes under waterlogging treatment. With increasing salinity, MBC, MBN and MBN/TN significantly decreased in, by on average 26.4, 36.2 and 30.2%, respectively. Relative to, the decrease degree of the soil microbial indices mentioned above insoil was lower. There was no significant effect of salinity on MBC/MBN in soils of both two species. Under the combined waterlogging and increased salinity, the valley-values of MBC, MBN, MBC/SOC, and MBN/TN occurred, and the peak-values of MBC/MBN occurred in bothandsoils. Relative tosoil, the sensitivity of soil microbial biomass and nutrients insoil to waterlogging and increased salinity was lower. The probable reason was that the growth (root biomass) ofshowed a high tolerance to flooding and salinity stress, and the soil nutrient kept a relatively stable level. Compared to the native, the invadedin the coastal wetlands may stabilize the associated soil microbial characteristics under conditions of rising sea level and simultaneous saltwater intrusion, and the invasion ofmay be exacerbated.
soil microbial biomass carbon; soil microbial biomass nitrogen; coastal wetland; hydrological stresses; invasive plant
10.14108/j.cnki.1008-8873.2020.06.023
S157.2
A
1008-8873(2020)06-181-10
2019-12-03;
2019-12-28基金项目:国家自然科学基金(41871088, 41571083); 国家重点研发计划(2017YFC0506001, 2016YFE0133700); 上海市科委重大项目(19DZ2210200)
解丽娜, 女, 博士研究生, 研究方向为湿地生态学
葛振鸣, 男, 研究员, 博士生导师, 研究方向为湿地生态学, E-mail: zmge@sklec.ecnu.edu.cn
解丽娜, 李亚雷, 李诗华, 等. 本土和外来湿地植物土壤微生物生物量对水、盐胁迫的响应[J]. 生态科学, 2020, 39(6): 181–190.
XIE Lina, LI Yalei, LI Shihua, et al. Responses of soil microbial biomass in the soils of native and exotic wetland plants to waterlogging and salinity[J]. Ecological Science, 2020, 39(6): 181–190.
