急性胰腺炎患者血清可溶性Tim-3、炎症因子及RAAS分子检测的临床意义
2021-01-04陈曙蓓林影叶勇
陈曙蓓,林影,叶勇
(内江市第二人民医院 消化内科,四川 内江 641000)
急性胰腺炎(acute pancreatitis, AP)是常见的急腹症之一,具有起病急,病情进展迅速的特点[1]。AP起病初期无明显特异性体征,极易造成误诊或漏诊,如不积极治疗易加重为重症急性胰腺炎(severe acute pancreatitis, SAP),而SAP 死亡率高达15%~30%[2-3]。目前,AP 的机制尚未完全明确,AP 是一个由于胰酶异常激活的复杂性炎症过程,常伴有免疫失调,在疾病早期即可导致全身炎症反应综合征(systemic inflam-matory response syndrome, SIRS),如不早期干预,炎症反应会进一步加重,可并发感染,导致多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)[4-5]。AP 导致的SIRS 涉及多种炎症细胞和炎症因子,如中性粒细胞、单核巨噬细胞、白细胞介素6(Interleukin-6, IL-6)、白细胞介素10(Interleukin-10,IL-10)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等,部分肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system molecule, RAAS)分子也与AP 的发展密切相关,但目前尚无相关敏感性指标可以用于评估早期AP 疾病严重程度[6-10]。有研究表明可溶性Tim-3(s-Tim-3)可参与多种免疫细胞的免疫激活调节,其可能和胰腺早期的免疫激活存在相关性[11]。s-Tim-3 是T 细胞免疫球蛋白与黏蛋白,属于Tim 家族,已有研究证明,Tim 蛋白与多种疾病的发生、发展有关[12]。本研究通过探讨不同病情AP 患者血清s-Tim-3、炎症因子水平及RAAS 分子联合检测的临床意义,并对其相关性进行分析,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年1月—2019年1月内江市第二人民医院收治的AP 患者90例,均符合2013年《中国急性胰腺炎诊治指南》[13]的诊断标准。纳入标准:①存在腹痛等相关临床症状;②血清淀粉酶和/或脂肪酶比正常水平上限高≥3 倍;③患者及其家属知情均签署同意书。排除标准:①合并有自身免疫病者;②慢性AP 者;③合并有肿瘤或其他肝、肾功能不全者;④入院后1 天内死亡者。所有患者按急性生理与慢性健康状况评分Ⅱ(APACHE Ⅱ)系统[14]进行评分,并分为轻度AP 组(评分≤8 分)和中重度AP 组(评分>8 分),分别有39 和51例。轻度AP 组患者中男性21例,女性18例;年龄30 ~55 岁,平均(46.13±7.42)岁;病程0.5 ~45.0 h,平均(25.32±1.33)h。中重度AP 组患者中男性27例,女性24例;年 龄31 ~54 岁, 平 均(45.24±6.24) 岁;病 程1.0 ~40.0 h,平均(24.92±1.24)h。另选取同期于本院健康体检者50例作为对照组。其中,男性24例,女性26例;年龄30 ~56 岁,平均(45.64±7.32)岁。各组年龄,性别比较,差异无统计意义(P>0.05)。本研究已通过本院伦理委员会批准。
1.2 方法
AP 患者均于次日清晨空腹状态下行静脉采血5 ml,对照组于体检当日清晨行静脉采血5 ml,以3 000 r/min 离心5 min,离心半径10 cm,离心后留取上清,置于-60℃冰箱中保存备用,采用酶联免疫吸附法检测血清中炎症因子IL-6、IL-10、TNF-α、RASS 分子群体反应性抗体(panel reactive antibodies,PRA)、血管紧张素Ⅱ受体(Ang Ⅱ)、醛固酮(Aldosterone, ALD)及s-Tim-3 水平。试剂盒均购自上海恒远生物科技有限公司,操作严格按试剂盒说明进行。APACHE II 评分包括急性生理学评分(20 分)、年龄(6 分)及慢性健康状况评分(7 分),共计33 分。入院后对每位AP 患者进行评分。
1.3 统计学方法
数据分析采用SPSS 20.0 统计软件,计数资料以率(%)表示,比较用χ2检验;计量资料以均数±标准差(±s)表示,比较用方差分析,进一步的两两比较用LSD-t检验;相关性分析用Pearson 法,P<0.05 为差异有统计学意义。
2 结果
2.1 各组血清炎症因子表达水平比较
各组血清IL-6、IL-10 及TNF-α 表达水平比较,经方差分析,差异有统计学意义(P<0.05),中重度AP 组血清IL-6、TNF-α 表达水平较轻度AP 组高(P<0.05),IL-10 水平较轻度AP 组低(P<0.05),轻度AP 组较对照组高(P<0.05),对照组较中重度AP组低(P<0.05)。见表1。
2.2 各组血清RASS 分子表达水平比较
各组血清PRA、Ang Ⅱ及ALD 表达水平比较,经方差分析,差异有统计学意义(P<0.05),中重度AP 组较轻度AP 组高(P<0.05),轻度AP 组较对照组高(P<0.05),对照组较中重度AP 组低(P<0.05)。见表2。
2.3 各组血清s-Tim-3 表达水平比较
轻度AP 组血清s-Tim-3 表达水平为(511.25±45.32)pg/L,中重度AP 组为(943.14±63.13)pg/L,对照组为(110.17±14.52)pg/L,经方差分析,差异有统计学意义(F=34.233,P=0.000),中重度AP 组较对照组高(P<0.05),轻度AP 组较对照组高(P<0.05),中重度AP 组较轻度AP 组高(P<0.05)。
表1 各组血清炎症因子表达水平比较 (pg/L,±s)

表1 各组血清炎症因子表达水平比较 (pg/L,±s)
注:①与轻度AP 组比较,P <0.05;②与中重度AP 组比较,P <0.05。
组别 n IL-6 IL-10 TNF-α轻度AP 组 39 227.64±11.42 312.42±3.63 342.17±0.42中重度AP 组 51 519.14±7.41① 220.51±5.24① 733.52±0.13①对照组 50 19.45±4.83①② 15.73±1.53①② 10.07±0.02①②F 值 31.465 19.423 23.145 P 值 0.001 0.001 0.001
表2 各组血清RASS 分子表达水平比较 (pg/L,±s)

表2 各组血清RASS 分子表达水平比较 (pg/L,±s)
注:①与轻度AP 组比较,P <0.05;②与中重度AP 组比较,P <0.05。
组别 n PRA Ang Ⅱ ALD轻度AP 组 39 1.05±0.22 60.24±5.24 122.17±13.64中重度AP 组 51 3.24±0.13① 84.35±5.25① 262.52±24.13①对照组 50 0.07±0.02①② 25.73±1.53①② 67.07±10.02①②F 值 17.455 21.423 25.185 P 值 0.001 0.001 0.001
2.4 AP 患者血清炎症因子、RAAS 分子及s-Tim-3 水平与APACHE Ⅱ评分的相关性
Pearson 相关性分析显示,AP 患者血清IL-6、TNF-α、PRA、Ang Ⅱ、ALD 及s-Tim-3水平与APACHE Ⅱ评分呈正相关(P<0.05),IL-10 与APACHE Ⅱ评分呈负相关(P<0.05)。见表3。
2.5 AP 患者血清炎症因子、RAAS 分子与s-Tim-3 水平的相关性
Pearson 相关性分析显示,AP 患者血清IL-6、TNF-α、PRA、Ang Ⅱ及ALD 与s-Tim-3 水平呈正相关(P<0.05),IL-10 与s-Tim-3 水平呈负相关(P<0.05),见表4。

表3 AP 患者血清炎症因子、RAAS 分子及s-Tim-3 水平与APACHE Ⅱ评分的相关性
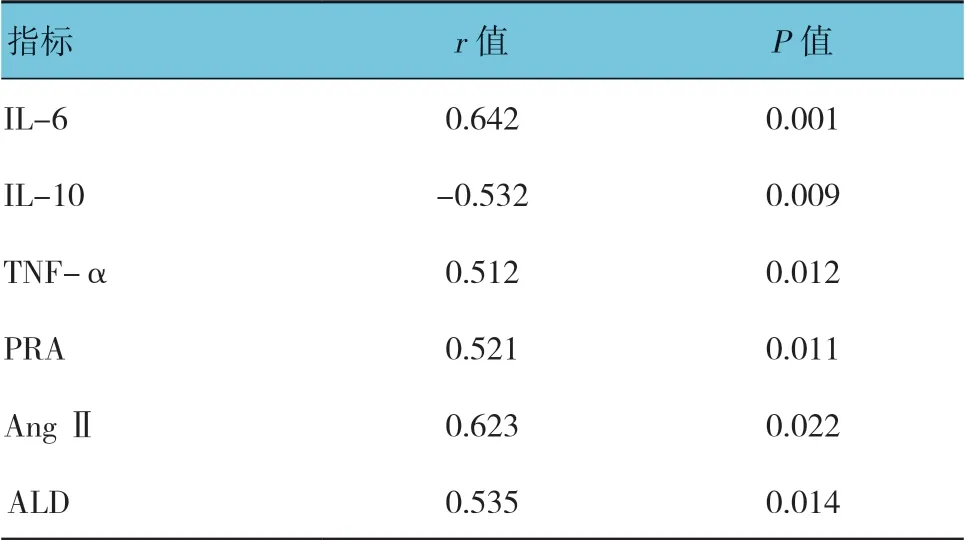
表4 AP 患者血清炎症因子、RAAS 分子与s-Tim-3 水平的相关性
3 讨论
AP 发生时由于胰腺组织的自我破坏,胰腺自身抗原暴露,可激活炎症细胞短时间释放大量炎症因子,从而导致SIRS。SIRS 的级联激活是AP 加重的核心环节,其影响多个炎症因子的调节释放,单一的指标难以评估SIRS,也不足以准确评估AP 患者的疾病严重程度[15]。APACHE Ⅱ评分系统涉及多个生命体征及测量指标,是目前广泛采用的用以评估患者病情程度和预后的评分系统,在AP 预后评估方面具有客观、全面的优势[14]。但APACHE Ⅱ评分系统也存在计算复杂,测量指标繁琐,在AP 早期难以及时评估患者病情的不足。
有研究表明,AP 早期既可出现免疫失调,随着疾病的进展,机体可出现代偿性的免疫抑制,这可能与患者继发感染有关[16]。IL-6、IL-10 和TNF-α 是重要的炎症因子,在免疫调节中起重要作用。IL-6 在炎症反应中起多项作用,如促进细胞黏附分子分泌,细胞迁徙聚集等。有研究表明,当IL-6 大量释放时,可提高MODS 的发病率[8]。本研究中,随着病情的加重,血清TNF-α 水平明显增高,且与APACHE Ⅱ评分呈正相关,提示TNF-α 是AP 病情评估的良好指标。TNF-α 是肿瘤坏死因子家族的成员,是炎症反应的重要启动因子,其可通过诱导白细胞介素1(Interleukin-1, IL-1)与IL-6 的分泌,调节炎症反应。TNF-α 还可诱导血管活性物质的产生,增加血管通透性,并促进血栓形成,过度分泌的TNF-α 能直接造成器官损伤[17]。本研究中,随着病情的加重,血清IL-6 水平明显增高,且与APACHE Ⅱ评分呈正相关,提示IL-6 是AP 病情评估的良好指标。IL-10 是重要的免疫调节因子之一,其可拮抗性调节IL-1,从而抑制多种炎症反应,并可诱导免疫耐受,从而降低过度免疫反应引起的损伤,另外IL-10 还可抑制IL-6、TNF-α 的合成及活性,从而调控AP 的炎症反应程度。本研究中,轻度AP 组的血清IL-10 水平高于中重度AP 组,其可能通过抑制过度的免疫反应,对AP 患者起保护作用。赵波等[18]研究了重症AP 患者IL-6、TNF-α、IL-10、TGF-β 和CRP 与疾病病情严重程度,其结果与本研究结果相似。另外,本研究中IL-10 与APACHE Ⅱ评分呈负相关,也证明了其可作为保护因子,用以评估AP 患者病情。
近年来,有研究发现,胰腺组织中也存在RAAS,并可分泌RASS 分子调节炎症反应,RAAS 激活后可大量分泌PRA、Ang Ⅱ及ALD,造成血管收缩和胰腺组织灌注异常,最终导致胰腺细胞水肿、变性及坏死[19]。本研究发现,随着AP 患者病情的进展,RASS分子水平明显升高,中重度AP 组血清PRA、Ang Ⅱ、ALD 水平明显高于轻度AP 组及对照组,而且PRA、Ang Ⅱ及ALD 与APACHE Ⅱ评分呈正相关,说明RAAS 的激活与AP 的发生发展存在密切关系。任勇[20]报道了93例患者的RAAS 因子与AP 患者的全身炎症反应程度及靶器官损伤程度的相关性,也证明了RASS 分子可用以评估AP 患者的病情严重程度。
T 细胞免疫球蛋白和粘蛋白结构域蛋白3(Tim-3)是Tim 家族的成员蛋白,被证明在CD4+、Th1、Th17、CD8+T1、树突状、自然杀伤细胞和巨噬细胞细胞中发挥重要作用[21]。目前有研究表明,s-Tim-3 与炎症反应存在密切关系[22]。REN 等[23]发现s-Tim-3 参与脓毒症的发展,s-Tim-3 在脓毒症期间对单核细胞具有免疫抑制作用;s-Tim-3 的出现扰乱了Tim-3 的体内平衡,加重了患者的脓毒血症。在本研究中,随着AP病情的加重,血清s-Tim-3 也随之升高,且s-Tim-3水平也与APACHE Ⅱ评分呈正相关,说明了s-Tim-3与AP 的预后存在相关性。LIN 等[24]对44例AP 患者血清s-Tim-3 水平测定,认为s-Tim-3 通过正相关调节促炎细胞因子参与AP 的早期进展,并认为血清s-Tim-3 可作为预测AP 病情严重程度的早期标志物。本研究的不足之处在于研究结果虽表明s-Tim-3 可作为预测AP 病情严重程度的早期标志物,但其机制仍不明确,尚待进一步研究。
综上所述,AP 患者s-Tim-3 水平在早期即可明显升高。血清s-Tim-3、炎症因子及RAAS 分子与AP 病情严重程度有关,且s-Tim-3 与炎症因子、RAAS 分子也存在相关性,对其进行检测有助于临床上AP 患者病情严重程度的评估及早期治疗。
