MicroRNA-494对胃癌细胞增殖、细胞周期及凋亡的影响
2021-01-04车宇梁静杨怡萍廖娟王蒨蔡英全邵帅
车宇,梁静,杨怡萍,廖娟,王蒨,蔡英全,邵帅
(陕西省肿瘤医院 放疗科,陕西 西安 710061)
近年来,我国胃癌的发病率呈逐年上升趋势[1]。胃癌早期多以烧心、腹胀不适及体重下降等亚临床表现为主,许多患者就诊时其胃癌已属临床晚期,失去了行根治性手术的机会。研究抑制胃癌生长的分子指标对提高胃癌患者手术切除率及改善患者长期预后具有重要作用。
MicroRNA 是单链的长度较短的RNA,通常其碱基数量为18 ~25 bp[2]。已发现许多与胃癌细胞增殖、转移及肿瘤血管新生密切相关的microRNA[3-4]。microRNA-494(miR-494)是近年来新鉴定出的一种microRNA,在多种妇科肿瘤(包括子宫内膜癌及卵巢癌)中的表达水平显著下调[5-6]。目前,miR-494 在胃癌中的表达水平及生物学功能尚不可知。笔者拟通过检测miR-494 在胃癌组织及胃癌细胞MGC803 中的表达,探究miR-494 对胃癌细胞增殖、细胞周期及凋亡的影响。
1 材料与方法
1.1 组织标本
选取2015年1月—2018年1月被陕西省肿瘤医院收治并行手术切除的60例患者的胃癌组织及对应癌旁组织(距肿瘤边缘>2 cm)标本。其中男性38例,女性22例;年龄37 ~68 岁,中位年龄53 岁。
1.2 细胞来源及主要试剂
MGC803 细胞由陕西省肿瘤医院放疗科实验室保存。microRNA mimics 模拟物(miR-494 及阴性对照)、引物(miR-494 及U6)购自广州复能基因有限公司及广州锐博生物科技有限公司,DMEM 培养基及胎牛血清购自美国Gibco 公司,Trizol、Lipofectamine®2000、SuperScript® One-Step RT-PCR System with Platinum® Taq DNA Polymerase 及DyNAmo Flash SYBR Green qPCR Kit 购自美国Invitrogen 公司,细胞周期蛋 白D1(CyclinD1) 抗 体(ab494175) 及β-actin抗体(ab8226)购自美国Abcam 公司,MTT 药物、Annexin-V/PI 细胞周期及凋亡检测试剂盒购自上海生工生物工程股份有限公司。
1.3 PCR
按Trizol 试剂说明书提取胃癌组织、癌旁组织及MGC803 细胞RNA,分别组建RT-PCR 及realtime PCR 反应体系。RT-PCR 反应条件:50℃逆转录30 min,94℃变性2 min,共1 个循环。real-time PCR反应条件:94℃变性15 s,60℃退火30 s,68℃延伸3 min,共40 个循环,72℃继续延伸10 min。通过2-△△Ct法计算miR-494 及CyclinD1 mRNA 的相对表达量。
1.4 细胞培养及mimics 转染
培养MGC803 细胞至稳定传代,将MGC803 细胞以合适密度接种于6 孔板中,过夜培养后洗涤细胞。根据mimics 转染分为miR-494 组和对照组。miR-494组每孔加入100 pmol miR-494 mimics、2 ml 含血清DMEM 及5μl 转染试剂;对照组每孔加入100 pmol阴性对照mimics、2 ml 含血清DMEM 及5μl 转染试剂。转染24 h 后进行后续实验。
1.5 MTT 法
将MGC803 细胞分别转染24 h、48 h、72 h 后按2×104个/孔的密度接种于96 孔板,每个时间点设置6个平行对照。培养过夜后加入MTT 溶液,再次避光培养4 h。吸净上清液后每孔用150μl DMSO 溶液溶解MTT结晶。读取酶标仪490 nm 处的光密度(optical density,OD)值。
1.6 流式细胞术
通过流式细胞仪检测过表达miR-494 对MGC803 细胞周期及细胞凋亡的影响。将转染72 h后的MGC803 细胞用冷PBS 洗2 次,胰酶消化后以800 r/min 离心5 min,获取细胞沉淀,用PBS 缓冲液重悬细胞并调整细胞密度为5×106个/ml,取100μl细胞悬液与10μl 碘化丙啶(PI)溶液混合上机检测细胞周期;取100μl 细胞悬液与5μl 及10μl PI 溶液混合上机检测细胞凋亡。
1.7 Western blotting
采用放射免疫沉淀法提取细胞总蛋白,SDSPAGE 胶电泳分离蛋白,70 V 湿转120 min 转印目标蛋白至PVDF 膜上,室温封闭2 h 后将目标条带分别置入CyclinD1 和β-actin 一抗溶液中,在4℃下孵育过夜,用1∶5 000 稀释的HRP 标记二抗,在室温中孵育目标条带1 h。采用ECL 法显影,计算蛋白相对表达量。
1.8 免疫组织化学法
将甲醛固定、石蜡包埋的组织切片常规脱蜡、水化及微波抗原修复,分别用3%过氧化氢及10%山羊血清封闭切片。用PBS 溶液按1∶100 配制CyclinD1一抗工作液,覆盖组织切片,4℃摇晃、孵育过夜。PBS 溶液洗净未结合一抗后,使用辣根过氧化物酶标记的山羊抗兔二抗结合相应一抗,用DAB 法显示阳性蛋白。计算染色得分:无阳性染色细胞计0 分,<25%计1 分,25%~<50%计2 分,50%~<75%计3 分,≥75%计4 分[7]。
1.9 统计学方法
数据分析采用SPSS 13.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验或重复测量设计的方差分析,相关性分析用Pearson 法,P<0.05为差异有统计学意义。
2 结果
2.1 胃癌与癌旁组织miR-494 相对表达量比较
癌旁组织miR-494 相对表达量为(1.327±0.052),胃癌组织为(0.921±0.048),经t检验,差异有统计学意义(t=5.421,P=0.000),癌旁组织较胃癌组织高。不同肿瘤直径、TNM 分期患者的miR-494 相对表达量比较,差异有统计学意义(P<0.05)不同性别、年龄,及是否吸烟、幽门螺杆菌感染、淋巴结转移患者的miR-494相对表达量比较,差异无统计学意义(P>0.05)。见表1。
表1 不同临床病理特征患者的miR-494 相对表达量比较(n =60,±s)

表1 不同临床病理特征患者的miR-494 相对表达量比较(n =60,±s)
临床病理特征 miR-494 t 值 P 值性别男0.871±0.037 1.295 0.062女0.931±0.065年龄≤60 岁 0.935±0.026 1.167 0.087>60 岁 0.881±0.038吸烟是0.904±0.049 0.856 0.105否0.936±0.028幽门螺杆菌感染是0.933±0.019 0.738 0.211否0.909±0.024肿瘤直径≤3 cm 0.975±0.031 1.844 0.041>3 cm 0.722±0.046淋巴结转移是0.884±0.055 1.660 0.059否0.939±0.032 TNM 分期Ⅰ、Ⅱ期 0.949±0.027 1.969 0.028Ⅲ、Ⅳ期 0.836±0.059
2.2 miR-494 对MGC803 细胞增殖、细胞周期进展及凋亡的影响
对照组MGC803 细胞miR-494 相对表达量为(1.00±0.00),miR-494 组 为(11.23±3.87),经t检验,差异有统计学意义(t=8.031,P=0.000),对照组较miR-494 组低(见图1),表明慢病毒感染促进MGC803 细胞miR-494 的表达。两组转染后24 h、48 h、72 h 的OD 值比较,经重复测量设计的方差分析,结果如下:①不同时间点的OD 值比较,差异有统计学意义(F=15.762,P=0.016);②两组的OD值比较,差异有统计学意义(F=67.896,P=0.008),miR-494 组较对照组低,细胞活力较低;③两组的OD 值变化趋势比较,差异有统计学意义(F=19.214,P=0.013)(见表2和图2)。流式细胞术结果表明,对照组G0/G1期比例为(40.33±4.23)%,miR-494 组为(78.19±6.48)%,经t检验,差异有统计学意义(t=3.721,P=0.023)(见图3);对照组细胞凋亡比例为(11.28±3.05)%,miR-494 组为(13.45±2.16)%,经t检验,差异无统计学意义(t=1.034,P=0.063)(见图4)。

图1 两组miR-494 相对表达量比较 (±s)
表2 两组不同时间点OD 值比较 (±s)

表2 两组不同时间点OD 值比较 (±s)
组别 24 h 48 h 72 h对照组 0.176±0.011 0.463±0.031 0.814±0.032 miR-494 组 0.131±0.009 0.296±0.017 0.544±0.034

图2 两组不同时间点OD 值变化趋势 (±s)

图3 两组G0/G1 期细胞的流式细胞图

图4 两组凋亡细胞的流式细胞图
2.3 miR-494 对MGC803 细胞中CyclinD1 表达的影响
对照组CyclinD1 mRNA 相对表达量为(1.00±0.00),miR-494 组为(0.41±0.13),经t检验,差异有统计学意义(t=4.031,P=0.011),对照组较miR-494 组高(见图5),表明过表达miR-494 抑制CyclinD1 mRNA 的表达。对照组CyclinD1 蛋白相对表达量为(0.68±0.13),miR-494 组为(0.27±0.09),经t检验,差异有统计学意义(t=2.106,P=0.042),对照组较miR-494 组高(见图6),表明过表达miR-494 下调CyclinD1 蛋白的表达。
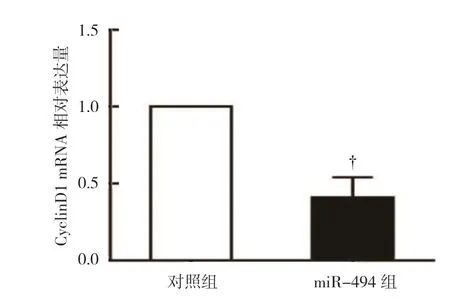
图5 两组CyclinD1 mRNA 相对表达量比较 (±s)

图6 两组CyclinD1 蛋白相对表达量比较 (±s)
2.4 miR-494 与CyclinD1 的相关性
miR-494 与CyclinD1 免疫组织化学评分呈负相关(r=-0.469,P=0.009)。见图7。
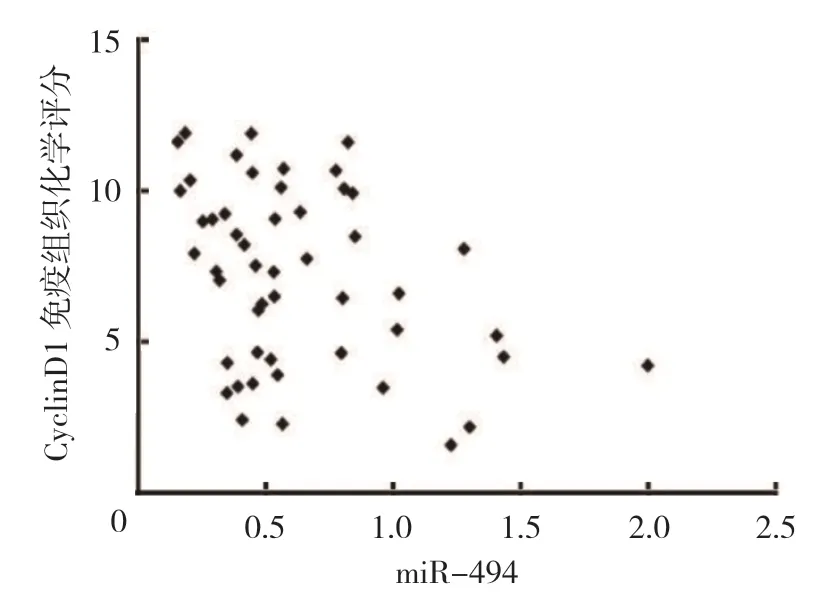
图7 miR-494 与CyclinD1 免疫组织化学评分的相关性散点图
3 讨论
miR-494 首先被发现于人类视网膜母细胞瘤中,其在人类许多良恶性疾病中扮演重要角色。例如,抑制动脉粥样硬化小鼠体内miR-494 的表达水平能够提高斑块的稳定性[8];高血清miR-494 水平与子宫内膜异位症患者并发不孕关系密切[9];低表达miR-494的乳腺癌患者预后不良[10]。但其在胃癌的表达及生物学功能尚未完全清楚。
本研究结果提示miR-494 在胃癌中扮演潜在抑癌角色,miR-494 能够显著抑制体外培养MGC803 细胞的增殖,阻碍细胞周期的进展。但是其对细胞凋亡的发生并无显著影响。除此之外,笔者通过文献查询也发现,miR-494 对结直肠癌转移及肺癌耐药也具有调控作用[11-12],说明miR-494 具有多样性的抗肿瘤作用,值得进一步深入研究。
MicroRNA 能够通过结合靶基因3’-UTR 区而发挥负向调控作用。结合上述功能学实验结果及生物信息学分析结果发现,细胞周期蛋白CyclinD1 mRNA存在于miR-494 的结合位点,可能是miR-494 的潜在靶点之一。进一步实验发现,过表达miR-494 能下调CyclinD1 的表达,且在组织水平上,miR-494与CyclinD1 的表达呈负相关。CyclinD1 是调控细胞增殖和细胞周期的主要生物因子[13]。有研究指出,CyclinD1 的异常高表达与胃癌的进展密切相关[13]。因此,下调CyclinD1 的表达可能是miR-494 抑制胃癌细胞的关键机制之一。
