益生菌联合整蛋白型肠内营养辅助治疗脓毒血症的疗效及对肠道和免疫功能的影响*
2021-01-04吕艳超李兴华刘颖
吕艳超,李兴华,刘颖
(保定市第一中心医院 重症医学科,河北 保定 071000)
脓毒血症一词来源于古希腊语,意为腐烂的肉,由各种病原菌感染侵入血液中,并通过血液扩散至全身,激活宿主细胞和免疫系统,产生各种细胞炎症因子,引发机体的全身炎症反应综合征(systemic inflammatory response syndrome, SIRS),从而出现急性肾损伤、急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)、休克、多器官功能障碍综合 征(multiple organ dysfunction syndrome, MODS)[1-2]。故从本质上来讲,脓毒血症是机体对感染因素的应激性反应。脓毒血症发展极快,可迅速出现组织低灌注/低血压状态,经早期液体复苏后无法纠正的低血压往往会引起脓毒性休克,进而伴发≥1 个急性脏器功能障碍。目前,脓毒血症治疗主要包括抗感染(应用广谱/窄谱抗生素)、营养支持、液体复苏、机械通气等。胃肠道不单纯是消化吸收器官,也是重要的免疫器官。由于脓毒血症患者机体细胞免疫功能下调,肠道功能及营养吸收出现异常[3-4]。因此,提升患者肠道和免疫功能对本症的治疗具有积极意义。骆恒芳等[5]研究表明,益生菌可以调节系统免疫功能,利于肠道菌群平衡。并且益生菌能刺激细胞分泌抗体,刺激肠道产生分泌性球蛋白A,提高免疫力,保护机体健康[6]。且益生菌可以缓解机体的炎症反应,有效改善机体炎症因子水平[7]。对危重症患者予以肠内营养(enteral nutrition, EN),不仅可以给予代谢所需的营养物质,而且助于维持肠黏膜的结构和屏障功能的完整性,增强机体免疫力[8]。整蛋白型肠内营养剂含酪蛋白、维生素、矿物质等,适用于脓毒血症患者[9]。笔者在长期对脓毒血症患者的治疗中,摸索出益生菌联合整蛋白型肠内营养支持临床基础抗感染的治疗方案,旨在提高脓毒血症患者治愈率,降低病死率并改善预后,现报道如下。
1 资料与方法
1.1 临床资料
选取2015年6月—2018年6月保定市第一中心医院西院收治的脓毒血症患者134例。将患者随机分为观察组和对照组,各67例。其中,男性76例,女性58例;年龄32 ~71 岁,平均(55.2±6.8)岁。感染因素:术后感染4例,严重皮肤软组织感染9例,尿道感染11例,急性化脓性胆管炎17例,慢性阻塞性支气管炎27例,重症肺炎66例。患者均符合《中国脓毒症/脓毒性休克急诊治疗指南》[10]中关于脓毒血症的诊断标准。
1.2 方法
对照组根据患者病情予以抗感染、液体复苏、清创引流、机械通气等。在此基础上,观察组另加用双歧杆菌四联活菌片联合整蛋白型肠道营养剂进行支持治疗。采用能全素营养剂(无锡市纽迪希亚制药有限公司,国药准字J20040077),4℃保存,视患者营养需求给予1 000 ~2 000 kcal/d(1 kcal=4.184 kJ),两组均连续治疗10 d。分别比较两组治疗前和治疗3 d、10 d 后急性生理和慢性健康状况(APACHE-II)评分和序贯器官衰竭(SOFA)评分。采用酶联免疫吸附法测定两组患者降钙素原(PCT)、白细胞介素-6(IL-6)、C 反应蛋白(CRP)及血清淀粉样蛋白酶A(SAA)。按我国1995年庐山会议所定的MODS 病情分期及严重程度评分(2015年修订版)[11]进行肠功能评分,0 分:肠鸣音正常,无胀气,消化吸收功能正常;1 分:恶心呕吐,肠鸣音减弱或消失,或有胀气,肠动力减弱;2 分:肠鸣音消失,胀气,肠道消化吸收能力严重受损;3 分:大量胃潴留,持续性肠道麻痹,肠内出血,腹腔内高压。免疫标记法测量外周血T 淋巴细胞亚群CD3+、CD4+和CD4+/CD8+的水平,所用试剂盒均购自上海仁捷生物科技有限公司,严格按照说明书进行操作。随访3 个月,记录患者出院后病死/存活转归情况。
1.3 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验或重复测量设计的方差分析;计数资料以率(%)表示,比较用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组治愈率、病死率比较
治疗期间观察组有3例患者家属签字同意终止或转院治疗,对照组有6例。观察组治愈率为89.55%,对照组为79.10%,观察组病死率为5.97%,对照组为11.94%。两组治愈率、病死率比较,差异有统计学意义(χ2=3.767 和3.465,P=0.036 和0.039),观察组治愈率较对照组高,病死率较对照组低。
2.2 两组APACHE-Ⅱ评分、SOFA 评分比较
两组治疗前和治疗3 d、10 d 的APACHE-Ⅱ评分、SOFA 评分比较,经重复测量设计的方差分析,结果如下:①不同时间点的APACHE-Ⅱ评分、SOFA评分比较,差异有统计学意义(F=6.529 和7.053,P=0.002 和0.000);②两组APACHE-Ⅱ评分、SOFA评分比较,差异有统计学意义(F=4.982 和5.384,P=0.016 和0.011);③两组APACHE-Ⅱ评分、SOFA评分变化趋势比较,差异有统计学意义(F=5.168 和6.058,P=0.014 和0.005)。见表1。
2.3 两组治疗前后肠道功能评分比较
两组治疗前肠道功能评分比较,差异无统计学意义(P>0.05)。两组治疗后肠道功能评分比较,差异有统计学意义(P<0.05),观察组较对照组低。见表2。
表1 两组患者治疗前后APACHE-Ⅱ评分、SOFA 评分比较 (±s)
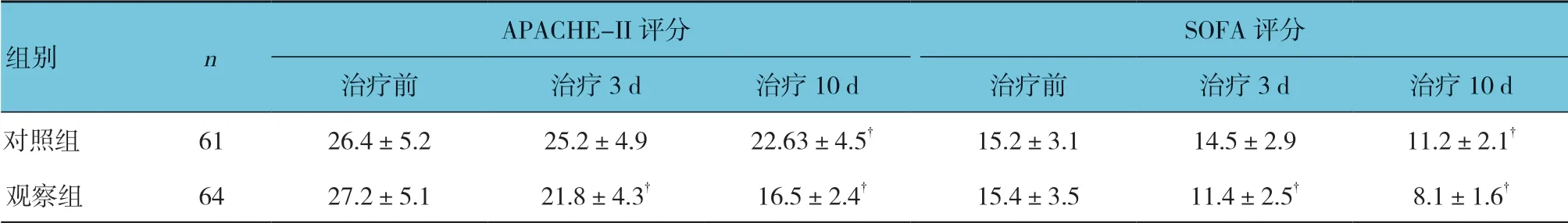
表1 两组患者治疗前后APACHE-Ⅱ评分、SOFA 评分比较 (±s)
注:†与治疗前比较,P <0.05。
APACHE-II 评分 SOFA 评分治疗前 治疗3 d 治疗10 d 治疗前 治疗3 d 治疗10 d对照组 61 26.4±5.2 25.2±4.9 22.63±4.5† 15.2±3.1 14.5±2.9 11.2±2.1†观察组 64 27.2±5.1 21.8±4.3† 16.5±2.4† 15.4±3.5 11.4±2.5† 8.1±1.6†组别 n
表2 两组治疗前后肠道功能评分比较 (±s)
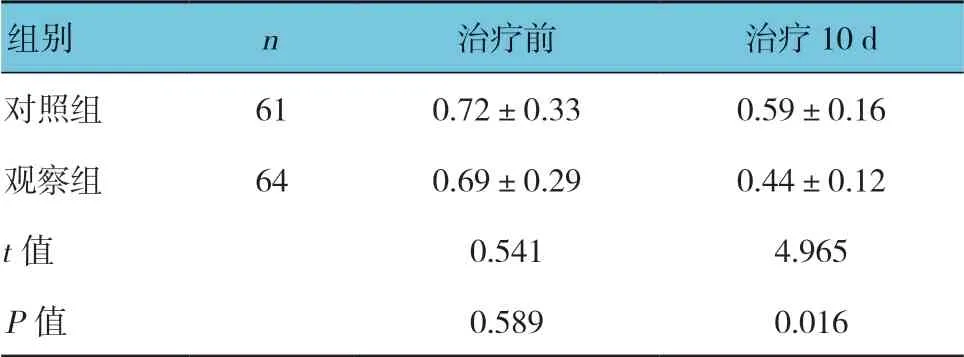
表2 两组治疗前后肠道功能评分比较 (±s)
组别 n 治疗前 治疗10 d对照组 61 0.72±0.33 0.59±0.16观察组 64 0.69±0.29 0.44±0.12 t 值 0.541 4.965 P 值 0.589 0.016
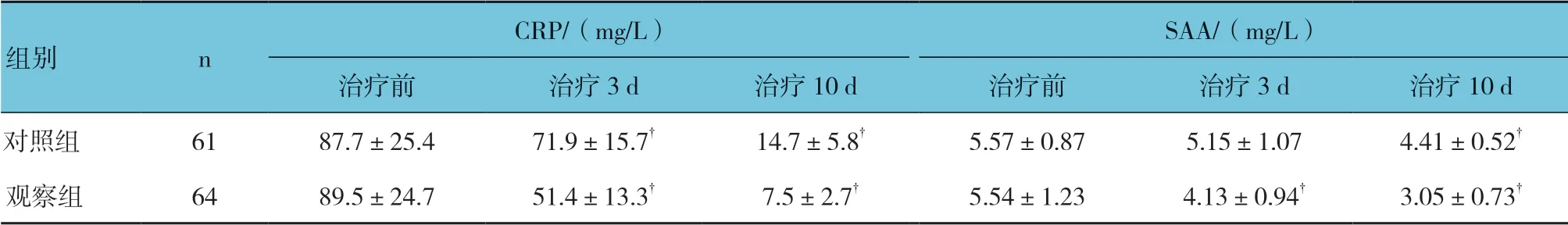
2.4 两组治疗后炎症因子水平比较
两组治疗前和治疗3 d、10 d 的PCT、IL-6、CRP 及SAA 水平比较,经重复测量设计的方差分析,结果如下:①不同时间点的PCT、IL-6、CRP 及SAA水平比较,差异有统计学意义(F=7.524、5.863、6.189和7.162,均P=0.000);②两组PCT、IL-6、CRP 及SAA 水平比较,差异有统计学意义(F=4.297、5.743、6.895 和4.583,P=0.025、0.009、0.000 和0.021);③两组PCT、IL-6、CRP 及SAA 水平变化趋势比较,差异有统计学意义(F=7.351、7.592、6.519 和6.834,均P=0.000)。见表3。
表3 两组治疗后炎症因子水平比较 (±s)
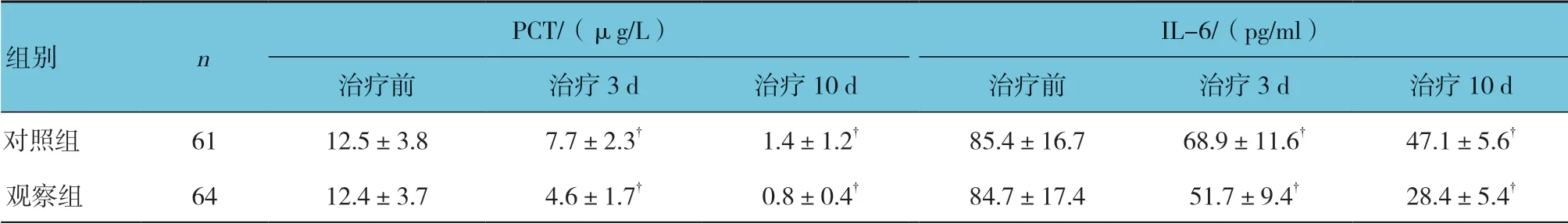
表3 两组治疗后炎症因子水平比较 (±s)
PCT/(μg/L) IL-6/(pg/ml)治疗前 治疗3 d 治疗10 d 治疗前 治疗3 d 治疗10 d对照组 61 12.5±3.8 7.7±2.3† 1.4±1.2† 85.4±16.7 68.9±11.6† 47.1±5.6†观察组 64 12.4±3.7 4.6±1.7† 0.8±0.4† 84.7±17.4 51.7±9.4† 28.4±5.4†组别 n
续表3
2.5 两组治疗前后外周血T 淋巴细胞亚群比较
两组治疗前和治疗3 d、10 d 的CD3+、CD4+及CD4+/CD8+水平比较,经重复测量设计的方差分析,结果如下:①不同时间点的CD3+、CD4+和CD4+/CD8+水平比较,差异有统计学意义(F=5.284、4.681 和4.019,P=0.014、0.021 和0.029);②两组CD3+、CD4+和CD4+/CD8+水平比较,差异有统计学意义(F=4.359、5.018 和4.883,P=0.024、0.016 和0.017);③两组的CD3+、CD4+和CD4+/CD8+水平变化趋势比较,差异有统计学意义(F=5.394、6.128 和4.953,P=0.013、0.007和0.016)。见表4。
表4 两组治疗前后外周血T 淋巴细胞亚群比较 (±s)
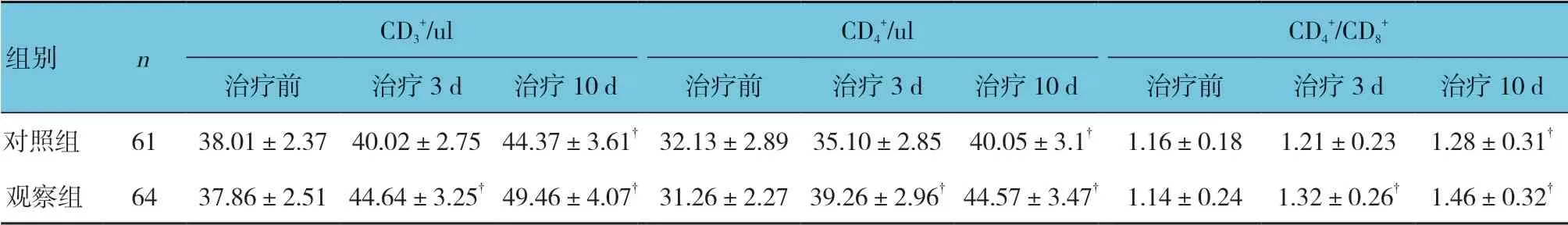
表4 两组治疗前后外周血T 淋巴细胞亚群比较 (±s)
注:†与治疗前比较,P <0.05。
CD3+/ul CD4+/ul CD4+/CD8+组别 n治疗前 治疗3 d 治疗10 d 治疗前 治疗3 d 治疗10 d 治疗前 治疗3 d 治疗10 d对照组 61 38.01±2.37 40.02±2.75 44.37±3.61† 32.13±2.89 35.10±2.85 40.05±3.1† 1.16±0.18 1.21±0.23 1.28±0.31†观察组 64 37.86±2.51 44.64±3.25† 49.46±4.07† 31.26±2.27 39.26±2.96† 44.57±3.47† 1.14±0.24 1.32±0.26† 1.46±0.32†
3 讨论
脓毒血症是一种较为棘手的炎性重症,病死率极高。脓毒血症通常是由微生物侵入人体血液循环,其中较为常见的致病细菌有革兰阴性菌、革兰阳性菌及真菌诱发的过度激烈全身炎症反应,其严重程度取决于机体的反应性。但是脓毒血症发病往往不明确病因,有研究者指出约有1/3 的脓毒血症患者找不到明确的致病菌[12]。所以,脓毒血症的临床诊断不能单一凭培养菌的阳性结果。脓毒血症患者通常因血压急剧降低,体内环境紊乱,重要器官灌流不足,死于器官衰竭,且从发病到病死的时间极短。目前临床一般治疗手段包括强力抗生素进行抗感染、液体复苏、抗休克治疗等,但治疗手段仍较为单一,往往由于脓毒血症的进行性发展导致应激性溃疡、弥漫性血管内凝血、MODS 等严重并发症进而病死。
脓毒血症本质上来讲是一种急性全身性炎症。在发病过程中,会产生大量炎症细胞因子,如PCT、CRP、SAA 等[13]。其中PCT 是由116 个氨基酸序列组成的蛋白质,局部有限的细菌感染或轻微炎症不会引起PCT 升高,往往是由于细菌内毒素的诱导/重症炎症才导致PCT 水平升高。检测血清PCT 可以预测脓毒血症进展,降低脓毒血症病死率,对于炎症的发生、发展具有较好的参考意义[14-15]。CRP 作为与炎症严重程度呈正相关的非特异性高敏炎症指标,是临床应用较多的炎症指示性细胞因子[15]。SAA 作为急性相蛋白,用以评估急性相反应进程,在感染性疾病中SAA 的绝对上升要高于其他炎症因子,对正常以及微小的炎性反应具有较好的参考意义[16]。T 淋巴细胞亚群水平与机体免疫功能密切相关,监测外周血T 淋巴细胞亚群可以分析发病机制,且可以观察治疗方案的疗效,监测预后[17]。
益生菌是可以参与并促进肠道营养物质的微生物。且益生菌能缓解机体炎症反应,提高免疫力。由于脓毒血症属于危重症,大多数患者进食困难,需给予其他营养支持方式,肠内营养是通过口服、导管输入两种方式,直接作用于肠道进行吸收的营养支持方式,摄入方式视患者情况选择。对于病理性需求,必须给予营养支持的患者,肠内营养较其他营养供给方式有着符合生理、直接经肠道吸收、给药方便及价格低廉的优势,是临床上常用的营养支持方式[18-19]。有研究显示,对于急性重症胰腺炎患者,给予肠内营养,可以有效改善患者代谢,降低全身炎症反应,提高患者免疫力[20]。本研究结果显示,益生菌联合整蛋白肠内营养能有效改善患者炎症情况,提升患者T 淋巴细胞亚群CD3+、CD4+和CD4+/CD8+水平,提高患者免疫力,降低病死率。
综上所述,益生菌联合整蛋白型肠内营养支持治疗脓毒血症,能提高疗效,改善肠道功能,并对炎症细胞因子水平以及免疫力的改善也有积极作用,有效降低病死率,值得临床推广。
