茯苓提取物对高脂饮食致肠道菌群失调小鼠的影响△
2021-01-04吴振宁祁龙凯陈地灵
吴振宁,祁龙凯,陈地灵
1.海南省中医院,海南 海口 570203;2.广东省科学院 广东省微生物研究所 华南应用微生物国家重点实验室/广东省微生物安全与健康重点实验室,广东 广州 510070
随着社会经济发展及生活水平的提高,人类饮食结构发生较大改变,富含饱和脂肪的肉类及油炸食品摄入比例日益提高。研究显示,长期高脂饮食可导致肥胖、高脂血症、糖尿病等一系列慢性代谢性疾病[1-2]。肠道是人体最重要的消化器官,大部分营养物质消化吸收均在肠道进行,而人体肠道内寄生着数万亿计的微生物。研究表明,肠道微生物与宿主能量代谢密切相关,其在肥胖、糖尿病等代谢性疾病的发生、发展过程中更是扮演重要角色[1,3]。菌群组成改变可能是饮食引发的肥胖及相关代谢性疾病的关键诱发因素。临床大数据研究显示,肥胖人群肠道菌群结构发生明显变化,菌群多样性降低,厚壁菌门/拟杆菌门比值显著提升[4]。动物实验证实,长期高脂饮食可改变肠道菌群结构,破坏正常肠道屏障,促进异位脂肪沉积及肠道内毒素脂多糖(LPS)进入内循环引起全身低度炎症[5-6]。
正常状态下,机体内肠道菌群结构相对稳定。但诸多研究指出,饮食或膳食补充剂中的蛋白质、糖类、膳食纤维、多酚等特定营养成分均可影响肠道菌群的组成。1977年,Hentges等[7]首次报道了膳食中的蛋白质对肠道微生物的影响,通过比较素食与食用大量牛肉青少年人群的肠道微生物后发现,食肉的青少年肠道菌群中双歧杆菌数量显著降低,而拟杆菌和梭状芽胞杆菌数量显著增加。多项研究结果表明,摄入蛋白量与肠道微生物总体多样性呈正相关[8-10]。目前除蛋白质外,营养成分对肠道微生物影响更多集中于低聚糖、膳食纤维这类无法直接被人体消化吸收的碳水化合物,该类化合物可被肠道微生物发酵,为宿主提供能量[11-12],且在此过程中可改变肠道环境,提高肠道菌群丰度及双歧杆菌、乳酸菌等有益菌数量[13-15]。鉴于肠道微生物、饮食与健康的关联,通过饮食或膳食补充剂改善肠道微生物可能对某些疾病的预防和治疗具有重要作用。
茯苓是多孔菌科真菌茯苓Poriacocos(Schw.)Wolf的干燥菌核,中医认为茯苓具有利水渗湿、宁心、健脾的功效,常用于水肿尿少、痰饮眩悸、脾虚食少、便溏泄泻、心神不安、惊悸失眠等症[16]。茯苓属于药食同源的药材,不仅是常用健脾祛湿药,更是滋补佳品,药性缓和,补而不峻,利而不猛,已有2000多年应用历史。迄今为止,从茯苓中分离发现的化合物主要有多糖类、三萜类、甾醇等,药理学研究表明,茯苓具有较好的抗肿瘤、免疫调节、降血糖、调脂保肝等生物活性,其重要活性成分为多糖和三萜类[17-18]。本实验从茯苓健脾开胃、调理肠道的功能入手,制备高脂饮食诱导肠道菌群失调模型,研究茯苓不同提取物对脂质代谢和肠道菌群的调节作用,以期为茯苓提取物调控脂质代谢和肠道菌群的应用提供数据支持。
1 材料
1.1 实验动物
雄性昆明种(KM)小鼠50只,SPF级,体质量12~14 g,28~30日龄,购于广东省医学实验动物中心,许可证号SCXK(粤)2013-0002。小鼠饲养于广东省微生物所动物实验中心,饲养温度(23±1) ℃,湿度(55±10)%,采用12 h昼夜间断照明。小鼠自由进食饮水。
1.2 试药
茯苓药材由广东粤微食用菌技术有限公司提供,批号:YW20190410,由广东省微生物研究所陈地灵副研究员鉴定为多孔菌科茯苓Poriacocos(Schw.)Wolf的干燥菌核,标本保存于广东省微生物研究所食用菌研究发展中心;氢氧化钠、无水乙醇均为分析纯(广东光华科技股份有限公司);总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)测试盒(南京建成生物工程研究所);高脂饲料购自广东省医学实验动物中心(批号:D12492,含52.2%基础饲料、20%蔗糖、15%猪油、10%酪蛋白、1.2%胆固醇、0.6%磷酸氢钙、0.4%石粉、0.4%预混料和0.2%胆酸钠)。
1.3 仪器
ALPHA 1-4 LD plus型冷冻干燥机(德国Christ公司);INFINITE 200 Pro型酶标仪(勒菲生物科技有限公司);HM340E型轮转式切片机、HiStoStar组织包埋机、Excelsior AS型自动组织脱水机、Gemini AS型全自动染色机(赛默飞世尔仪器有限公司);Illumina HiSeq 2500 PE250型测序仪(美国Illumina公司);RE-6000A型旋转蒸发仪(上海亚荣生化仪器厂);ML-1600型平板显微镜(浙江康涛自动化设备有限公司);ME204E型电子分析天平(d = 0.1 mg,梅特勒-托利多仪器有限公司)。
2 方法
2.1 茯苓不同提取物的制备
取干燥茯苓,粉碎,过三号药筛。取粉末,加12倍量无水乙醇,加热回流提取2 h,滤过,取续滤液即醇提取溶液;滤渣加12倍量水,加热回流提取2 h,滤过,取第2次续滤液即为水提取溶液;滤渣加10倍量2%氢氧化钠溶液,搅拌下浸泡12 h,超声30 min,3000×g离心10 min,取上清即为碱提取溶液。将醇提取溶液、水提取溶液和碱提取溶液分别减压浓缩、冷冻干燥,即得茯苓醇提取物(PCS)、茯苓水提取物(PCW)、茯苓碱提取物(PCA),冷藏备用。
2.2 多糖、蛋白质含量测定
多糖含量测定参照中华人民共和国农业行业标准NY/T 1676—2008《食用菌中粗多糖含量的测定》方法,蛋白质含量测定参照中华人民共和国食品安全国家标准GB 5009.5—16《食品中蛋白质的测定》第一法:凯氏定氮法。
2.3 模型制备与给药
饲养期间小鼠自由进食饮水,每日检查1次,取全部健康小鼠进行实验。50只KM小鼠经适应性饲养7 d后,随机分成对照组、模型组、PCW组、PCA组、PCS组,每组10只。对照组用普通饲料喂养,模型组和各给药组用高脂高胆固醇饲料喂养,连续喂养2个月后给药。各给药组按PCW 426.59 mg·kg-1、PCA 56.80 mg·kg-1、PCS 135.06 mg·kg-1灌胃给药,相当于茯苓生药量2 g·kg-1,对照组及模型组按0.5 mL/只给予纯水,每天给药1次,连续给药35 d。对照组小鼠继续用普通饲料喂养,给药组和模型组小鼠继续用高脂高胆固饲料喂养。每组随机选取8只进行检测分析。
2.4 小鼠外观体态观察及体质量检测
每天观察小鼠的外观体态(毛、色、形)和动态并作相应记录,每隔7 d测量体质量1次。
2.5 血样及组织样采集
小鼠末次灌胃24 h后,摘除眼球取血,血液经4 ℃,1000×g离心2次,每次10 min,收集血清,储存于-80 ℃冰箱备用。
取血后将小鼠颈椎脱臼处死,迅速剖取,收集肝脏、肠组织,并固定于4%多聚甲醛溶液中;收集盲肠内容物,液氮猝灭后,储存于-80 ℃冰箱。
2.6 血脂生化指标的测定
取血清,解冻后按试剂盒说明操作,测定血清中HDL-C、LDL-C、TG、TC水平,分析数据并比较各组血脂4项指标的变化。
2.7 小肠、肝脏病理学检查
取多聚甲醛固定的小鼠小肠、肝组织,修剪后乙醇逐级脱水,石蜡包埋,切片,苏木-伊红(HE)染色,光学显微镜下观察肝组织、肠组织形态及病理变化。
2.8 盲肠内容物16 S rRNA测序
提取小鼠盲肠内容物中的DNA,检测其质量并定量;采用正向引物5′-ACTCCTACGGGAGGCAGCA-3′和反向引物5′-GGACTACHVGGGTWTCTAAT-3′对小鼠16 S rRNA的V3~V4区基因进行PCR扩增,扩增产物经2%琼脂糖凝胶电泳检测,并对目标片段切胶回收;将PCR扩增回收产物进行荧光定量。根据荧光定量结果,将各组样本按相应比例混合后,制备测序文库,用Illumina HiSeq 2500 PE250进行2×300 bp双端测序。
在97%相似度下利用Qiime v1.8.0软件进行操作分类单元(operational taxonomic units,OTUs)聚类和物种注释,比较对照组、模型组及各给药组小鼠的肠道菌群变化,观察茯苓提取物对肥胖小鼠肠道菌群的影响。
2.9 数据统计方法

3 结果与分析
3.1 茯苓不同提取物中蛋白质和多糖测定结果
茯苓不同提取物中多糖与蛋白质的含量差异显著,PCW中多糖和蛋白质含量最高,PCA中多糖与蛋白质含量最低,提示茯苓中多糖主要为水溶性多糖,其次为醇溶性小分子多糖,酸性多糖含量最低,蛋白质主要为水溶性蛋白,见表1。

表1 茯苓不同提取物多糖和蛋白含量 g·kg-1
3.2 茯苓不同提取物对高脂饮食喂养小鼠外观体态与体质量的影响
在实验过程中,与对照组比较,高脂饮食模型组小鼠毛皮暗淡无光泽;茯苓给药组小鼠的毛皮较模型组更平滑光润。高脂饮食连续饲喂2个月,与对照组比较,模型组小鼠体质量显著升高(P<0.01),说明高脂饮食诱导肥胖模型造模成功。与模型组比较,连续灌胃不同茯苓提取物5周后,各给药组小鼠平均体质量均降低,其中PCW组小鼠平均体质量(65.19 g)与模型组(71.02 g)比较差异有统计学意义(P<0.05)。与对照组比较,模型组小鼠体质量差值显著升高(P<0.05)。与模型组比较,各茯苓提取物组小鼠体质量差值均降低,其中PCW组差异有统计学意义(P<0.05),见图1。表明茯苓不同提取物均可以减缓因高脂饮食导致的小鼠体质量增加并提亮毛色,其中PCW效果最佳。

注:与对照组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01;下同。图1 茯苓不同提取物对高脂饮食喂养小鼠体质量的影响
3.3 茯苓不同提取物对高脂饮食喂养小鼠血清脂质代谢指标的影响
与对照组比较,长期高脂饮食喂养可显著升高小鼠血清TG和TC水平,降低HDL-C水平(P<0.01)。与模型组比较,茯苓不同提取物均可不同程度降低小鼠血清TG、TC和LDL-C水平,升高HDL-C水平(P<0.05,P<0.01),见图2。结果表明,长期高脂饲料会导致小鼠血脂代谢异常,茯苓不同提取物均可不同程度改善小鼠血脂代谢异常问题,其中茯苓水提物改善脂质代谢异常效果最佳。

图2 茯苓不同提取物对高脂饮食喂养小鼠血清脂质代谢指标的影响
3.4 茯苓不同提取物对高脂饮食喂养小鼠小肠和肝组织病理形态的影响
对照组小鼠小肠组织黏膜层较厚,绒毛较长且排列整齐紧密;模型组小鼠小肠黏膜显著变薄,绒毛残缺变短,排列疏松;给予茯苓不同提取物后,小鼠小肠黏膜厚度显著增加,绒毛变长,完整性提高,其中PCW效果最好,见图3。结果提示,长期高脂饮食可破坏肠道屏障,使肠壁变薄,绒毛变短,而茯苓提取物可不同程度改善小肠肠黏膜结构,修复高脂饮食诱导的肠道损伤。
对照组小鼠的肝组织结构完整,中央静脉附近的肝细胞有少许空泡样变性和少量脂肪变性;模型组小鼠肝组织有明显脂肪肝特征,多数肝细胞脂肪变性,空泡化,中央静脉附近的肝细胞排列无序,出现点状坏死,呈现蔓延性空泡样;给予茯苓不同提取物后,各组小鼠肝脏虽仍有少量脂肪空泡,但细胞排列结构较为完整,脂肪变性程度显著降低,并趋向于正常水平,其中PCA改善高脂饮食诱导肝细胞损伤效果最好,见图3。
结果提示,茯苓不同提取物均可不同程度降低长期高脂饮食所引起的脂质在肝脏堆积,改善肝损伤。

注:A.小肠;B.肝组织。图3 茯苓不同提取物对高脂饮食喂养小鼠小肠和肝组织病理形态的影响(HE)
3.5 茯苓不同提取物对高脂饮食喂养小鼠肠道菌群的影响
3.5.1茯苓提取物对肠道菌群α多样性的影响α多样性可以反映物种的丰富度和均匀度,其中Ace、Chao1和Observed OTUs是菌群丰度的常用算法,Shannon和Simpson是物种丰富度和均匀度的常用算法[19]。由表2可知,模型组小鼠肠道菌群的Ace、Chao1和Observed OTUs指数低于对照组,但差异无统计学意义,Shannon和Simpson指数无明显变化。给予茯苓不同提取物后,与模型组比较,各组小鼠肠道菌群的Ace、Chao1和Observed OTUs指数均有不同程度的降低,但差异无统计学意义,Shannon和Simpson指数无明显变化。结果表明,长期高脂饮食及给予茯苓不同提取物对小鼠肠道菌群丰度和多样性影响较小。

表2 茯苓提取物对肠道菌群α多样性的影响
3.5.2茯苓提取物对高脂饮食小鼠肠道菌群门水平的影响 茯苓提取物对高脂饮食小鼠肠道菌群门水平结构影响见图4。40个样品共计得到203个OUT,归属于9个菌门,其中小鼠肠道微生物归主要属于厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和脱铁杆菌门(Deferribacteres)。分析结果显示,与对照组比较,长期高脂饮食可显著提高厚壁菌门相对丰度,降低拟杆菌门相对丰度(P<0.05)。与模型组比较,茯苓不同提取物均可不同程度降低厚壁菌门相对丰度,提高拟杆菌门相对丰度,其中PCS组差异有统计学意义(P<0.05,P<0.01)。

图4 茯苓提取物对高脂饮食小鼠肠道菌群门水平的影响
3.5.3茯苓提取物对高脂饮食小鼠肠道菌群属水平的影响 茯苓提取物对高脂饮食小鼠肠道菌群属水平结构影响见图5。小鼠肠道微生物归属于20多个菌属,其中平均质量分数>1.0%的菌属有AF12、乳杆菌属(Lactobacillus)、颤螺旋菌属(Oscillospira)、瘤胃球菌属(Ruminococcus)、Odoribacter、拟杆菌属(Bacteroides)、普氏菌属(Prevotella)、[Ruminococcus]、粪球菌属(Coprococcus)、Dehalobacterium、Dorea、Mucispirillum和[Prevotella]等。统计分析结果显示,与对照组比较,长期高脂饮食可显著降低乳杆菌属相对丰度(P<0.01)、显著升高颤螺旋菌属相对丰度(P<0.01);与模型组比较,PCA和PCS可显著提高乳杆菌属相对丰度(P<0.05),茯苓各提取物均可显著降低颤螺旋菌属相对丰度(P<0.01),PCW可显著提高瘤胃球菌属相对丰度(P<0.05),PCS可显著降低瘤胃球菌属相对丰度(P<0.05)。
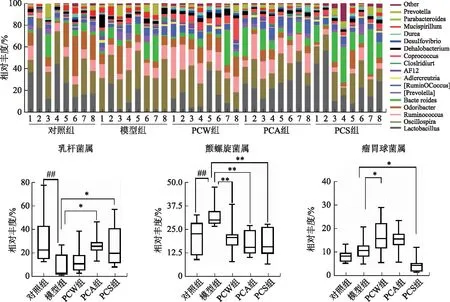
图5 茯苓提取物对高脂饮食小鼠肠道菌群属水平的影响
4 讨论
随着经济水平的提高,富含脂肪类的肉类等食品在日常膳食中的比重日益提高,可提供足够的能量及优质蛋白,但长期高脂饮食所引起的问题也日益凸显,尤其是改变肠道菌群结构,破坏菌群与宿主间平衡,并由此引发肥胖、高血脂等系列代谢性疾病。本研究采用高脂饮食制备肠道菌群失调及肥胖小鼠模型,与对照组比较,各组小鼠未出现食量下降、体质量降低、毛发灰暗粗糙等现象。但相对模型组,茯苓提取物组小鼠毛发更光亮。连续高脂饲料饲喂2个月后,模型组小鼠体质量显著高于对照组。给予茯苓提取物干预5周,各组小鼠体质量及体质量差值均低于模型组,其中PCW效果最显著(P<0.05),说明茯苓提取物对高脂饮食诱导肥胖具有一定抵抗作用。茯苓提取物对小鼠血清脂质代谢指标及肝组织病理形态的影响表明,长期高脂饮食诱使小鼠脂质代谢失常及脂肪在肝脏堆积,而茯苓不同提取物呈现出不同程度的改善脂质代谢、减少脂质在肝脏堆积的作用,说明茯苓提取物具有调血脂及护肝作用,其中PCW效果最好,这可能与其中多糖和蛋白含量最高有密切关系。
研究表明[1-2],肥胖个体肠道菌群异于正常个体,而饮食所致肠道菌群失衡与肥胖、高血脂等慢性代谢性疾病密切相关。小肠是机体最重要的营养消化吸收场所,小肠绒毛是小肠内表面环形皱襞上的众多绒毛状的突起,可增大小肠吸收面积,其结构好坏与营养物质的吸收密切相关,绒毛越长,吸收能力越强[20]。本研究中,长期高脂饮食使小肠黏膜显著变薄,绒毛残缺变短,排列疏松,肠道菌群结构发生显著变化,门水平上,厚壁菌门相对丰度显著升高,拟杆菌门相对丰度显著降低,这与以往研究[4,21]结果一致;属水平上,长期高脂饮食可使乳杆菌属相对丰度显著降低,而PCA和PCS可以显著提升乳杆菌属相对丰度,乳杆菌属多为肠道有益菌,其代谢产生的乳酸等有机酸可降低肠道pH,促进专性厌氧菌在肠道定植,抑制腐败有害菌繁殖,调节肠道功能[22-23]。模型组小鼠肠道中颤螺旋菌属相对丰度显著升高,而各茯苓提取物可显著降低颤螺旋菌属相对丰度,使其回归正常水平。总之,茯苓提取物可能通过修复小肠绒毛、调节肠道菌群组成和结构达到改善高脂饮食诱导肠道菌群失调的目的。
长期定向饮食或摄入膳食补充剂可显著影响肠道菌群组成和结构[24-26]。饮食中的低聚糖、多糖等成分虽无法被机体利用,但可作为肠道微生物的碳源和益生元,提高肠道有益菌水平,对诸多疾病模型肠道菌群均会产生一定影响[27-28]。如龙眼多糖可有效改变小鼠肠道菌群结构,提高琥珀酸、乙酸、丙酸和丁酸等肠道菌群代谢物水平,并能显著改善小鼠免疫指标[29]。茯苓及其固态发酵物均对肠道正常菌群有扶植作用,可显著提高双歧杆菌的水平,可作为一种有效益生元[30-31]。本研究采用3种不同茯苓提取物,探讨其对高脂饮食诱导的肠道菌群失调的影响。结果表明,与模型组比较,茯苓3种提取物均能有效改善脂质代谢,修复肠道屏障(小肠绒毛),调整肠道菌群结构,提高乳杆菌属等潜在有益菌数量,通过对上述多项指标综合分析推断,茯苓提取物可能是通过调节肠道菌群结构来实现调脂、护肝、改善肠道微生态的作用。本研究虽验证了茯苓不同提取物对高脂饮食诱导小鼠脂代谢和肠道菌群结构的影响,但其作用机制仍需进一步研究。
