PGPR 菌剂对辣椒的促生效应及根际土壤细菌的响应研究
2021-01-04黄文茂詹永发韩丽珍
黄文茂,詹永发,王 欢,韩丽珍*
(1.贵州大学生命科学学院,贵州 贵阳 550025;2.贵州省农业科学院辣椒研究所,贵州 贵阳 550006)
根际土壤微生物(Rhizosphere Soil Microorganism)在根际土壤中扮演着至关重要的角色,与植物共同构成了复杂的土壤生态系统。微生物在土壤中的生命代谢活动是土壤矿物养分循环和能量转换的驱动力,对维持土壤肥力作出了巨大的贡献[1]。因此,评价土壤肥力或土壤质量优劣时,不仅以土壤微生物及功能菌群的数量作为指标,还常常以土壤中的微生物种群多样性作为重要的评价指标[2]。根际土壤微生物的种群多样性受多种因素影响,除了土壤理化因子[3]和植物释放到土壤中的一些根系分泌物外[4],人工施肥对土壤微生物群落结构也有显著影响,且微生物群体随着施肥类型和施肥量的不同而有所变化[5-7],而外施微生物菌剂也会影响土壤的微生物多样性。
辣椒(Chilli),茄科辣椒属植物,因其果实具调味功能且营养丰富而备受青睐,是全球种植面积最广的蔬菜作物之一。近年来市场需求量的激增和土壤日益恶化,使研究者将重心放在辣椒高产品种选育和肥料控释技术两个方向上,但新品种的选育过程繁琐而费时,肥料控释技术又无法从根源上改善土质。因此,微生物菌剂作为一种新型肥料,由于其在促进作物增产的同时,还能有效改善土壤状况,防止土壤退化而引起人们的重视[8]。
植物根际促生菌(Plant Growth Promoting Rhizobacteria,简称PGPR)是一类环境友好且对植物生长有利的微生物类群,现已被开发成各种剂型菌剂施加到作物上,并取得了预期效果。PGPR 主要分布于植物根际周围,是根际土壤微生物群落结构的重要组成部分。根据其在植物根际的定植位置可分为胞内PGPR(Intracellular PGPR,iPGPR)和胞外PGPR(Extracellular PGPR,ePGPR)两类[9],iPGPR 通常存在于植株根部某些特定的组织或细胞内,通过分泌生长素(Indole-3-acetic Acid,IAA)、赤霉素(Gibberellin,GA)、细胞分裂素(Cytokinin,CTK)等生长激素促进植株生长[10-11];ePGPR 则主要定植于根表皮及根围土壤中,绝大多数PGPR都属于这类定植方式,ePGPR 在土壤中的代谢活动一方面加快了土壤养分循环,促进植物对矿物营养的吸收,另一方面某些PGPR 还可以分泌具有抑菌作用的次生代谢物,诱导系统抗性,增强植物的抗病害能力[12]。在研究芽孢杆菌属两个菌株B. licheniformisCECT 5106 和B. pumilusCECT 5105对意大利石松(Pinus pineaL.)幼苗的促生作用时,Probanza 提出“PGPR 改变根际土壤微生物群落结构是其另一种促生机制”的假说[13],遗憾的是,至今鲜有相关研究证明。尽管也有文献报道外施微生物制剂可以改变植物根际土壤微生物群落结构[14-16],但在田间种植辣椒的根际土壤微生物对外施微生物菌剂如何响应尚未可知。本研究以4 株具优良促生能力的PGPR 菌株制成液体复合菌剂在田间条件下进行辣椒接种,通过功能菌群数量的改变分析外施PGPR 菌剂对根际土壤微生物的影响,并进一步利用高通量测序技术深入探究辣椒根际细菌群落对复合菌剂灌根的响应,以及细菌群落结构的变化与辣椒促生之间的相关性,为解析PGPR 菌剂对辣椒的田间促生机制提供理论依据。
1 材料与方法
1.1 供试菌株及试验材料
供试菌株是由本实验室前期分离纯化得到的4株具有优良促生性能的菌株:HGD3(Pseudomonas putida)、HGD12(Bacillus flexus)、HP9(Bacillus velezensis)、HP10(Bacillus firmus)。试验所用辣椒品种名为遵辣9 号,由贵州省遵义市农业科学院选育提供。
1.2 试验大田概况
试验大田位于贵州省遵义市播州区枫香镇枫元村堰塘组(E106°34′23″,N27°35′29″),所处纬度较低,常年日照充足,雨量充沛。大田土壤类型为黄壤,前茬作物为豇豆和蚕豆。试验处理前土壤理化指标如下:有机质含量36.57 g/kg,全氮2.16 g/kg,全磷1.28 g/kg,全钾13.53 g/kg,碱解氮164 mg/kg,有效磷74 mg/kg,速效钾150 mg/kg。
1.3 PGPR 复合菌剂的制备
分别按1%接种量将各菌株甘油保种液接种至LB 培养基(Luria-bertani)中,180 r/min,30℃恒温摇床过夜培养活化,再以5%接种量将活化菌液转接至新鲜LB 培养基中扩培24 h,离心去上清并以新鲜LB 培养基重悬菌体,调节有效活菌数浓度为1010cfu/mL,等量混合备用,施用前以自来水稀释25 倍后浇灌。
1.4 试验设计及样品采集
以全量化肥为对照(CK),试验共设计了2 个处理:PGPR 菌剂+全量化肥(PGPR-CF1);PGPR菌剂+80%化肥(PGPR-CF2)。其中全量化肥标准为:化肥(总养分≥45.0%,N-P2O5-K2O:15-15-15) 750 kg/hm2,磷酸二铵(总养分≥64.0%,N-P2O5-K2O:18-46-0) 300 kg/hm2,各处理分别设置3 个重复。育苗按常规措施进行,幼苗移栽时间为2018 年4 月20 日,选取长势一致的辣椒幼苗,采用错位种植法进行种植,每处理种植两垄,每垄种植两行,垄间距0.6 m,株间距0.5 m。起垄时施加化肥,PGPR 菌液于幼苗移栽后7、30、60 d 对辣椒进行灌根(每株100 mL)。
在盛果期采集土壤,根际土壤采集参照Courchesne F 等方法[17],每个重复随机采集3 株辣椒的根际土壤50 g 混匀作为一份土样,装入无菌自封袋密封,作好标记并立即放入冰盒带回实验室。土样细菌多样性分析由深圳华大基因科技服务有限公司进行。
1.5 辣椒产量指标测定
辣椒采收期为2018 年7 月28 日至11 月1 日,共采收5 次。统计每轮采摘期各重复所摘辣椒重量,采收结束后计算辣椒的单株挂果数、单株产量,并对辣椒单果重量进行统计。
1.6 根际土壤细菌和功能菌群数量的测定
辣椒根际土壤细菌总数和功能菌群(溶磷菌、固氮菌、解钾菌)数量通过稀释平板涂布法完成。细菌计数培养基为LB 琼脂培养基,溶磷菌计数培养基为Pikovaskaia's(PKO)无机磷琼脂培养基,固氮菌计数培养基为阿须贝氏琼脂培养基,解钾菌计数培养基为硅酸盐细菌培养基。
1.7 根际土壤细菌DNA 提取及高通量测序数据处理
根际土壤细菌总DNA 采用试剂盒(Power Soil®DNA Isolate Kit,美国Mobio)进行提取并纯化。DNA提取纯化完成后,以带Barcode 序列的特异引物进行细菌16S rRNA 基因V3-V4 区的PCR 扩增,引物序列分别如下:515F:5’-GTGCCAGCMGCCGCGGTAA-3’;806R:5’-GGACTACHVGGGTWTCTAAT-3’,并采用Illumina-MiSeq 平台进行Paired-end 测序。
1.8 统计分析
通过Mothur(version:v.1.30.1)计算Alpha 多样性指数,并结合R 语言等相关软件绘制PCA 主成分分析图、物种profiling 面积图和柱状图、组间Alpha 多样性盒形图等。不同处理间的差异显著性检验通过SPSS 20.0 进行One way-ANOVA 及Duncan 检验,辣椒产量、挂果数与土壤细菌Alpha多样性指数之间的相关性通过Pearson(2-tailed)分析得到,并采用Office 2019 进行数据处理。
2 结果与分析
2.1 施加PGPR 菌剂对辣椒产量指标的影响
对辣椒单果重量分析表明,施加PGPR 菌剂对果实增重具有显著促进作用,其中,施加PGPR 菌剂的全量化肥组(PGPR-CF1)单果重较对照增加11.88%,80%化肥组的PGPR 处理(PGPR-CF2)增加14.36%。同时,施加PGPR 菌剂均可以促进辣椒单株挂果数增多和单株产量的增加,PGPRCF1 与PGPR-CF2 的单株产量较对照分别提高28.74%和22.10%(表1)。
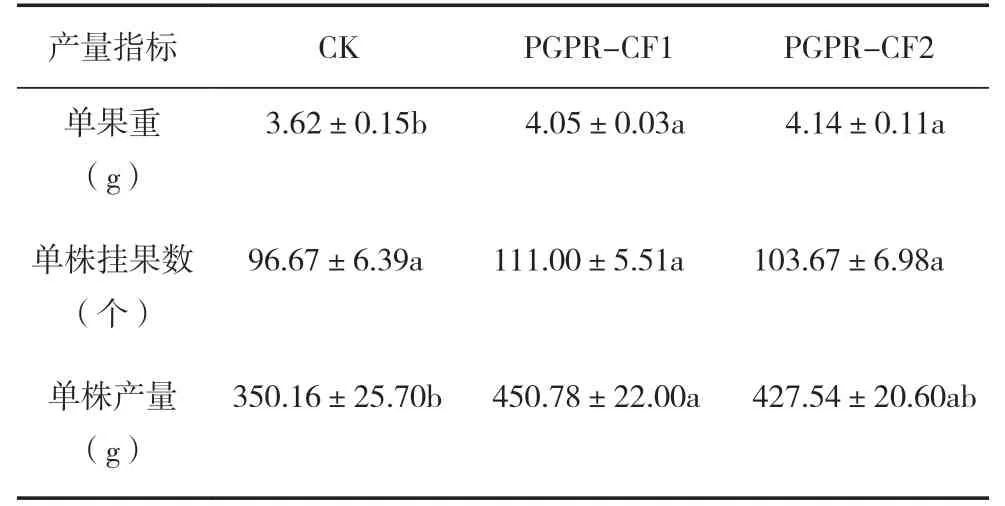
表1 不同施肥处理的辣椒产量变化
2.2 施加PGPR 菌剂对根际土壤细菌及功能菌群数量的影响
辣椒根际土壤中细菌数量和功能菌群数量的分析结果(表2)表明,施加PGPR 菌剂显著影响辣椒根际土壤细菌数量和功能菌群数量(P<0.05)。与CK 相 比,PGPR-CF1 和PGPR-CF2 处 理 组 的细菌总量分别提高了3.02 和2.82 倍。经PGPR菌剂处理后,根际土壤功能菌群数量显著提高(P<0.05),处理组的溶磷菌和固氮菌数量均显著高于CK,其中溶磷菌提高约4 倍,固氮菌提高约9 ~10 倍;而PGPR-CF1 和PGPR-CF2处理根际土壤解钾菌的数量比CK 分别增加了168%和195%。

表2 不同施肥处理的辣椒根际土壤功能菌群数量
2.3 施加PGPR 菌剂对辣椒根际土壤细菌Alpha 多样性的影响
9 个根际土壤样本经Illumina MiSeq 平台测序后一共得到有效序列573 896 条,平均每个样本63 766 条,在97%相似度下将得到的序列聚类共得到3 164 个OTUs,各土样OTUs 数量分别为2 153 个(CK)、2 337 个(PGPR-CF1)、2 358 个(PGPR-CF2) (表3),所有土壤样本的测序覆盖率均达到了0.98 以上(图1a),说明土样中细菌已基本完全被测出,该测序深度能够比较真实地反映土壤细菌的群落组成结构。
Alpha 多样性指数(Chao1 指数、Ace 指数、Shannon 指数、Simpson 指数等)能够表征物种的多样性及物种丰度。对PGPR 菌剂灌根后辣椒根际土壤细菌的Alpha 多样性分析结果见表3。配对t检验(图1b),PGPR 菌剂灌根能够增加辣椒根际土壤的细菌物种数量,但差异不显著(P>0.05),相 比 于CK,PGPR-CF1 和PGPR-CF2 根 际 土 壤中可观察到的物种数分别增加了184 和205 个。Chao1 指数和Ace 指数表明,PGPR 菌剂灌根的辣椒根际土壤细菌丰富度均高于单施全量化肥,以PGPR-CF2 处理组的细菌丰富度最高;PGPR 菌剂处理组Shannon 指数均高于对照,表明PGPR 菌剂能够增加辣椒根际土壤细菌的群落多样性;但CK和PGPR-CF1 组的Simpson 指数基本相同,PGPRCF2 处理组的Simpson 指数最低,表明化肥减量且PGPR 菌剂的处理组中,根际土壤细菌优势度更高,化肥施加量可能对根际土壤优势种群有一定的影响。
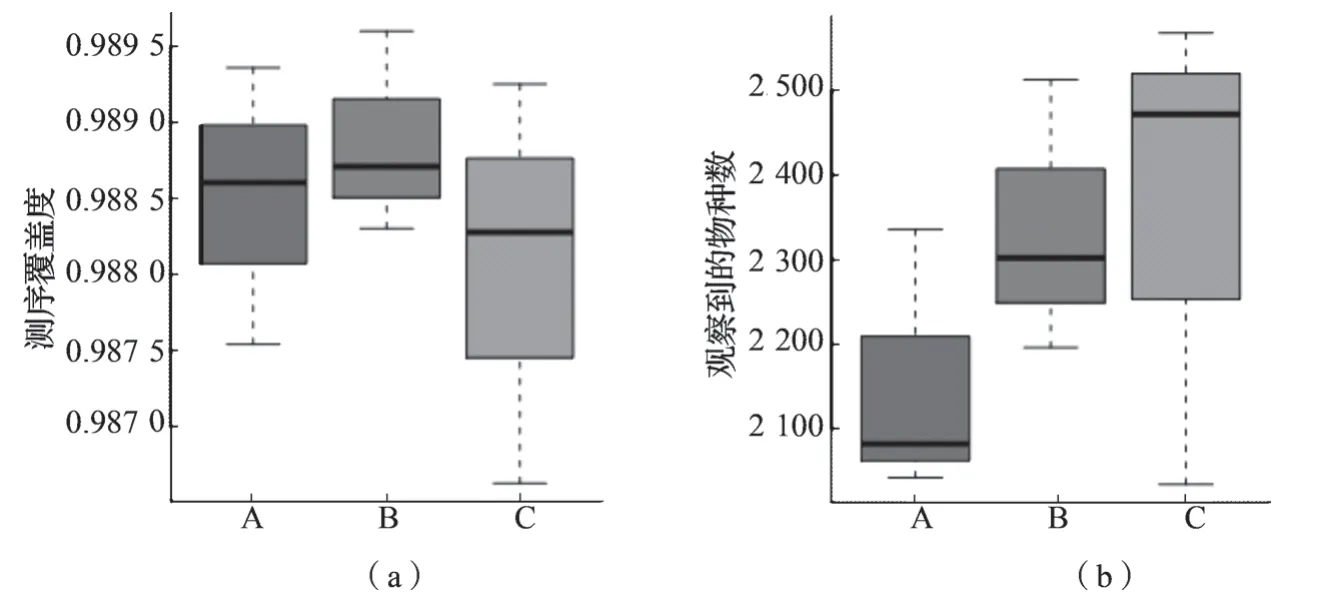
图1 不同施肥处理辣椒根际土壤所观察到测序深度及物种数的盒形图
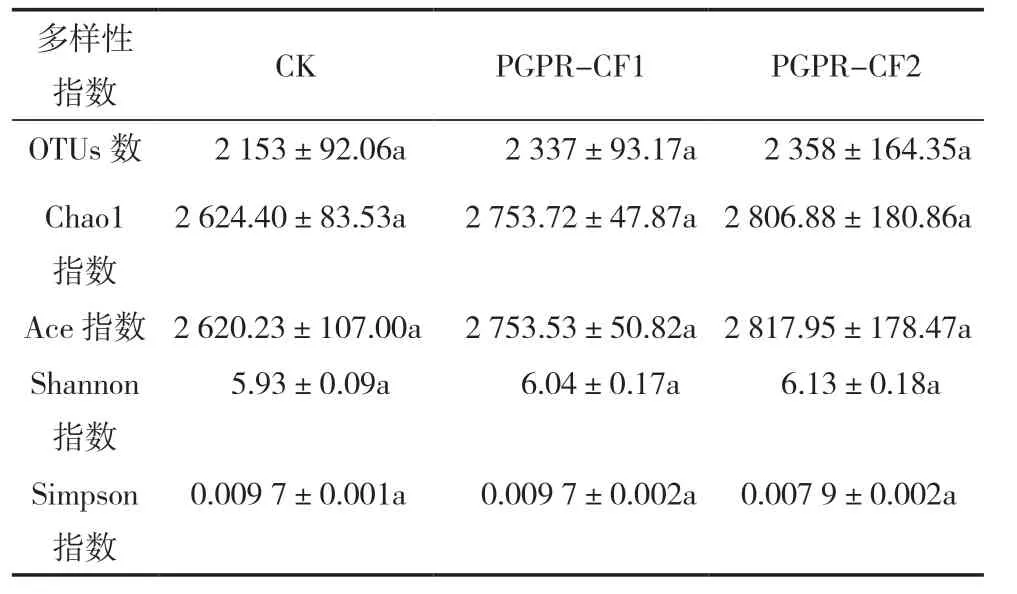
表3 不同施肥处理的辣椒根际土壤细菌Alpha 多样性指数

图2 不同施肥处理辣椒根际土壤细菌在门水平上的相对丰度
2.4 辣椒根际土壤细菌群落组成结构差异
对比数据库Greengene_2013_5_99,对所有土样测得3 164 个OTUs 对应的物种信息进行分类统计,归属到37 个门;其中CK 和PGPR-CF1 分别检 测 到34 门,PGPR-CF2 检 测 到36 门( 图2)。Candidate division OP3 是PGPR 菌剂灌根处理土壤独有的门,Thermi 和NKB19 是PGPR-CF2 独有的门,GN02 是CK 和PGPR-CF1 共有的门。
在3 个实验组中,相对丰度大于1%的有13个门,分别为酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、泉古菌门(Crenarchaeota)、蓝藻门(Cyanobacteria)、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)、硝化螺旋菌门(Nitrospirae)、浮霉菌门(Planctomycetes)、变形菌门(Proteobacteria)、TM7 和疣微菌门(Verrucomicrobia)。其中,酸杆菌门、放线菌门、拟杆菌门、绿弯菌门、浮霉菌门和变形菌门为辣椒根际土壤中的优势门,在辣椒根际土壤中累计分别占细菌总数的83.7%(PGPR-CF1)、79.55%(PGPR-CF2)和79.77%(CK)。
但是,不同处理组部分细菌类群的相对丰度发生改变,PGPR-CF1 和PGPR-CF2 辣椒根际土壤中拟杆菌门的相对丰度较对照分别增加了10.11%和39.28%,厚壁菌门的相对丰度分别增加了12.64%和37.33%;PGPR 菌剂灌根土壤芽单胞菌门、蓝藻门和柔膜菌门(Tenericutes)呈现下降趋势,以芽单胞菌门下降最明显,PGPR-CF1 下降了21.44%,PGPR-CF2 下降了13.29%。显然,PGPR 菌剂的处理改变了土壤中原有细菌群落的结构。
在目水平上对辣椒根际土壤细菌群落组成结构进一步分析,所有土样共检测到42 个目(图3)。菌剂处理组细菌相对丰度最高的是鞘氨醇杆菌目(PGPR-CF1,9.27%;PGPR-CF2,7.42%),而全量化肥(对照)组根际土壤中为酸杆菌目(CK,9.05%);另外,相对丰度大于5%的细菌目在CK 中还包括Solibacterales(6.12%)和鞘氨醇杆菌目(7.96%),而在PGPR-CF1 和PGPR-CF2 处理组中,相对丰度大于5%的细菌类群还包括酸杆菌目(7.93%,6.71%)、Solibacterales(6.89%,5.28%)、腐生螺旋体菌目(5.48%,6.76%),WD2101(PGPRCF1,5.13%)和iii1-15(PGPR-CF2,6.21%)的相对丰度也大于5%,PGPR 菌剂处理的辣椒根际土壤中表现出更为丰富的细菌群落结构。此外,在PGPR菌剂灌根的辣椒根际土壤中,部分类群的相对丰度发生改变,具体而言,芽孢杆菌目(Bacillales)、伯克霍尔德氏菌目(Burkholderiales)、红螺菌目(Rhodospirillales)、腐生螺旋体菌目(Saprospirales)、鞘氨醇杆菌目(Sphingobacteriales)、黄单胞菌目(Xanthomonadales)所占比例均有所增大,而酸杆菌目(Acidobacteriales)、黄杆菌目(Flavobacteriales)、Ellin5290、Ellin6067、芽单胞菌目(Gemmatimonadales)、MND1、Thermogemmatisporales 相对丰度则有所下降(表4)。
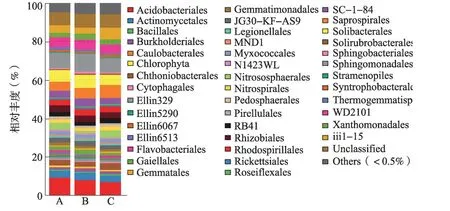
图3 不同施肥处理辣椒根际土壤细菌在目水平上的相对丰度
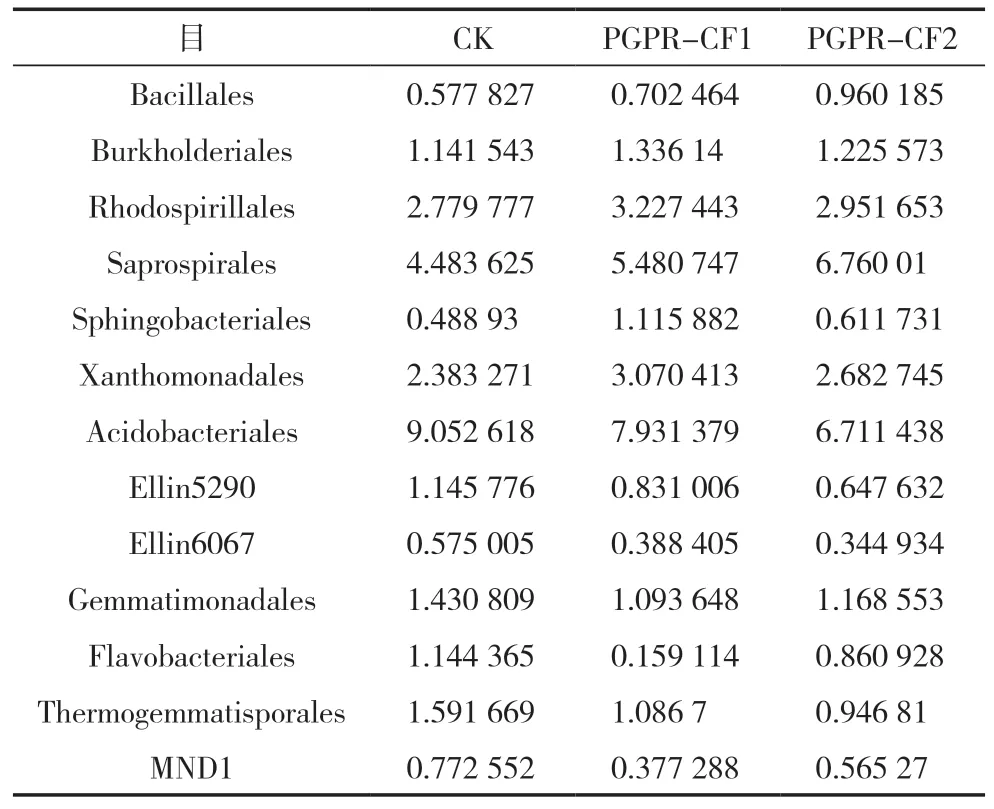
表4 不同施肥处理辣椒根际土壤细菌在目水平上的变化 (%)
2.5 辣椒根际土壤细菌主成分分析
基于OTUs 丰度进行主坐标分析(PCA),评估PGPR 菌剂灌根对辣椒根际土壤细菌群落结构的影响。PC1 和PC2 是解释不同处理土壤样本间差异性的主要成分,解释度分别为38.07%和20.72%(图4)。不同施肥处理辣椒根际土壤细菌的群落结构差异明显,图中PGPR-CF1 与PGPR-CF2 的距离在PC1 上相距较远,在PC2 上距离较近;而CK与PGPR-CF1 在PC1 上的距离更近,表明菌剂和化肥的施用共同影响了辣椒根际土壤细菌群落结构,且化肥用量的提高可对根际土壤细菌群落结构造成更大的影响。
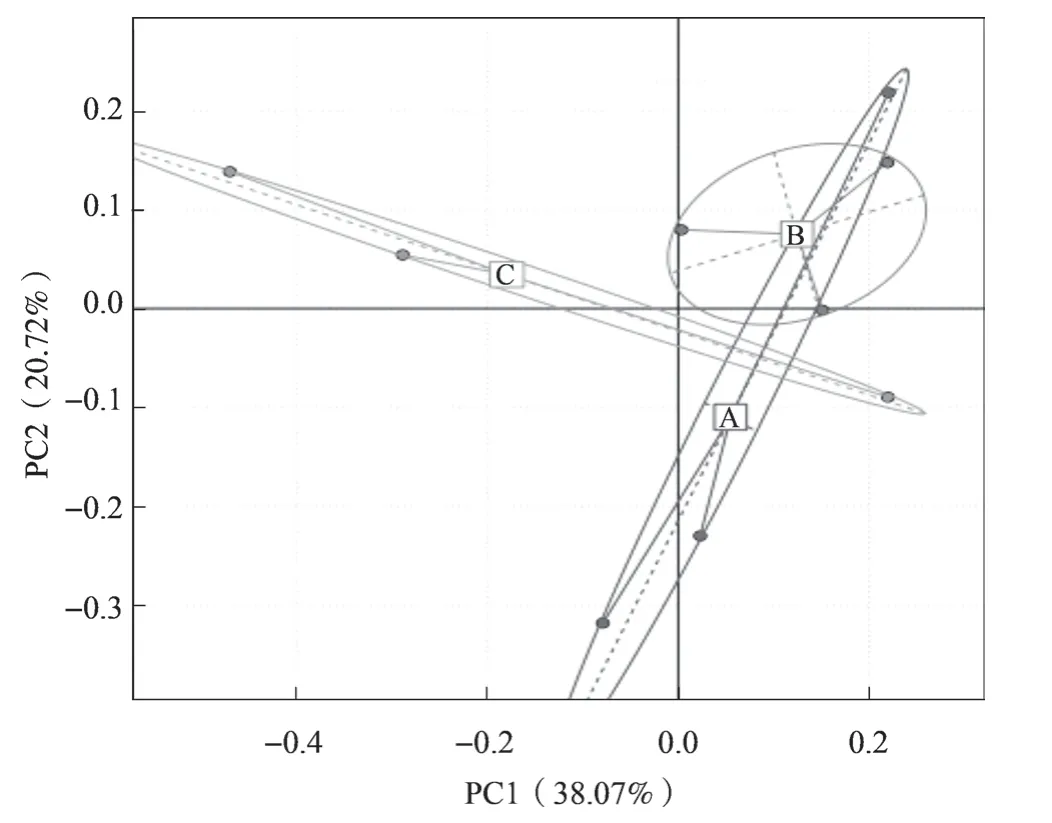
图4 不同施肥处理辣椒根际细菌的PCA 分析
2.6 根际土壤细菌多样性和产量指标之间的关系
对PGPR 菌剂灌根辣椒根际土壤细菌多样性与产量指标之间的相关性分析(表5)表明,根际土壤细菌Alpha 多样性的Chao1、Ace、Shannon 指数与单果重量、单株挂果数、单株产量呈正相关关系,但不显著(P>0.05);Simpson 指数与单果重量呈负相关,相关性不显著(P>0.05),但与单株挂果数、单株产量之间没有相关性。
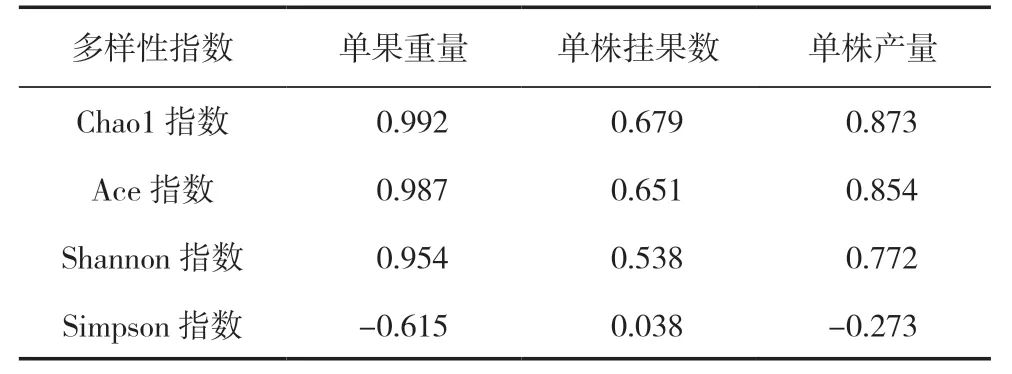
表5 辣椒产量指标与根际土壤细菌Alpha 多样性指数之间的相关性
3 讨论
以植物生长促进菌制成的微生物菌剂是目前研究较多的生物肥料之一,其富含功能微生物,在农林业生产上发挥着修复土壤,维持土壤肥力和促进增产等作用[18]。近年来国内外研究人员大多关注PGPR 菌株在实验室条件下促生效果及机制的研究[11,19-20],而大田条件下促生菌对辣椒促生增产及根际土壤微生物群落结构影响的报道很少。本文利用PGPR 菌剂和化肥配施,在田间条件下对辣椒的产量、辣椒根际土壤细菌数量、功能菌群数及细菌群落结构进行了系统地研究。结果表明,施加PGPR 菌剂的2 个处理组中,辣椒单果重、单株挂果数及单株产量均较全量化肥(CK)有不同程度的提高,表明PGPR 菌剂的施加提高了辣椒产量。细菌数及功能菌群数测定的结果显示,施加PGPR菌剂明显提高了辣椒盛果期根际土壤中细菌、溶磷菌、固氮菌和解钾菌的数量。从细菌数量上来看,100%化肥配施PGPR 菌剂相对高于80%化肥配施PGPR 菌剂,这可能是全量化肥条件下引起土壤化学成分的改变,为微生物的代谢提供了营养来源,刺激土壤中微生物活性的提高,从而引起细菌代谢加快,数量提高[21-22]。
本文采用灌根的方法,研究了PGPR 菌剂对辣椒根际土壤细菌多样性及群落结构的影响。高通量测序结果显示,PGPR 菌剂灌根改善了辣椒根际土壤细菌的物种丰度和多样性,其中PGPR-CF2 处理根际土壤细菌多样性最高,PGPR-CF1 处理次之,CK 处理最差,这与雷先德等[5]的研究结论一致。表明PGPR 菌剂能够在一定程度上维持和提高根际土壤细菌丰度和多样性;Simpson 指数表明,全量化肥配施PGPR 菌剂及单施全量化肥条件下,根际土壤细菌的物种优势度相对高于配施80%化肥的菌剂组,前人研究表明[23-24],施肥对土壤微生物群体变化影响较大,不同施肥量引起的C/N 变化影响了土壤微生物活性,氮肥虽然不支持细菌生长,但当氮肥与易分解底物结合时,有利于土壤中某些优势细菌种群的生长,加快了这类细菌的新陈代谢,从而促进其大量繁殖。
对根际土壤细菌群落结构的分析发现,不同施肥处理的辣椒根际土壤细菌群落结构具有一定的相似性,表现为主要的优势菌门为酸杆菌门、放线菌门、拟杆菌门、绿弯菌门、芽单胞菌门、变形菌门和疣微菌门等7 个类群;但相较于对照,经微生物菌剂处理后细菌的群落结构又有所差异,贺国强等[25]利用解磷固氮复合菌剂研究其对小麦根际土壤细菌群落的影响时发现,解磷固氮复合菌剂降低了芽单胞菌门的相对丰度,这与本研究结论一致,但与蓝藻门相对丰度减少的结论有所差别,也有研究表明蓝藻的丰度因土壤类型、养分和采样期温度等不同而呈现一定差异[26-27]。此外,PGPR 菌剂处理的两种土壤样本中均检测到了Candidate division OP3,CK 处理中并未发现,但在PGPR-CF1 和CK处理中检测到了GN02,PGPR-CF2 中单独检测到Thermi 和NKB19,结合主成分分析(PCA)可知,辣椒根际土壤细菌群落结构的变化与PGPR 菌剂和化肥量有关。
不同施肥处理辣椒根际土壤细菌群落结构在目水平差异也较大。2 个PGPR 菌剂灌根处理组相对丰度最高的是鞘氨醇杆菌目,而全量化肥组相对丰度最高的酸杆菌目。在以往的文献[28-31]中多次报道了鞘氨醇杆菌目的某些种属(Sphingobacteriumsp.,Sphingobacterium pakistanensissp. nov.,Sphingobacterium canadense)可 以 产 生IAA、ACC 脱 氨酶、铁载体等,具有显著的促生特性,而根际土壤中具有促生功能的相关菌群丰度提高,也可能是辣椒产量增高的原因之一。本研究发现,PGPR 菌剂灌根处理中酸杆菌目的相对丰度均低于常规处理。Kalam 等[28]研究表明,接种PGPR 后,番茄和黑豆根际土壤酸杆菌数量在60 d 内总体增加;但最近一项研究显示,滴施含枯草芽孢杆菌(Bacillus subtilis)和荧光假单胞菌(Pseudomonas fluorescens)的可湿性粉剂、哈茨木霉(Trichoderma harzianum)菌剂以及含枯草芽孢杆菌(B. subtilis)、胶质芽孢杆菌(B. licheniformis)、巨大芽孢杆菌(B. megaterium)的复合菌等不同生物菌剂后,棉花根际土壤酸杆菌的丰度均表现降低[32];显然,不同微生物菌剂对根际土壤酸杆菌的种群密度影响尚有争论。此外,PGPR 菌剂灌根还增加了辣椒根际土壤中芽孢杆菌目(Bacillales)的相对丰度,本研究所采用菌剂包含的菌株HP10、HP9、HGD12 均属于该细菌目,这可能是接种的芽孢杆菌属菌株定殖到根际土壤中,或者是菌剂的施加活化了根际土壤中芽孢杆菌目的细菌所致。本研究的PGPR 菌剂中,HGD3 为假单胞菌属菌株,虽然两种处理的根际土壤中均未检测到Pseudomonassp.,但有研究表明,自然界中存在某些PGPR,它们在根际土壤中的存活时间不长,但其对土壤细菌群落结构的影响不可忽视[33]。土壤微生物之间相互作用,关系错综复杂,加之田间土壤环境影响因素复杂多变,不同成分的微生物菌剂与土壤原住物种之间的竞争与掠食关系等[34-35],所引起的土壤细菌消减增涨效应也有所不同。鉴于此,可通过盆栽试验以避免复杂的田间环境因素,进一步探究根际土壤细菌对微生物菌剂的响应。
根际土壤微生物群落多样性是提高农田土壤的稳定性、生产力和可持续性[36-38]的基础,根际土壤微生物群落结构变化决定了作物生长状况的优良。Ramos 等[39]研究表明,接种地衣芽孢杆菌(B.licheniformis)悬浮液对欧洲桤木(Alnus glutinosa)的促生效果与根际土壤微生物的响应幅度呈正相关关系,类似的研究在意大利石松幼苗[13]和豇豆[40]上也得到了相同的结果。本文对辣椒果实产量指标与根际土壤细菌多样性的Pearson 相关性分析发现,细菌多样性指数与单株产量之间呈正相关性,PGPR 菌剂处理后辣椒的单株产量提升明显,且单果重量显著提高。PGPR 菌剂灌根后辣椒根际土壤细菌群落结构的改变可能才是辣椒产量增加和果实品质提升的最主要原因,但具体的作用和机制还需进一步通过动态观察研究。
4 结论
通过PGPR 菌剂对辣椒进行灌根,显著提高了辣椒根际土壤中细菌及固氮、溶磷及解钾等功能菌群的数量,改善了辣椒根际土壤细菌的多样性和丰度,显著促进了辣椒产量的提升。
不同化肥量配施PGPR 菌剂,辣椒根际土壤细菌群落结构有所差异,表明化肥影响了辣椒根际土壤细菌群落结构,2 种处理组辣椒产量没有明显差异,且根际土壤细菌群落多样性和丰度均高于未施菌剂组。结果表明:PGPR 菌剂配施化肥在促进辣椒增产的同时,有利于维持并改善土壤细菌多样性,对提高土壤生产力和可持续性具有重要作用。
