丝胶蛋白及其复合材料在软骨和骨组织工程中的研究进展
2021-01-03刘苹戴梦男李蒙宋慧龚佳俊殷音王建南
刘苹 戴梦男 李蒙 宋慧 龚佳俊 殷音 王建南


摘要: 骨/软骨组织工程是结合医学与材料科学开发支架材料来治疗或替换坏损骨/软骨。丝胶蛋白生物学性能优异,在骨组织修复和软骨组织再生方面应用潜力巨大。研究显示,丝胶蛋白基骨组织工程支架可以促进细胞黏附与增殖、刺激胶原蛋白生成、并为磷酸钙提供成核位点来促进羟基磷灰石沉积;其溶液-凝胶转变特性为包埋的细胞提供合适的生存环境。因此,文章综述了丝胶蛋白及其复合物在骨/软骨组织工程中的研究背景,重点阐述了丝胶蛋白材料的制备、生物矿化、与干细胞相互作用及对惰性金属骨移植物表面修饰等方面的研究进展,并对今后丝胶蛋白在骨和软骨组织工程方面的研究方向和发展做出展望。
关键词: 丝胶蛋白;骨;软骨;复合材料;组织工程;组织再生
中图分类号: TS101.4;Q189
文献标志码: A
文章编号: 1001-7003(2021)12-0001-07
引用页码: 121101
DOI: 10.3969/j.issn.1001-7003.2021.12.001(篇序)
Abstract: Bone/cartilage tissue engineering is the combination of medical science and material science to develop scaffold materials for the treatment or replacement of bone/cartilage defects. Sericin with excellent biological properties has tremendous potential in bone/cartilage tissue repair and regeneration. Studies have shown that sericin-based bone tissue engineering scaffold can promote cell adhesion and proliferation, stimulate collagen production, and provide nucleation bond for calcium phosphate to promote hydroxyapatite deposition. The solution-gel transition characteristics of sericin provide a suitable living environment for the embedded cells. Therefore, this article reviewed the research background of sericin and its composites in bone/cartilage tissue engineering, emphasized on the research progress in the sericin materials preparation, biomineralization, interaction with stem cells, and surface finishing on inert metal bone grafts. Finally, the article prospected the future research direction and development of sericin in bone/cartilage tissue engineering.
Key words: sericin; bone; cartilage; composite material; tissue engineering; tissue regeneration
骨骼是人體内最重要的组织之一,能够提供机械支持,并在维持离子平衡方面发挥重要作用[1],软骨为关节运动提供所必需的结构和力学支持。意外事故和自身机能老化等都会造成骨缺损[2],并且随着人均预期寿命的增加与人口老龄化现象严重,人群中骨科疾病的发病率越来越高[3],对骨/软骨缺损修复的需求和难度也越来越大。据统计,全世界每年有约890万人发生骨科疾病[4],超过2 700万人有软骨损伤造成的骨关节炎疾病,截至2020年年底,中国骨科植入医疗器械行业市场规模约为304亿元[5]。
大部分的骨/软骨缺损都可以自我再生与修复,但是当损伤范围超出自身的再生能力时则需要进行骨移植,自体或异体骨移植是目前临床上最有效的方法[6],但需要进行手术获取组织,这可能导致供体部位出现损伤、畸形和瘢痕,也可能会导致出血、炎症或感染。异体骨移植还具有疾病传播和免疫排斥等潜在风险,应用受到限制。如果缺损过大,则供体来源可能不足,大多数缺损不能完全修复[7]。其他方法例如关节镜下清创术、微骨折术、镶嵌成形术等[8],也存在供区缺陷、感染和免疫反应及供区来源有限等问题[9]。鉴于以上的缺点和限制,骨/软骨组织工程越来越受到材料和医学科学家的极大关注,也呈现出极具潜力的应用前景。
1 骨/软骨组织工程
骨/软骨损伤的再生与修复是一个复杂的过程,不同类型的细胞、信号分子和基质蛋白共同作用于修复骨/软骨缺损。骨/软骨组织工程是一种最有希望的治疗方法[10],即将细胞接种在与天然骨/软骨性能相近的组织工程支架中,支架可作为细胞或生长因子的载体,体外培养后植入或体内诱导干细胞向骨/软骨细胞分化[11],或将组织工程支架植入捕获细胞/干细胞定植或分化。组织工程支架不仅可以为诱导骨/软骨缺损的再生与修复提供适宜的环境,还维持一定的空间结构和机械强度,为骨/软骨再生提供基本条件[12]。因此,作为支架的材料是骨组织工程的关键。
关于骨/软骨组织工程最早的研究可以追溯到19世纪初,医生尝试将磷酸钙用做骨移植材料[13]。随着材料的开发和研究技术的发展,组织工程材料从生物惰性材料(合成聚合物为主)开始向生物活性材料(天然聚合物为主)转变。生物活性材料可以为组织再生提供特定的结构,并增强与细胞之间的联系,以诱导受损组织再生与修复,但力学性能通常达不到要求。合成聚合物是当前骨/软骨组织工程研究的主要材料,可大规模生产和精确制造几何形状,通常力学性能优异但生物学性能欠佳,多数不降解或降解有可能产生一定的毒性。临床上广泛应用的金属材料是一种重要的骨移植材料,具有比组织工程材料更佳的力学性能,由于力学性能远高于天然骨,所以植入后不利于与骨组织之间的整合[14]。当前常用的骨/软骨组织工程支架材料如表1所示。
丝胶蛋白由于其优异的生物学性能,在生物医学领域受到了越来越多的关注。近年来,许多研究都在探索丝胶蛋白在骨/软骨组织再生中的应用。本文综述丝胶蛋白在骨/软骨组织工程中的研究进展。
2 丝胶蛋白
2.1 丝胶蛋白的组成
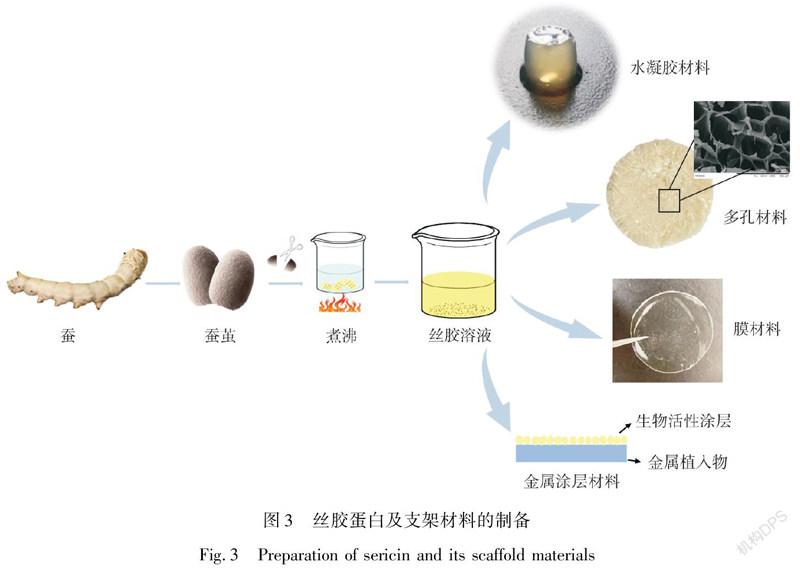
丝胶蛋白源于蚕丝,资源非常丰富,通常随着工业废水排出,造成了极大的浪费和环境污染。丝胶蛋白是由蚕的中部丝腺合成(图1,参考文献[39]重新绘制),当蚕的后部丝腺合成的丝素蛋白迁移至中部丝腺时,丝胶蛋白与丝素蛋白复合并包裹在丝素蛋白外围(图2)。丝胶蛋白占蚕丝质量的25%~30%[40],是一种水溶性球状蛋白,相对分子质量约为24~400 kDa,主要由18种氨基酸组成,其中含量较多的氨基酸为丝氨酸(Ser)和天门冬氨酸(Asp),分别约占33%和20%[16,41]。
丝胶蛋白的产量、相对分子质量,以及理化性质和生物活性都取决于其制备方法,目前常用的丝胶蛋白获得方法有高温热水法[16]、溴化锂法[42]、高压法[43]、碳酸钠法[44]、尿素法[45]及酸析法[46]等。
2.2 丝胶蛋白的生物学性能
天然的丝胶蛋白分子以无规线圈结构为主,是一种无定形材料。丝胶蛋白肽链上具有大量的氨基、羧基、羟基,使其具有许多优良的生物活性及功能改性的结构基础[47]。丝胶蛋白可抑制促炎因子的释放,减少炎症的发生,具有低免疫原性[44];丝胶蛋白可以代替培养基中的胎牛血清为细胞提供营养,促进细胞增殖,具有良好的生物相容性[48];丝胶蛋白可以清除细胞内的活性氧,抑制细胞凋亡从而具有抗氧化的效果[49];还有研究指出,丝胶蛋白具有原位荧光特性,为追踪丝胶蛋白材料在体内的变化提供便利[50]。
丝胶蛋白还具有保湿、美白和防晒等功效,是一种优质的化妆品添加剂,在美容护肤行业备受青睐[51]。除此之外,丝胶蛋白具有8种人体必需氨基酸,安全无毒,在功能性食品开发方面也有广泛的应用[52]。近年来,丝胶蛋白材料及其复合材料在生物医学和组织工程方面展现出了令人惊喜的应用潜力。其应用研究,包括用作干细胞和生长因子的载体、药物缓释基质及惰性移植物的涂层材料等已有较多的报道。
3 丝胶蛋白作为骨/软骨组织工程材料的研究进展
丝胶蛋白作为骨/软骨组织工程支架有水凝胶和多孔材料两种最主要的形式,其中水凝胶常用于软骨组织工程。丝胶蛋白中大量的丝氨酸和天门冬氨酸,所含亲水性基团—OH和—COOH赋予了丝胶蛋白高度亲水的性质,使其成为水凝胶制备的理想材料(图3)。同时可装载基因片段和小分子药物,用于仿生细胞外基质。形成丝胶蛋白水凝胶简单可行的物理方法有自组装法[18,20,40]和超声法[53],除此之外,化学交联也常用于制备丝胶蛋白凝胶支架,常用的化学交联试剂如戊二醛、京尼平等[15,17,21]。近年来,由于酶(如辣根过氧化物酶)催化反应制备的材料温和、无毒,已引起越来越多的关注[54]。
经冻干制备的丝胶蛋白海绵状多孔材料常用于骨组织工程支架[19,55](图3),冷冻干燥法通过冰晶的升华作用在三维支架内形成孔隙,材料完全可在水系环境中制备,避免了有机溶剂的使用。
除此之外,丝胶蛋白也可制备成膜材料来支持骨细胞的黏附和增殖[22]。丝胶蛋白中大量的极性基团便于与功能化的钛基质表面结合进行涂层改性,也是提高金属骨移植物生物活性的常见方法[35-36]。
3.1 3D丝胶蛋白支架
丝胶蛋白水凝胶含水量高、弹性好、生物大分子易扩散,网络结构良好,并能以极小的创口进行注射,与骨/软骨缺损形状相适应。丝胶蛋白本身也可作为细胞存活和增殖的营养来源,为骨/软骨组织再生提供基础[56-57]。Qi等[23]通过光交联制备了甲基丙烯酸丝胶蛋白水凝胶,接种的软骨细胞在该水凝胶中黏附、增殖良好,且其降解可以为细胞生存提供营养。将水凝胶皮下注射进雌性小鼠背部,结果显示该水凝胶内软骨细胞产生的细胞外基质主要成分糖胺聚糖和Ⅱ型胶原的含量明显提高,软骨形成标记物SOX9、Ⅱ型胶原α1和聚蛋白聚糖也都显著提高,并且其杨氏模量可达到2.53 MPa,接近于天然软骨。Chen等[17]制备了壳聚糖/丝胶蛋白/羟基磷灰石复合水凝胶,丝胶蛋白的加入使水凝胶的弹性模量和抗压强度增加,并且可以促进接种在材料上的人骨肉瘤细胞增殖。
丝胶蛋白多孔材料具有良好的吸水能力、降解能力等,孔隙结构为成骨细胞提供适宜的生长空间。方艳等[19]制备出丝胶蛋白/羟基磷灰石/聚己内酯复合支架材料,该复合材料良好的孔隙结构能满足骨细胞生长和黏附的要求,并未顯示出细胞毒性,可作为骨组织工程支架作进一步研究。王琳婷等[24]制备了不同配料比的丝胶蛋白/羟基磷灰石复合支架,当丝胶蛋白与羟基磷灰石质量比为5︰5时,支架具有最佳的机械性能和热稳定性,但孔隙率较低,不适宜细胞生存。
3.2 矿化模板
骨是自然界中生物矿化最复杂的材料之一。生物矿化是指由生物体中基因、细胞、蛋白和基质等有机体逐级调控生成无机矿物复杂的分级过程[58]。对骨组织工程来说,支架材料能诱导矿化、引导骨组织再生,并满足结构与机械性能的要求至关重要。丝胶蛋白中大量带负电荷氨基酸提供的—COOH可作为Ca2+的结合位点,已有研究证明丝胶蛋白矿化能够促进羟基磷灰石沉积[25-26],且丝胶蛋白能调控沉积的羟基磷灰石的晶体大小和形态[59]。
Zhang等[22]尝试在丝胶蛋白膜表面进行体外矿化试验,使磷灰石矿物在丝胶蛋白膜上沉积,随着矿化时间的延长,磷灰石矿物的沉积增多,虽然使得丝胶蛋白膜变硬变脆,但增加了播种在膜上的人骨肉瘤细胞的活力。Griffant等[10]利用胶原和丝胶蛋白制备了可注射水凝胶,不仅复合水凝胶中的细胞代谢活性明显高于纯胶原支架,而且体外矿化研究发现40%丝胶的掺入是促进矿化的最佳浓度,并且在第14天时羟基磷灰石沉积量接近90%。田伟[16]使用沸水脱胶方法制备了丝素/丝胶蛋白复合膜和多孔材料,两种材料在模拟体液中的矿化结果均显示,沸水脱胶时间较短(丝胶蛋白含量较多)的丝素/丝胶蛋白复合材料上的磷灰石矿物沉积明显高于脱胶时间较长(丝胶蛋白含量较少)的复合材料,说明了丝胶蛋白相比于丝素蛋白,更能促进磷灰石矿物的沉积。Veiga等[27]制备了羟基磷灰石/丝胶蛋白纳米复合材料,也指出复合材料中随着丝胶蛋白浓度的增加,羟基磷灰石沉积速度明显提高。Yang等[25]和Zhuang等[26]也都证明了丝胶蛋白可作为羟基磷灰石沉积和生长的模板,进一步促进人骨髓间充质干细胞的成骨分化。
3.3 干细胞支架材料
为了克服自体骨或异体骨移植的局限性,科研人员更深层次地探究基于细胞的治疗方法,而干细胞为最佳选择。干细胞是具有多向分化潜能、自我更新能力的细胞,是细胞起源最原始细胞[60]。组织工程常用的干细胞有胚胎干细胞和间充质干细胞,但胚胎干细胞的获得具有一定伦理学上的争议,故研究受限。而间充质干细胞可来源于骨髓、脂肪、脐血、外周血及肌肉组织等,获取相对容易,并且在特定条件下可向不同组织的细胞分化[61]。目前,骨/软骨组织工程中关于干细胞的研究越来越多,常用的是骨髓间充质干细胞[20,28-29],脂肪间充质干细胞也有报道[15],而其他间充质干细胞在骨/软骨组织工程中的应用鲜有报道。
Dinescu等[15]分别制备了透明质酸/丝胶蛋白/胶原和硫酸软骨素/丝胶蛋白/胶原凝胶支架,指出两种支架均可为脂肪间充质干细胞的黏附、增殖和成软骨分化提供适宜的环境,可望作为软骨组织工程支架作进一步研究,但添加达10%硫酸软骨素时复合水凝胶支架具有明显的细胞毒性。Wang等[20]通过基因工程技术将血小板源性生长因子PDGF-BB整合到丝胶蛋白的基因组中,使蚕吐出的蚕丝具有功能化的丝胶蛋白并且制备的丝胶蛋白水凝胶可以支持骨髓间充质干细胞的黏附和增殖,并显示出高的成骨细胞分化能力。他们将接种了骨髓间充质干细胞的水凝胶皮下注射进裸鼠侧腹,发现PDGF-BB功能化的丝胶水凝胶的骨形成更明显。Pankongadisak等[18]制备了壳聚糖/丝胶蛋白/磷酸甘油酯复合水凝胶,该水凝胶对小鼠胚胎成骨细胞前体细胞无细胞毒性,并可以提高细胞在水凝胶上的黏附和增值。Qi等[28]制备了丝胶蛋白/氧化石墨烯复合水凝胶,该水凝胶生物相容性、力学性能和降解性能优异,进一步将水凝胶植入小鼠颅骨缺损部位,发现氧化石墨烯/絲胶蛋白复合水凝胶可以促进自身的骨髓间充质干细胞迁移到损伤部位,不需要外源性刺激便可诱导干细胞成骨分化来进行骨再生。同样,Yuan等[29]在丝胶蛋白/还原氧化石墨烯纳米复合材料中接种骨髓间充质干细胞,细胞中反映软骨形成能力的总胶原、糖胺聚糖和Ⅱ型胶原分泌水平均明显提高,标志着材料中的骨髓间充质干细胞已向软骨细胞分化,认为该复合材料有望用于膝关节软骨的修复。
3.4 金属骨移植物涂层
钛及其合金无毒,具有良好的机械性能[62],作为骨科、牙科植入物、髋关节置换装置的关键材料,在生物医学领域的应用较为广泛。然而,金属骨植入物缺乏生物活性且易受细菌感染,在体内稳定性差还易诱发并发症[63]。丝胶蛋白优异的生物学性能可以用于金属骨的改性。Nayak等[35]为了活化钛基质,将丝胶蛋白和精氨酸-甘氨酸-天冬氨酸的三肽序列涂覆于基质表面。在生物体中,细胞与基质及周围细胞的接触是由细胞黏附受体介导的,而整合素就是数量最多、用途最广的受体。精氨酸-甘氨酸-天冬氨酸的三肽序列是最小的细胞黏附肽序列,存在于多种细胞外基质中,可与多种整合素特异性结合,促进细胞与细胞外基质及细胞间的黏附作用。研究发现,丝胶蛋白涂覆提高了钛基质的生物活性,促进了小鼠成骨细胞的黏附、增殖和分化能力。该研究组进一步将小鼠巨噬细胞单独接种或小鼠巨噬细胞与成骨细胞共同培养于钛基表面,发现各组细胞中的促炎因子白细胞介素1β和肿瘤坏死因子α的释放量都保持在正常水平,说明没有发生严重炎症反应,可以提高钛基骨植入物整合的有效性。Zhang等[36]用甲基丙烯酸作为桥梁,将丝胶蛋白接枝于钛基骨表面,提高了其成骨细胞的黏附和增殖,同时赋予了钛基骨表面一定的抗菌性能。
4 结论与展望
组织工程在过去几十年的时间内已经成为了坏损组织和器官修复极具潜力的手段,骨/软骨组织工程研究热点已经从需要二次手术更换的不可降解支架,转变为可调控细胞行为、促进细胞增殖和组织再生且无需取出的可降解生物活性支架。许多研究证明,丝胶蛋白是一种生物活性大分子,生物相容性好、免疫原性低等。丝胶蛋白基骨/软骨组织工程支架与人体组织结合良好并能诱导矿化和干细胞分化,在骨/软骨组织修复和再生方面将发挥不可估量的作用。但目前丝胶蛋白基的骨/软骨组织工程支架,无论是水凝胶还是多孔材料,主要挑战是机械性能的不足,不能满足骨/软骨组织暂时的力学替代要求。另外,制备过程中的一些不溶化手段可能会对细胞或肌体产生理化不良作用,尤其是水凝胶,这是组织工程支架研制与应用过程中需考虑的重要问题,需要通过长期体内试验才能验证。相信随着材料和化学科学的发展,将会出现更多生物安全性更高的丝胶蛋白及其复合材料的骨/软骨组织工程支架的构建策略,不仅能解决日益增多的骨/软骨组织坏死或缺损的临床需要,也将为减少丝绸工业的丝胶蛋白排放污染做出重大贡献。
參考文献:
[1]TAICHMAN R S. Blood and bone: Two tissues whose fates are intertwined to create the hematopoietic stem-cell niche[J]. Blood, 2005, 105(7): 2631-2639.
[2]IANNONE F, LAPADULA G. Phenotype of chondrocytes in osteoarthritis[J]. Biorheology, 2008, 45(3): 411-413.
[3]LANDI E, TAMPIERI A, CELOTTI G, et al. Sr-substituted hydroxyapatites for osteoporotic bone replacement[J]. Acta Biomaterialia, 2007, 3(6): 961-969.
[4]GMEZ-LIZRRAGA K K, FLORES-MORALES C, DEL PRADO-AUDELO M L, et al. Polycaprolactone-and polycaprolactone/ceramic-based 3D-bioplotted porous scaffolds for bone regeneration: A comparative study[J]. Materials Science & Engineering C-Materials for Biological Applications, 2017, 79: 326-335.
[5]王宝亭, 耿鸿武. 医疗器械蓝皮书: 中国医疗器械行业发展报告(2020)[M]. 北京: 社会科学文献出版社, 2020.
WANG Baoting, GENG Hongwu. Aunual Report on the Development of Medical Device Industry in China(2020)[M]. Beijing: Social Sciences Academic Press, 2020.
[6]SINGH Y P, MOSES J C, BHUNIA B K, et al. Hierarchically structured seamless silk scaffolds for osteochondral interface tissue engineering[J]. Journal of Materials Chemistry B, 2018, 6(36): 5671-5688.
[7]THORMANN U, RAY S, SOMMER U, et al. Bone formation induced by strontium modified calcium phosphate cement in critical-size metaphyseal fracture defects in ovariectomized rats[J]. Biomaterials, 2013, 34(34): 8589-8598.
[8]CHRISTENSEN B B, FOLDAGER C B, HANSEN O M, et al. A novel nano-structured porous polycaprolactone scaffold improves hyaline cartilage repair in a rabbit model compared to a collagen type Ⅰ/Ⅲ scaffold: In vitro and in vivo studies[J]. Knee Surgery Sports Traumatology Arthroscopy, 2012, 20(6): 1192-1204.
[9]LEVINGSTONE T J, MATSIKO A, DICKSON G R, et al. A biomimetic multi-layered collagen-based scaffold for osteochondral repair[J]. Acta Biomaterialia, 2014, 10(5): 1996-2004.
[10]GRIFFANTI G, JIANG W, NAZHAT S N. Bioinspired mineralization of a functionalized injectable dense collagen hydrogel through silk sericin incorporation[J]. Biomaterials Science, 2019, 7(3): 1064-1077.
[11]SINGH Y P, BHARDWAJ N, MANDAL B B. Potential of agarose/silk fibroin blended hydrogel for in vitro cartilage tissue engineering[J]. ACS Applied Materials & Interfaces, 2016, 8(33): 21236-21249.
[12]ZHANG Y, CAO Y, ZHANG L, et al. Fabrication of an injectable BMSC-laden double network hydrogel based on silk fibroin/PEG for cartilage repair[J]. Journal of Materials Chemistry B, 2020, 8(27): 5845-5848.
[13]DOROZHKIN S V. A detailed history of calcium orthophosphates from 1770s till 1950s[J]. Materials Science & Engineering C-Materials for Biological Applications, 2013, 33(6): 3085-3110.
[14]廖欣宇, 王福科, 王国梁. 骨组织工程支架的进展与挑战[J]. 中国组织工程研究, 2021, 25(28): 4553-4560.
LIAO Xinyu, WANG Fuke, WANG Guoliang. Progress and challenges of bone tissue engineering scaffolds[J]. Chinese Journal of Tissue Engineering Research, 2021, 25(28): 4553-4560.
[15]DINESCU S, GALAT,EANU B, ALBU M, et al. Biocompatibility assessment of novel collagen-sericin scaffolds improved with hyaluronic acid and chondroitin sulfate for cartilage regeneration[J]. Biomed Research International, 2013: 598056.
[16]田伟. 丝素/丝胶蛋白共混材料的制备及其矿化性能的研究[D]. 苏州: 苏州大学, 2020.
TIAN Wei. The Preparation and Mineralization Properties of Silk Fibroin/Sericin Blend Materials[D]. Suzhou: Soochow University, 2020.
[17]CHEN L, HU J, RAN J, et al. A novel nanocomposite for bone tissue engineering based on chitosan-silk sericin/hydroxyapatite: Biomimetic synthesis and its cytocompatibility[J]. RSC Advances, 2015, 5(69): 56410-56422.
[18]PANKONGADISAK P, SUWANTONG O. The potential use of thermosensitive chitosan/silk sericin hydrogels loaded with longan seed extract for bone tissue engineering[J]. RSC Advances, 2018, 8(70): 40219-40231.
[19]方艷, 徐水, 吴婷芳, 等. 丝胶蛋白/羟基磷灰石/聚己内酯复合支架材料的制备及表征[J]. 材料导报, 2019(33): 533-537.
FANG Yan, XU Shui, WU Tingfang, et al. Preparation and characterization of sericin/hydroxyapatite/polycaprolactone composite scaffold materials[J]. Material Report, 2019(33): 533-537.
[20]WANG F, HOU K, CHEN W, et al. Transgenic PDGF-BB/sericin hydrogel supports for cell proliferation and osteogenic differentiation[J]. Biomaterials Science, 2020, 8(2): 657-672.
[21]ZHAO J J, LIU D C, YU Y H, et al. Development of gelatin-silk sericin incorporated with poly(vinyl alcohol) hydrogel-based nanocomposite for articular cartilage defects in rat knee joint repair[J]. Journal of Biomedical Nanotechnology, 2021, 17(2): 242-252.
[22]ZHANG H P, WANG X Y, MIN S J, et al. Hydroxyapatite/sericin composite film prepared through mineralization of flexible ethanol-treated sericin film with simulated body fluids[J]. Ceramics International, 2014, 40(1): 985-991.
[23]QI C, LIU J, JIN Y, et al. Photo-crosslinkable, injectable sericin hydrogel as 3D biomimetic extracellular matrix for minimally invasive repairing cartilage[J]. Biomaterials, 2018, 163: 89-104.
[24]王琳婷, 杨明英, 朱良均, 等. 丝胶蛋白/羟基磷灰石复合支架材料的制备及性能研究[J]. 蚕业科学, 2010, 36(4): 639-644.
WANG Linting, YANG Mingying, ZHU Liangjun, et al. Preparation and performance of silk sericin/hydroxyapatite composite bone scaffold[J]. Science of Sericulture, 2010, 36(4): 639-644.
[25]YANG M, SHUAI Y, ZHANG C, et al. Biomimetic nucleation of hydroxyapatite crystals mediated by antheraea pernyi silk sericin promotes osteogenic differentiation of human bone marrow derived mesenchymal stem cells[J]. Biomacromolecules, 2014, 15(4): 1185-1193.
[26]ZHUANG J Y, ZHOU G S, ZHANG J C, et al. Antheraea pernyi silk sericin mediating biomimetic nucleation and growth of hydroxylapatite crystals promoting bone matrix formation[J]. Microscopy Research and Technique, 2017, 80(3): 305-311.
[27]VEIGA A, CASTRO F, L OLIVEIRA A, et al. High efficient strategy for the production of hydroxyapatite/silk sericin nanocomposites[J]. Journal of Chemical Technology & Biotechnology, 2021, 96(1): 241-248.
[28]QI C, DENG Y, XU L, et al. A sericin/graphene oxide composite scaffold as a biomimetic extracellular matrix for structural and functional repair of calvarial bone[J]. Theranostics, 2020, 10(2): 741-756.
[29]YUAN Y, LIU H, ZHENG N, et al. Simple fabrication of sericin/graphene nanocomposites for application in articular cartilage repair in knee joints in nursing care[J]. Applied Nanoscience, 2020, 10(3): 695-702.
[30]PRIDDY L B, CHAUDHURI O, STEVENS H Y, et al. Oxidized alginate hydrogels for bone morphogenetic protein-2 delivery in long bone defects[J]. Acta Biomaterialia, 2014, 10(10): 4390-4399.
[31]LAN W, XU M, QIN M, et al. Physicochemical properties and biocompatibility of the bi-layer polyvinyl alcohol-based hydrogel for osteochondral tissue engineering[J]. Materials & Design, 2021, 204(11): 109652.
[32]ILYAS K, ZAHID S, BATOOL M, et al. In-vitro investigation of graphene oxide reinforced bioactive glass ceramics composites[J]. Journal of Non-Crystalline Solids, 2019, 505: 122-130.
[33]PANKONGADISAK P, JAIKAEW N, KITI K, et al. The potential use of gentamicin sulfate-loaded poly(l-lactic acid)-sericin hybrid scaffolds for bone tissue engineering[J]. Polymer Bulletin, 2019, 76(6): 2867-2885.
[34]劉朝红, 董寅生, 林萍华, 等. β-磷酸钙多孔生物陶瓷支架的制备及生物相容性[J]. 东南大学学报: 自然科学版, 2004, 34(5): 665-668.
LIU Chaohong, DONG Yansheng, LIN Pinghua, et al. Preparation and biocompatibility of porous β-Ca3(PO4)2 scaffold[J]. Journal of Southeast University(Natural Science Edition), 2004, 34(5): 665-668.
[35]NAYAK S, DEY T, NASKAR D, et al. The promotion of osseointegration of titanium surfaces by coating with silk protein sericin[J]. Biomaterials, 2013, 34(12): 2855-2864.
[36]ZHANG F, ZHANG Z, ZHU X, et al. Silk-functionalized titanium surfaces for enhancing osteoblast functions and reducing bacterial adhesion[J]. Biomaterials, 2008, 29(36): 4751-4759.
[37]王勇平, 劉小荣, 张炳春, 等. 镁合金支架对成骨细胞功能的影响[J]. 中国组织工程研究, 2016, 20(34): 5021-5026.
WANG Yongping, LIU Xiaorong, ZHANG Bingchun, et al. Effect of magnesium alloy scaffolds on osteoblast function[J]. Chinese Journal of Tissue Engineering Research, 2016, 20(34): 5021-5026.
[38]WANG X, ZHU Z, XIAO H, et al. Three-dimensional, multiscale, and interconnected trabecular bone mimic porous tantalum scaffold for bone tissue engineering[J]. ACS Omega, 2020, 5(35): 22520-22528.
[39]KUNZ R I, BRANCALHO R M C, RIBEIRO L F C, et al. Silkworm sericin: Properties and biomedical applications[J]. Biomed Research International, 2016: 8175701.
[40]GHENSI P, BETTIO E, MANIGLIO D, et al. Dental implants with anti-biofilm properties: A pilot study for developing a new sericin-based coating[J]. Materials, 2019, 12(15): 2429.
[41]KUNDU B, KUNDU S C. Silk sericin/polyacrylamide in situ forming hydrogels for dermal reconstruction[J]. Biomaterials, 2012, 33(30): 7456-7467.
[42]CHEN C S, ZENG F, XIAO X, et al. Three-dimensionally printed silk-sericin-based hydrogel scaffold: A promising visualized dressing material for real-time monitoring of wounds[J]. ACS Applied Materials & Interfaces, 2018, 10(40): 33879-33890.
[43]ZHANG Y S, ZHAO Y Y, HE X B, et al. A sterile self-assembled sericin hydrogel via a simple two-step process[J]. Polymer Testing, 2019, 80: 106016.
[44]郭晓晓, 农叶琳, 王平, 等. T-Gase催化丝胶-壳寡糖交联及其复合膜材料性能探究[J]. 丝绸, 2020, 57(7): 9-14.
GUO Xiaoxiao, NONG Yelin, WANG Ping, et al. T-Gase-catalyzed crosslinking reaction between sericin and chitooligosaccharide and properties of the composite membrane[J]. Journal of Silk, 2020, 57(7): 9-14.
[45]ARAMWIT P, KANOKPANONT S, NAKPHENG T, et al. The effect of sericin from various extraction methods on cell viability and collagen production[J]. International Journal of Molecular Sciences, 2010, 11(5): 2200-2211.
[46]吴金鸿, 王璋, 许时婴. 丝绸废水中丝胶提取方法的研究[J]. 食品与发酵工业, 2007, 33(6): 136-140.
WU Jinhong, WANG Zhang, XU Shiying. Study on extraction method of sericin from silk wastewater[J]. Food and Fermentation Industries, 2007, 33(6): 136-140.
[47]LAMBONI L, LI Y, LIU J, et al. Silk sericin-functionalized bacterial cellulose as a potential wound-healing biomaterial[J]. Biomacromolecules, 2016, 17(9): 3076-3084.
[48]TERADA S, SASAKI M, YANAGIHARA K, et al. Preparation of silk protein sericin as mitogenic factor for better mammalian cell culture[J]. Journal of Bioscience and Bioengineering, 2005, 100(6): 667-671.
[49]DASH R, MANDAl M, GHOSH S K, et al. Silk sericin protein of tropical tasar silkworm inhibits UVB-induced apoptosis in human skin keratinocytes[J]. Molecular and Cellular Biochemistry, 2008, 311(1): 111-119.
[50]WANG Z, ZHANG Y, ZHANG J, et al. Exploring natural silk protein sericin for regenerative medicine: An injectable, photoluminescent, cell-adhesive 3D hydrogel[J]. Scientific Reports, 2014, 4(1): 1-11.
[51]趙林, 谢艳招, 郑贻德, 等. 蚕丝蛋白在化妆品中的应用研究进展[J]. 日用化学工业, 2012, 42(6): 452-456.
ZHAO Lin, XIE Yanzhao, ZHENG Yide, et al. Progress in research work with respect to application of silk protein in cosmetics[J]. China Surfactant Detergent & Cosmetics, 2012, 42(6): 452-456.
[52]陈楠楠, 陈珍, 卜黎明, 等. 丝胶枸杞保健饮料的研制[J]. 食品科学技术学报, 2016, 34(4): 85-90.
CHEN Nannan, CHEN Zhen, BU Liming, et al. Production of healthy beverage of sericin and wolfberry[J]. Journal of Food Science and Technology, 2016, 34(4): 85-90.
[53]ZHANG Y, JIANG R, FANG A, et al. A highly transparent, elastic, injectable sericin hydrogel induced by ultrasound[J]. Polymer Testing, 2019, 77: 105890.
[54]胡浩然, 何敏, 王平, 等. HRP酶促丝胶自交联及其膜材料的制备[J]. 丝绸, 2020, 57(2): 1-5.
HU Haoran, HE Min, WANG Ping, et al. HRP-catalyzed crosslinking of silk sericin and preparation of its membrane material[J]. Journal of Silk, 2020, 57(2): 1-5.
[55]SIAVASHANI A Z, MOHAMMADI J, ROTTMAR M, et al. Silk fibroin/sericin 3D sponges: The effect of sericin on structural and biological properties of fibroin[J]. International Journal of Biological Macromolecules, 2020, 153: 317-326.
[56]ZHANG Y, CHEN H, LI Y, et al. A transparent sericin-polyacrylamide interpenetrating network hydrogel as visualized dressing material[J]. Polymer Testing, 2020, 87: 106517.
[57]TERADA S, NISHIMURA T, SASAKI M, et al. Sericin, a protein derived from silkworms, accelerates the proliferation of several mammalian cell lines including a hybridoma[J]. Cytotechnology, 2002, 40(1): 3-12.
[58]崔福斋. 生物矿化[M]. 北京: 清华大学出版社, 2007.
CUI Fuzhai. Biomineralization[M]. Beijing: Tsinghua University Press, 2007.
[59]CAI Y, JIN J, MEI D, et al. Effect of silk sericin on assembly of hydroxyapatite nanocrystals into enamel prism-like structure[J]. Journal of Materials Chemistry, 2009, 19(32): 5751-5758.
[60]WONG V W, SORKIN M, GURTNER G C. Enabling stem cell therapies for tissue repair: Current and future challenges[J]. Biotechnology Advances, 2013, 31(5): 744-751.
[61]王曉锋, 吴岩. 骨组织工程中干细胞的研究与应用[J]. 中国组织工程研究, 2013, 17(19): 3558-3565.
WANG Xiaofeng, WU Yan. Stem cells in bone tissue engineering[J]. Chinese Journal of Tissue Engineering Research, 2013, 17(19): 3558-3565.
[62]BEUTNER R, MICHAEL J, SCHWENZER B, et al. Biological nano-functionalization of titanium-based biomaterial surfaces: A flexible toolbox[J]. Journal of the Royal Society Interface, 2010, 7(1): 93-105.
[63]CHUA P H, NEOH K G, KANG E T, et al. Surface functionalization of titanium with hyaluronic acid/chitosan polyelectrolyte multilayers and RGD for promoting osteoblast functions and inhibiting bacterial adhesion[J]. Biomaterials, 2008, 29(10): 1412-1421.
