大豆苷元与修饰环糊精的包合研究*
2020-12-31杨敏芬盘振杰
杨敏芬,盘振杰
(广西民族师范学院化学化工学院,广西 崇左 532200)
大豆苷元是一种天然性的植物雌性激素的异黄酮类化合物。主要具有降低肿瘤、抗血栓、抗缺氧缺血、骨骼保护、抗心血管病、抑制癌细胞的生长和促进骨细胞的生成等生理活性方面药理作用。因此大豆苷元常常作为药品用药和食品补充剂被广泛的应用[1-2]。但是因为大豆苷元这类异黄酮化合物自身的水溶性和脂溶性是比较相对较差,其自身的稳定性也是比较低,而且其口服吸收的能力较差,体内吸收的效果也是不太理想,从而导致了大豆苷元这类异黄酮化合物在生活方面的利用率不高,大大地影响了大豆苷元这类异黄酮化合物在医药制剂上和食品补充剂上的应用[3-4]。
环糊精(Cyclodextrins)又可以被称为Schardinger糊精是一类环状型寡糖的总糖,研究表明环糊精基本的分子结构的形状呈截形圆筒。环糊精这一种环状低聚糖主要是由1→4糖苷键(主要以6-8个葡萄糖分子为主)链接而成的从而具有“内疏水外亲水”这种特殊的结构性质[5-7]。其中β-环糊精有着非常特殊的包合作用在许多药物上,所以在药物辅料中有着非常重要的应用。
本文以大豆苷元、β-环糊精和1,4-丁二胺为原料,制备大豆苷元-1,4-丁二胺单修饰β-环糊精包合物,并借助扫描电镜(SEM)、红外光谱(IR)等方法对成功制备出的包合物进行结构表征。通过紫外可见分光光度计测定大豆苷元与1,4-丁二胺单修饰β-环糊精的结合常数以及大豆苷元-1,4-丁二胺单修饰β-环糊精包合物的溶解性。
1 实 验
1.1 试剂与仪器
β-环糊精(BR级),成都市科隆化学品有限公司;对甲苯磺酰氯(AR级),上海精纯生化科技股份有限公司;1,4-丁二胺(98%),上海精纯生化科技股份有限公司;大豆苷元,上海同田生物技术股份有限公司。
DHG-9140A干燥箱,上海元析仪器有限公司;UV-6102S紫外光谱仪,上海元析仪器有限公司;EVO-18扫描电镜,上海恒球仪器设备有限公司;IR PerkinElmer-65红外光谱,铂金埃尔默仪器(上海)有限公司。
1.2 实验内容
1.2.1 修饰β-环糊精的制备
准确量取10 mL 1,4-丁二胺与2.5000~3.0000 g Tosylate于三颈烧瓶中在60 ℃条件下用磁力搅拌下搅拌6~7 h后,停止反应。将上述溶液加入丙酮溶液中搅拌,产生大量的白色沉淀,重复上述过程三次可得到最终产品。即得到1,4-丁二胺单修饰β-环糊精(修饰环糊精)。合成的路线如图1所示。
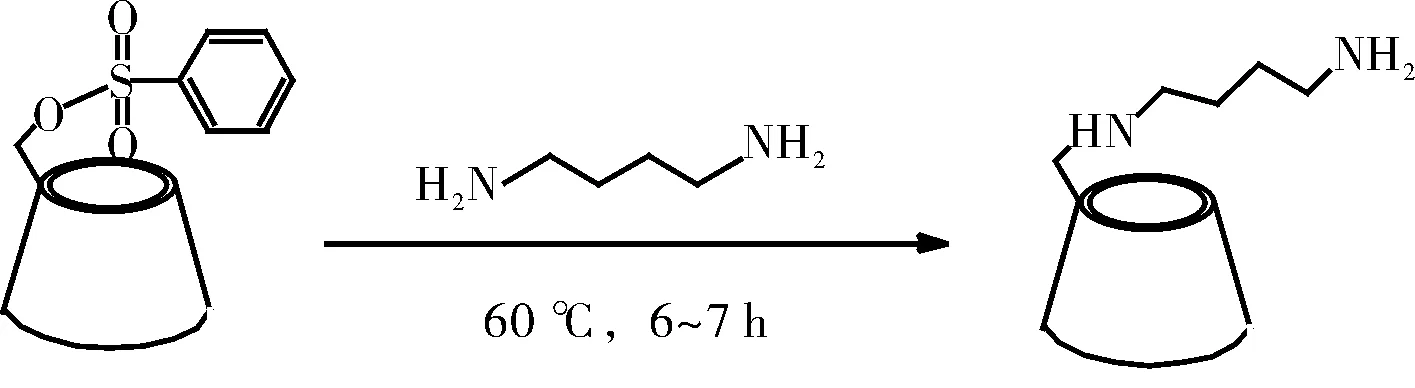
图1 修饰β-环糊精的合成路线
1.2.2 大豆苷元与修饰环糊精包合物的制备
在室温下称取76.0 mg(0.3 mmol)大豆苷元于100 mL三颈烧瓶中,用6 mL的无水乙醇溶液使之完全溶解,同时滴加1,4-丁二胺单修饰β-环糊精180.8 mg (0.15 mmol)水溶液至三颈烧瓶中,使两种溶液充分混合。搅拌约5 h之后,用0.45 μm微孔滤膜将溶液过滤之后将滤液置于40~45 ℃真空烘箱中烘大约24 h左右,即得到固体包合物。
1.2.3 大豆苷元标准工作曲线的建立
称取1.3 mg溶于无水乙醇溶,定容于10 mL容量瓶。分别移取上述已经配制好的溶液70、140、210、280、350、420 μL于5 mL的容量瓶中并用无水乙醇溶液进行定容。得到溶液的溶度分别为0.7、1.4、2.1、2.8、3.5、4.2(10-5mol/L),采用紫外光谱分别测定上述配制好的溶液在200~600 nm处的吸光度值。取λdaidzein=250 nm处的吸光度值(Abs)作为横坐标,大豆苷元溶液的浓度(Cdaidzein)作为纵坐标,作出标准工作曲线。
1.2.4 主客体之间稳定常数的测定
称取6.1 mg修饰β-环糊精溶于蒸馏水中,定容于10 mL容量瓶。得到所需主体溶液。移取主体溶液210、280、350、420、490、560、630、700 μL于5 mL的容量瓶后,向其加入已经配制好的大豆苷元标准溶液200 uL,并用已经配制好的乙醇溶液(无水乙醇溶液:水=3:2)定容至5 mL,用紫外光谱分别测定上述配制好的溶液在200~600 nm处的吸光度值。
1.2.5 水溶性的测定
往离心管中加入0.5 mL二次蒸馏水,逐渐加入包合物直至形成饱和溶液。用紫外可见光谱测定其吸光度值。取λdaidzein=250 nm时的吸光度值代入标准的工作曲线并计算出其溶解度。
2 结果分析与讨论
2.1 大豆苷元标准曲线的建立
由图2可知,在同一波长下吸光度值随着大豆苷元乙醇溶液浓度的增大是逐渐增大的。取波长λ(daidzein)=250 nm处的吸光度值(Abs)作为纵坐标,大豆苷元的浓度(Cdaidzein)作为为横坐标,作出标准工作曲线。由图2可知,大豆苷元的标准工作曲线线性关系良好,标准工作曲线方程为Adaidzein=0.4137S-0.0248(R2=0.99476)。
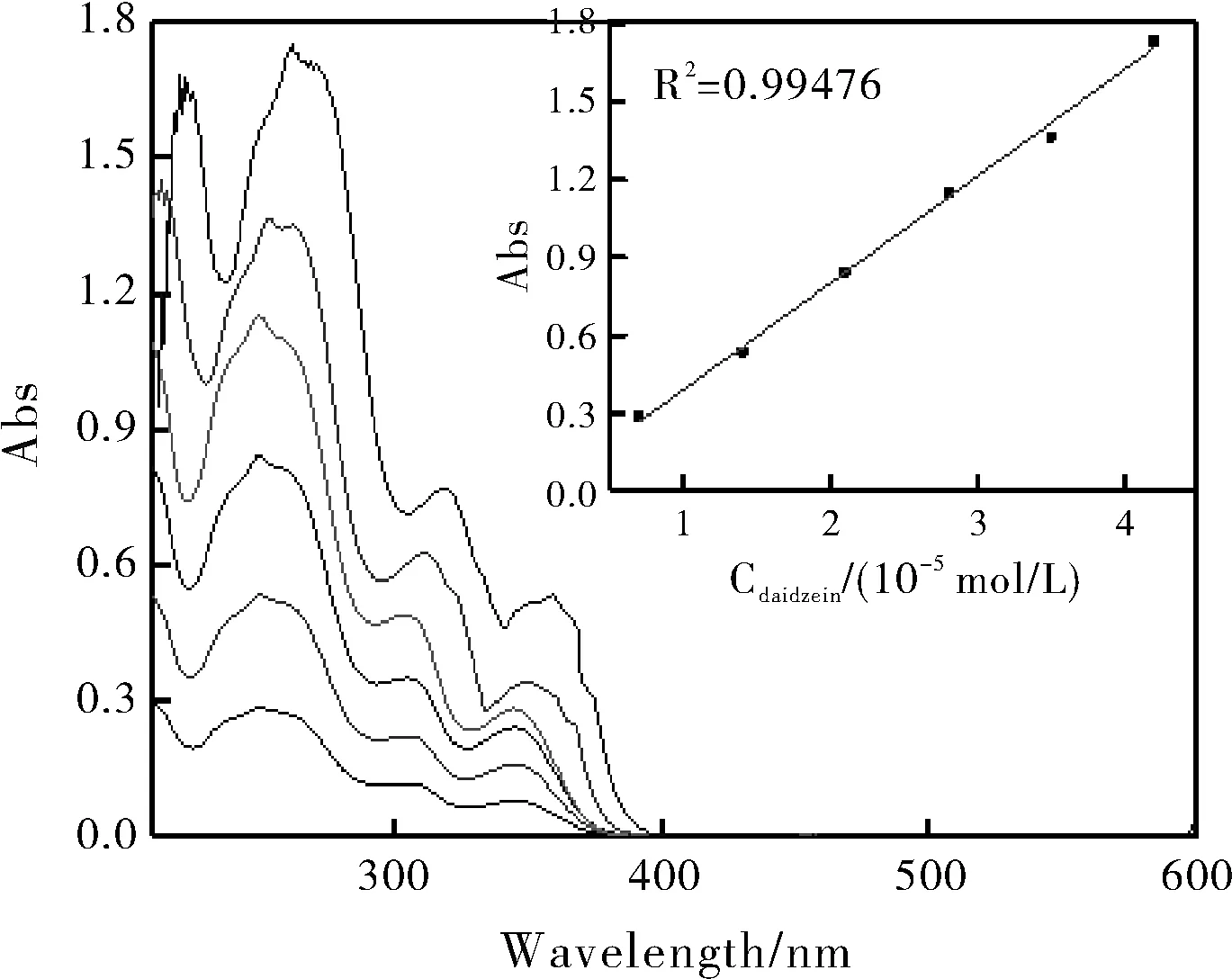
图2 大豆苷元的标准曲线
2.2 修饰β-环糊精与大豆苷元之间稳定常数的分析
由图3可知,随着修饰β-环糊精浓度的不断增加,大豆苷元的吸光度值也随之逐渐增大,表明修饰β-环糊精与大豆苷元形成了包合物。取λ=250 nm处的吸光度值作拟合曲线,线性关系较好,拟合曲线方程为y=4.1442S+0.5323(R2=0.99637)。根据线性拟合曲线方程,可以求出修饰β-环糊精与大豆苷元的结合稳定常数Ks。
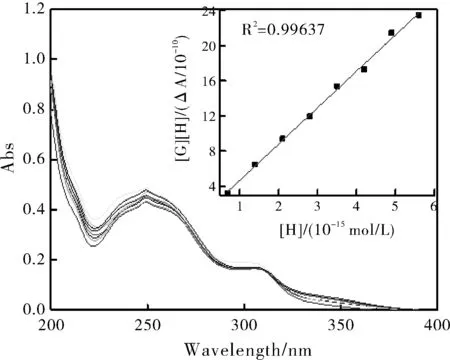
图3 稳定常数图
因为主体(修饰β-环糊精)与客体(大豆苷元)之间的包合比为1:1,所以修饰β-环糊精与大豆苷元的反应过程满足下列计算公式:
(1)
式中,[H]0为主体的初始浓度;[G]0为客体大豆苷元的初始浓度;α为紫外可见光谱的敏感因子;ΔIA为加入主体前后客体大豆苷元的相对荧光强度。以[H]0[G]0/ΔIA作为纵坐标,[H]0作为横坐标作图,作出的图形如图3所示的线性拟合曲线。由图3的线性拟合曲线可知主体与客体大豆苷元的包合过程呈现出了良好的线性关系,这表明了主体与客体大豆苷元之间的包合比为1:1。
根据图3的线性拟合曲线的斜率与截距并结合式(1),可以计算得出主体与客体大豆苷元之间的结合稳定常数为:Ks=1.6×105(M-1)。
2.3 红外光谱分析(IR)
在图4中,a为主体(修饰β-环糊精),b为客体(大豆苷元),c为包合物(大豆苷元-修饰β-环糊精包合物)。如图4a所示,主体的主要特征吸收峰呈现在3400 cm-1、2930 cm-1和1640~950 cm-1处,如图4b所示,在3415 cm-1、2912 cm-1和1600~930 cm-1三处出现了客体大豆苷元的主要特征吸收峰,如图4c所示大豆苷元-4修饰β-环糊精包合物在3400 cm-1的特征峰产生了比较微弱的蓝移,且在2912 cm-1处出现了客体大豆苷元的特征吸收峰。形成包合物后,客体大豆苷元在2912 cm-1处的特征吸收峰的强度比之前的稍微减弱,在1300~1200 cm-1处原来存在的特征吸收峰消失了,综合以上所述的现象均可以表明主体已经和客体大豆苷元形成包合物。
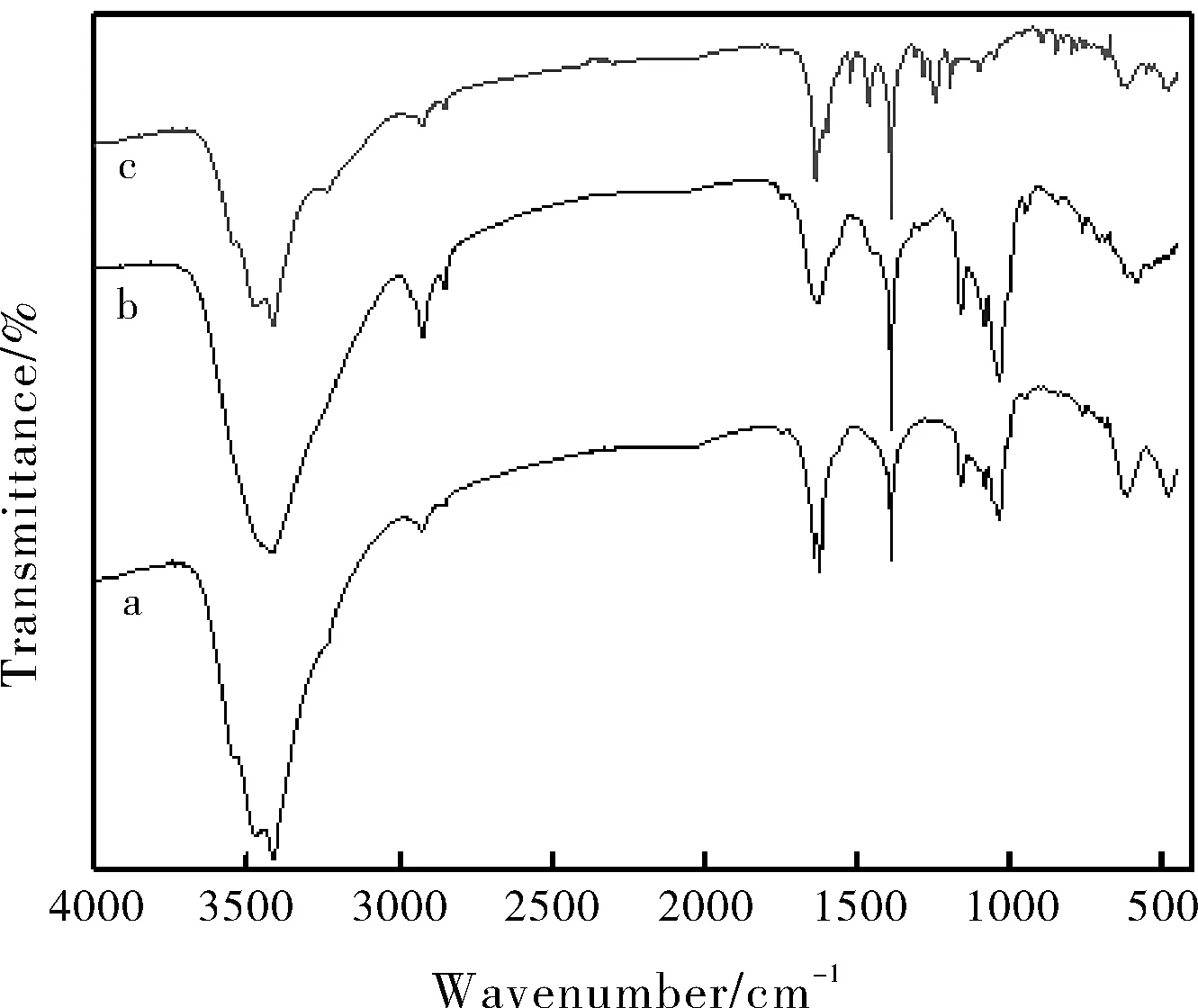
图4 红外光谱
2.4 扫描电镜分析(SEM)
如图5所示,大豆苷元、修饰β-环糊精、大豆苷元-修饰β-环糊精包合物的SEM图。从图5a中可以看出客体大豆苷元分布比较集中,主要呈现出不规则的条状形结构;图5b中修饰β-环糊精分布比较散乱,主要呈现出粘稠感的球状形结构(有小块状依附着);图5c中明显可以看出大豆苷元-修饰β-环糊精包合物是既不同于客体大豆苷元的不规则的条状形结构,也不是同于主体修饰β-环糊精粘稠状的球状形结构的棱角分明的大块状结构(如图5c所示),并且也不是主体与客体两种物质简单混合后的形状外貌。综合以上现象所述证明大豆苷元-修饰β-环糊精包合物已经形成。

图5 扫描电镜图(SEM)
2.5 大豆苷元-1,4-丁二胺单修饰β-环糊精包合物水溶性的测定
根据25 ℃时,客体大豆苷元的标准工作曲线:
Adaidzein=0.4137S-0.0248(R2=0.99476)
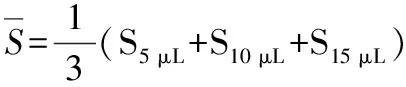
3 结 论
本文首先以β-环糊精和对甲苯磺酰氯为原料制备出Tosylate;然后以1,4-丁二胺对Tosylate进行修饰,形成1,4-丁二胺单修饰β-环糊精,采用溶液搅拌法,成功制备出了大豆苷元-1,4-丁二胺单修饰β-环糊精包合物,并借助扫描电镜(SEM)、紫外光谱仪和红外光谱(IR)等方法对包合进行表征。从而确定了我们成功制备出包合物。其次运用紫外光谱研究了主体与客体大豆苷元之间的相互作用,根据实验研究结果发现在25 ℃时,主体与客体大豆苷元的结合常数为Ks=1.6×105M-1。最后,大豆苷元-修饰β-环糊精包合物的水溶性进行了探究。根据水溶性的实验研究表明,形成包合物之后,大豆苷元的水溶性明显提高了8.48倍。
