基于CT 的影像组学术前预测胃癌Ki-67表达水平的研究
2020-12-31董梦艺赵秉超李叶兴黄佳夏婷梁长虹刘再毅
董梦艺 赵秉超 李叶兴 黄佳 夏婷 梁长虹 刘再毅
胃癌是全球最常见的消化系统恶性肿瘤之一,我国胃癌发病率在各种恶性肿瘤中位居第2 位,每年新增病例约67.9 万例,导致死亡约49.8 万例[1]。Ki-67 是一种识别增殖期细胞核内相关抗原的单克隆抗体,其表达阳性率的高低与胃癌的分化程度、淋巴结转移及预后密切相关[2-4]。因此,Ki-67 可能成为可靠、快速测定胃癌增殖率的重要工具,而胃癌增殖细胞百分比的准确测定对预后有重要价值,对选择合适的治疗方法也有重要意义。目前临床上常用病理免疫组织化学(immunohistochemistry,IHC)方法检测胃癌Ki-67 表达水平,但其有创、耗时且成本高。影像组学可从医学影像中提取海量的定量特征进行分析以协助临床决策,研究表明影像组学可用于术前预测乳腺癌、肾上腺癌等肿瘤的Ki-67表达水平,但在胃癌方面尚未见相关报道[5-7]。因此,本研究拟建立并验证基于术前增强CT 的影像组学诺谟图以预测胃癌Ki-67 表达水平。
1 资料与方法
1.1 研究对象 回顾性收集2009 年1 月—2019年1 月行上腹部CT 增强扫描且术后行胃癌组织Ki-67 表达水平检测的胃癌病人468 例,其中男297 例,女171 例,年龄26~88 岁,平均(59.03±12.24)岁。将病人随机分为训练集[310 例,男196例,女114 例,年龄27~88 岁,平均(59.39±12.72)岁]和验证集[158 例,男101 例,女57 例,年龄26~83岁,平均(66.83±6.10)岁]。纳入标准:①手术切除且经术后病理确诊为胃腺癌;②经术后IHC 检测Ki-67表达水平;③术前行增强CT 检查且可明确显示癌灶。排除标准:①术前行放疗、化疗或放化疗;②CT影像不符合后处理要求,如影像质量差、癌灶过小或胃充盈差而无法清晰显示病灶等。本研究经伦理委员会批准,豁免签署病人知情同意书。
1.2 设备与方法 采用西门子Somatom Definition Flash CT、飞利浦256 层Brilliance iCT 设备,扫描范围自膈顶至双肾下级。扫描参数:管电压120 kV,管电流130 mA,层厚、层间距及重建厚度均为1 mm,旋转时间0.5 s/r,FOV 36 cm×36 cm,矩阵512×512。对比剂使用碘普罗胺(含碘370 mg/mL),经前臂静脉注入对比剂(1.5 mL/kg 体质量),注射流率为3.5 mL/s,分别于注射对比剂后30、60、180 s 获取动脉期、门静脉期及延迟期CT 影像。
1.3 病理检查及Ki-67 表达水平评定 记录病人肿瘤部位(胃上部、胃中部、胃下部),以及术前活检病理分化程度(高分化、中分化、低分化)、Lauren 分型(肠型、弥漫型、混合型)、血清癌胚抗原(CEA)(正常、升高)和糖类抗原CA19-9 水平(正常、升高)。术后1 周内通过IHC 检测Ki-67 水平,记录显微镜(×40)下每1 000 个细胞中Ki-67 标记阳性细胞百分比,根据Ki-67 表达水平(≥50%为高表达,<50%为低表达[8])将病人分为高表达组(训练集177 例,验证集79 例)和低表达组(训练集133 例,验证集79 例)。
1.4 影像组学分析
1.4.1 兴趣体积(volume of interest,VOI)勾画 从图像存储与传输系统(PACS)工作站以DICOM 格式导出门静脉期CT 影像,由2 名有经验的放射科医生使用ITK-SNAP 图像处理软件(版本3.6.0,www.itksnap.org)手动勾画肿瘤VOI。自病灶起始层开始连续勾画兴趣区(ROI),沿肿瘤轮廓分割,避开胃腔内气体、坏死区、肿大淋巴结及外周的脂肪等(图1)。连续勾画层面包括整个病灶,最后将病人多层ROI 整合为VOI。
1.4.2 影像组学特征的提取 提取的影像组学特征包括手工特征和深度学习特征。手工特征提取:截取VOI 每一层面的最小外接矩形,将矩形中不属于肿瘤区域的像素置零,然后使用MATLAB 2016(MathWorks,Natick,MA)提取手工特征,包括一阶统计量、纹理特征、形态学特征、滤波特征。深度学习特征提取:使用计算机视觉领域广泛应用的迁移学习技术提取,截取肿瘤图像最大层面的最小外接矩形,并标准化为224×224 像素,输入MATLAB 上预训练好的VGG16 模型(ww2.mathworks.cn),将模型的最后隐含层移除,最后输出的特征作为本研究使用的深度特征。
1.5 特征的筛选和影像组学诺谟图的构建 筛选与胃癌Ki-67 表达水平高度相关的影像组学特征。首先通过计算组内和组间相关系数(ICC)评估特征的稳定性,对稳定的(ICC≥0.9)的手工特征和深度学习特征分别筛选。手工特征筛选采用最大相关最小冗余(mRMR)及递归特征消除(RFE)方法;深度学习特征筛选采用单因素分析[计算单一特征的受试者操作特征(ROC)曲线下面积(AUC),按AUC 大小进行降序排列,选取AUC 较大的特征进行分析]及随机森林(RF)方法。将筛选后与胃癌Ki-67 表达水平高度相关的手工特征和深度学习特征联合建模[9]。采用支持向量机(support vector machine,SVM)构建影像组学标签(https://github.com/Bingchao-Zhao/CT-prediction-ki67.git),并计算每例病人的影像组学评分(Rad-score)。
1.6 统计学方法 采用R 软件(version3.6.1)和SPSS 20.0 软件进行统计学分析。符合正态分布的计量资料以均数±标准差(x±s)表示,2 组间比较采用独立样本t 检验。计数资料以例(%)表示,2 组间比较采用卡方检验。采用多因素逻辑回归分析潜在的临床危险因素,将这些危险因素联合影像组学标签建立影像-临床联合预测模型,并生成影像组学诺谟图。采用ROC 曲线评估影像组学标签和诺谟图的性能,计算AUC 并比较。采用校准曲线评估联合预测模型在术前预测Ki-67 状态的结果与术后病理真实状态的拟合度,并采用决策曲线分析(decision curve analysis,DCA)对验证集影像组学诺谟图预测的临床有效性进行分析,计算净获益时的阈值概率。P<0.05 为差异有统计学意义。
2 结果

图1 胃癌病灶ROI 手动勾画示意图。A 图为腹部增强CT 门静脉期影像,可见胃壁局灶性增厚且明显强化。B 图为手动分割的ROI,红色区域为癌灶ROI。
2.1 Ki-67 高表达与低表达病人的临床及病理特征比较 训练集中,2 组间性别、CEA 水平、术前病理分化程度、Lauren 分型间差异均有统计学意义(均P<0.05),详见表1。验证集中,2 组间年龄、性别、Lauren 分型差异均有统计学意义(均P<0.05),详见表2。训练集和验证集中,2 组间CA19-9 水平、肿瘤部位差异均无统计学意义(均P>0.05)。
2.2 Ki-67 高表达与低表达病人Rad-score 的比较 训练集和验证集中,Ki-67 高表达者的中位Rad-score(分别为1.022、1.154)均高于低表达者(分别为0.648、0.626),差异均有统计学意义(分别t=50.187,P<0.001;t=31.333,P<0.000 1)。
2.3 影像组学特征筛选及分析结果 基于训练集数据最终筛选出与Ki-67 表达水平高度相关的9个手工特征和11 个深度学习特征,输入SVM 构建影像组学标签(图2)。
2.4 影像组学标签和诺谟图对Ki-67 表达的预测效能分析
2.4.1 影像组学标签预测效能 训练集和验证集的影像组学标签预测的AUC 分别为0.637(95%CI:0.570~0.704)、0.724(95%CI:0.641~0.807)(图3)。
2.4.2 临床危险因素分析 多因素逻辑回归分析结果显示年龄和Rad-score 是与Ki-67 高表达相关的临床独立危险因素(表3)。年龄的优势比(OR)值为4.154,在其他因素保持不变的情况下,年龄每增加一岁,Ki-67 高表达的风险就增加了4.154 倍;Rad-score 的OR 值为1.320,在其他因素保持不变的情况下,Rad-score 的分数越高,Ki-67 就越趋向于高表达。
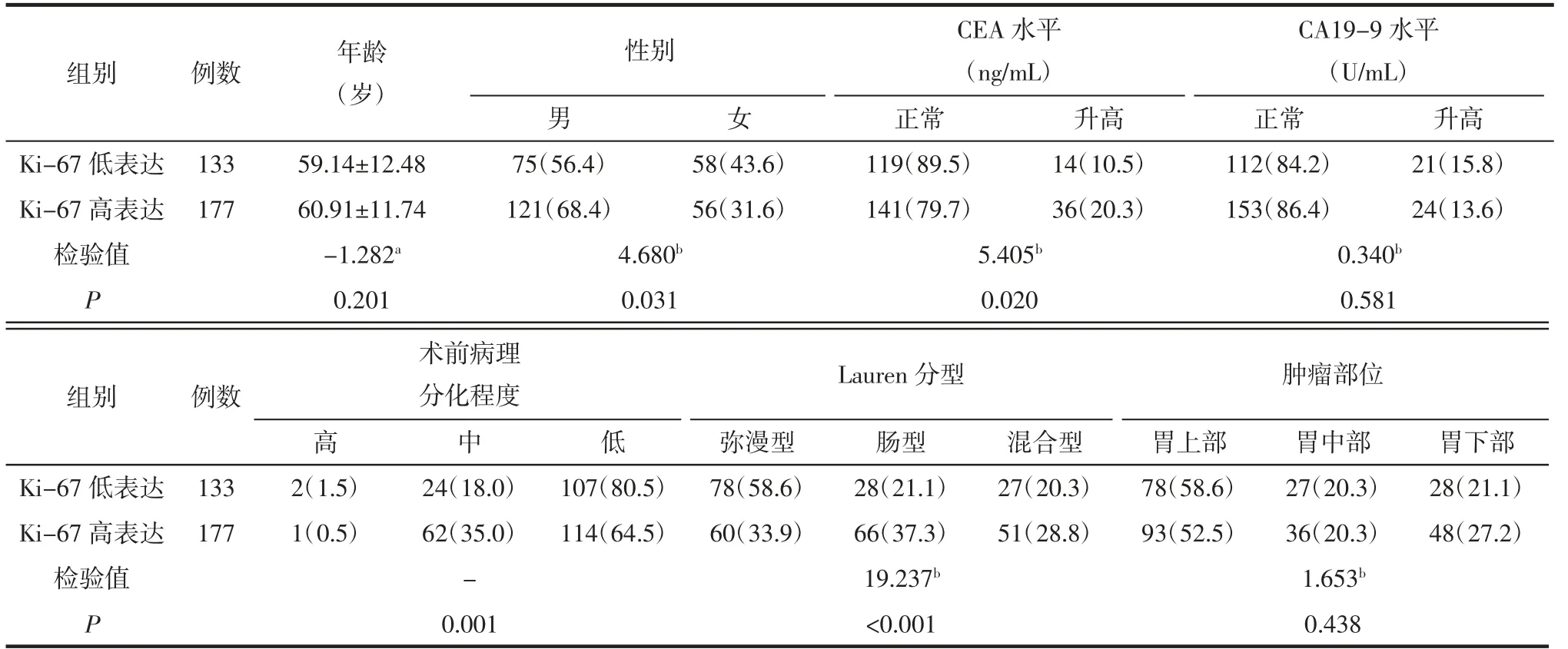
表1 训练集中Ki-67 低表达和高表达病人的基本临床和病理特征比较 例(%)
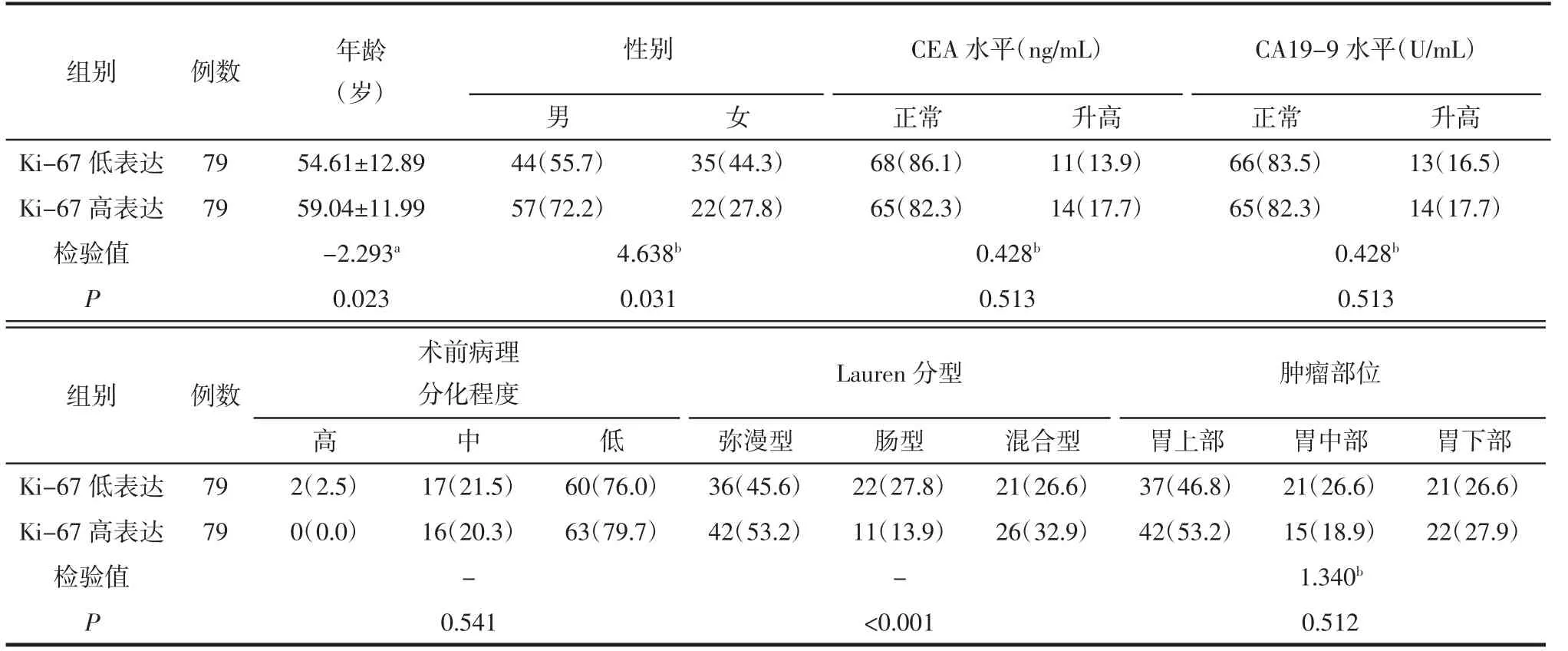
表2 验证集中Ki-67 低表达和高表达病人的基本临床和病理特征比较 例(%)

图2 手工特征及深度学习特征的筛选流程图

图3 基于增强CT 影像组学标签预测Ki-67 表达水平的ROC 曲线
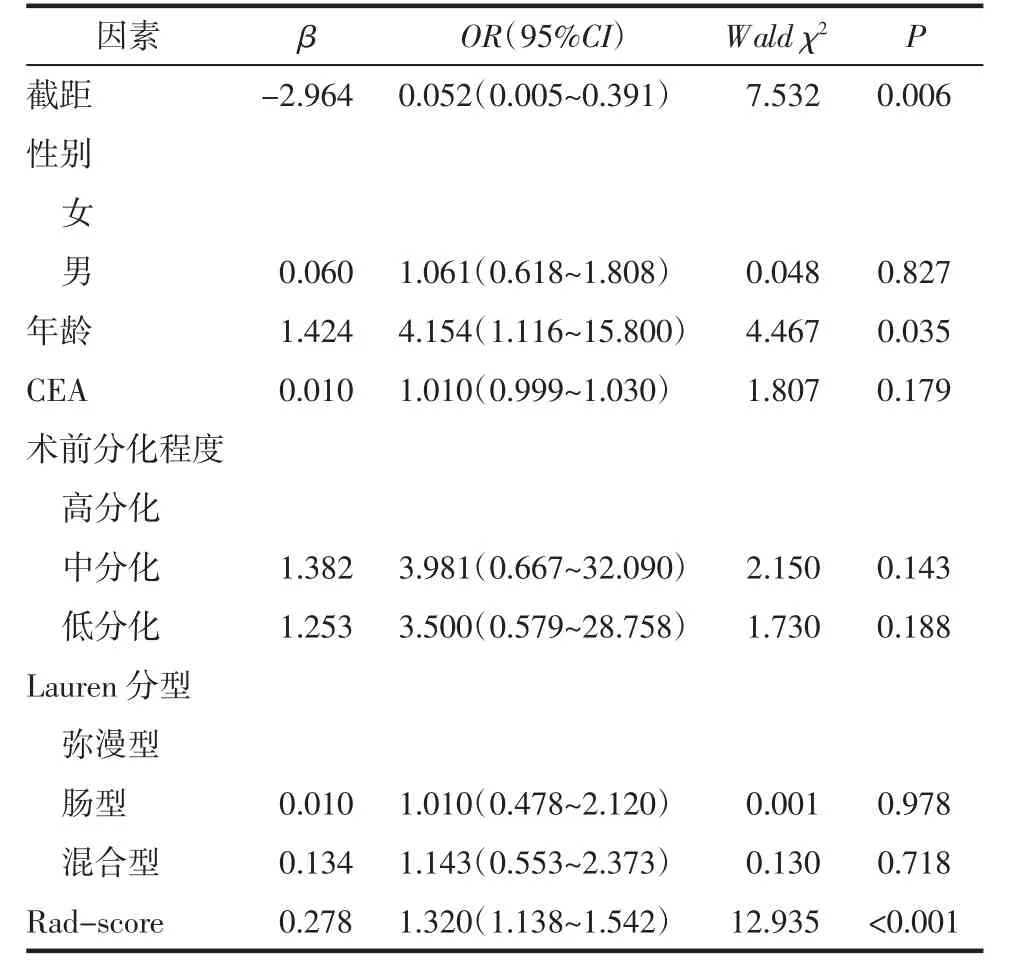
表3 胃癌Ki-67 高表达状态的独立危险因素分析
2.4.3 诺谟图预测效能 最后选取临床独立危险因素中的年龄与影像组学标签构建联合预测模型,并生成诺谟图(图4)。训练集和验证集采用联合预测模型的AUC 分别为0.656(95%CI:0.589~0.724)、0.733(95%CI:0.650~0.816)(图5)。与影像组学标签预测的AUC 相比,该联合模型对于Ki-67 表达水平的术前预测表现出更好的效能。诺谟图校准曲线显示训练集和验证集对Ki-67 表达水平的预测结果与术后病理免疫组化结果之间的一致性均较好,且在验证集中的结果优于训练集(图6)。诺谟图在验证集中进行DCA,在阈值概率为11%~62%时,影像-临床联合预测模型具有更大的净获益(图7)。
3 讨论
1983 年,Gerdes 等[10]发现Ki-67 抗原是一种在增殖细胞中表达的核抗原,这种抗原可反映细胞周期中活性细胞的比例,是评估多种肿瘤细胞增殖的有效参数。有多项研究[11-14]表明Ki-67 表达水平与胃癌生长动力学的异质性、分级、分期和预后密切相关。

图4 训练集诺谟图。由影像组学标签与年龄联合构建的影像组学诺谟图。

图5 诺谟图预测Ki-67 表达状态的ROC 曲线
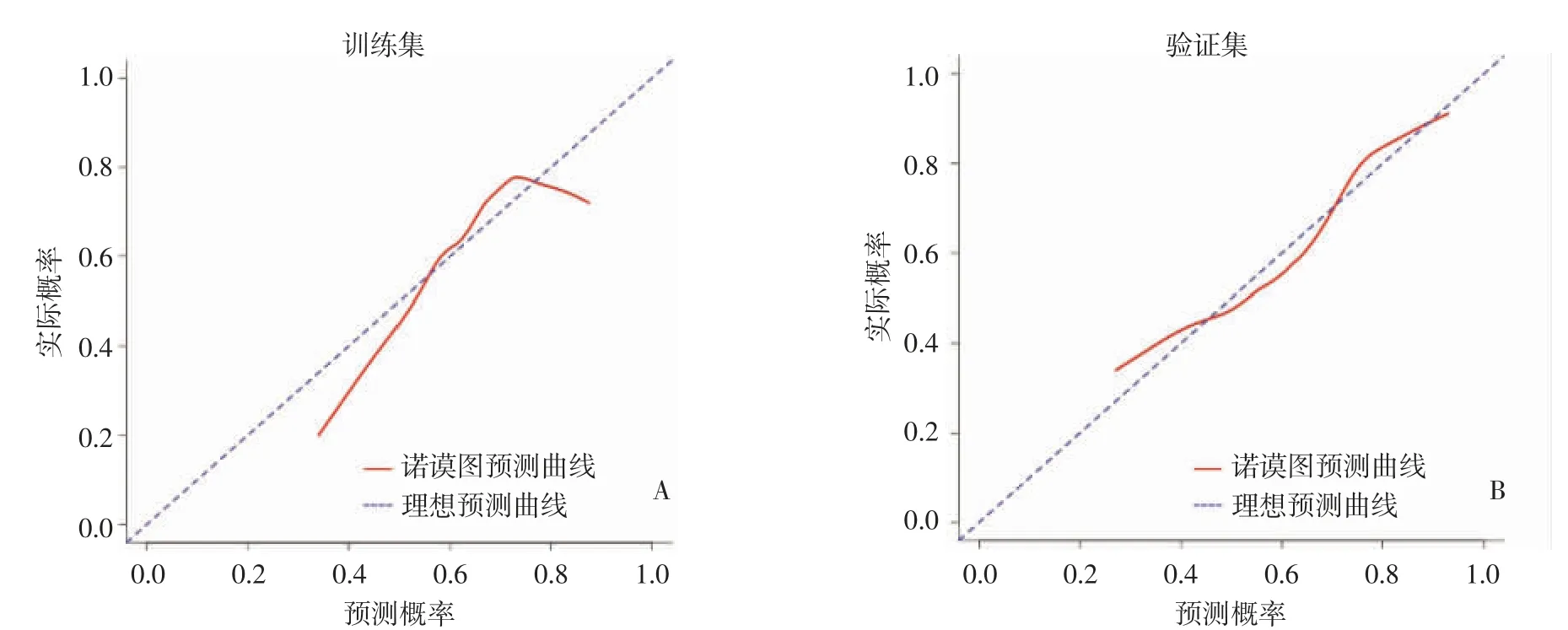
图6 诺谟图校准曲线。诺谟图对Ki-67 表达水平预测的结果与病理结果间一致性均较好,且在验证集中的结果优于训练集。

图7 验证集中诺谟图DCA。在阈值概率为11%~62%时,应用影像组学诺谟图具有良好的净获益。
目前临床常规Ki-67 检测多采用IHC 方法,这种传统检测方法耗时且成本高。Ki-67 表达在胃癌中存在异质性,在肿瘤内不同区域增殖率不等,仅依靠核心活检标本无法全面评估病灶的Ki-67 表达,有必要基于肿瘤整体对其进行全面评估[15]。影像组学方法具有解析肿瘤异质性的潜能,能够充分挖掘医学图像中所包含的数字信息,且可以预测某些肿瘤的分子分型等临床病理信息[16]。传统的影像组学特征通常为一般的手工特征,而基于深度学习的特征主要通过卷积神经网络来提取,特征学习来源于数据本身,可以提取种类丰富的深度特征,在图像信息采集方面能够做到更加全面[17-18]。而将联合模型以诺谟图的形式呈现,可以更方便临床医师通过简单的评分来获得有效的个体化预测信息,以协助临床决策,改善胃癌病人预后。
本研究构建了一种预测胃癌病人术前Ki-67表达水平的无创联合模型。通过结合深度学习特征和手工特征来构建影像组学标签,在训练集病例中行多因素逻辑回归分析得到与Ki-67 高表达显著相关的临床危险因素(年龄),将其与影像组学标签联合构建了影像-临床联合模型,进而获得诺谟图并分析其预测效能。研究显示联合模型评估Ki-67表达水平在训练集和验证集中均表现良好,且诺谟图的预测效能均优于单纯采用影像组学标签预测的效能,这表明加入了临床危险因素的联合模型有潜力改善治疗策略。分析原因可能是Ki-67 表达水平越高则肿瘤细胞增殖越活跃,血管内皮生长因子受到刺激后使得小血管增生,从而导致肿瘤强化明显及浸润深度增加;而且Ki-67 的表达与许多基因的表达都有明显的正相关性,这些因素都使得基于影像来提取的手工特征和深度组学特征能够更好地反映肿瘤的病理学特征。有研究[19]利用逻辑回归分析也发现胃癌的Ki-67 的表达与年龄、淋巴结转移和TNM 分期显著相关,与本研究筛选到的临床危险因素结果基本相符。通过对临床危险因素分析及诺谟图的解读发现,病人的年龄越大、Rad-score评分越高,胃癌组织Ki-67 就越趋向于高表达。本研究训练集和验证集中Ki-67 高表达者的中位Rad-score 均高于低表达者,Rad-score 是基于影像组学标签得出的,这表明我们筛选两类特征最后构建的影像组学标签有利于鉴别高低表达组。
校准曲线显示诺谟图对Ki-67 表达水平预测的结果与病理结果间一致性均较好,且在验证集中的结果优于训练集,在验证集中进行DCA,在阈值概率为11%~62%时,影像-临床联合预测模型能获取更大的净获益,表明基于影像并结合临床危险因素建立的模型具有良好的稳定性及泛化能力,有望应用于临床。Paul 等[9]的研究从CT 影像中提取了深度学习特征和手工特征对肺癌病人淋巴结转移评估,显示该方法具有潜在的预测能力,采用最近邻分类器的AUC 为0.713;但由于数据仅有40 例,他们使用一种内部验证方法即5 倍交叉验证来评估模型的性能。本研究的模型是纳入了158 例病人的独立验证集,结果更具有可信度;且加入了临床危险因素,使得本研究模型的效能要高于Paul 等[9]的结果。同时,本研究也证明了基于影像的多标签分析可能是一种改善临床治疗更有效的方法。
在肿瘤Ki-67 无创预测方面,许多影像组学的研究在乳腺癌、肺癌、肝癌等方向均有涉及,Liang等[20]基于MRI-T2WI 建立的影像组学标签分类器在评估预测Ki-67 状态时表现出良好的效能,对比本研究,可能是由于胃癌不像乳腺癌那样在领域内有一个相对恒定、公认的阈值(14%),且有部分研究甚至划分了多个阈值来分别评估分类效能。本研究结合数据本身特征及以往类似研究选取了50%作为分类阈值,得到了相对较好的结果,未来研究中我们将继续探索胃癌Ki-67 表达水平的最佳阈值。
另外,影像组学对胃癌的临床诊断、分期及预后评估方面也起着不可忽视的重要作用。Ma 等[21]通过勾画胃淋巴瘤和胃癌VOI 并筛选最有价值的纹理特征,同时选用CT 报告的客观特征(胃壁厚度等)及临床特征,分别建立人工判断模型、纹理特征模型及两者联合的模型,用于鉴别胃淋巴瘤与弥漫浸润型胃癌,结果表明联合模型的诊断效能最高。本研究提取了深度学习特征及手工特征,深度和维度都远高于单一的纹理特征,能纳入模型的鉴别信息更丰富,但我们最后的联合模型效能却略逊于他们的模型效能,分析原因或许是他们研究中的人工判断模型对联合模型的附加价值要高于我们挑选的临床危险因素对联合模型的附加价值,在人工判断模型中,诊断医师可以根据不同扫描期相胃壁形态改变、病灶的强化模式来灵活评估胃壁的蠕动性,而本研究只有门静脉期的影像信息;且医师对胃周脂肪浸润情况和肿大淋巴结的评估是我们研究中VOI 并没有纳入的重要诊断信息。我们将在以后的研究中进一步探索这些重要的影像特征对联合模型的附加价值。
本研究还存在一些不足。首先,本研究为回顾性研究,存在不可避免的选择性偏倚,且病人来自同一机构的单中心研究,研究结果有待多中心、多样本进一步研究验证。其次,本研究仅从门静脉期CT 影像中提取影像组学特征。虽然在门静脉期可以更清楚地显示肿瘤结构,但未来研究中若能融合平扫、动脉期、延迟期等多时相影像可望提高影像组学模型预测Ki-67 表达水平的性能。再者,VOI 的手工勾画耗时耗力,且没有标准化的勾画流程与规则,可能导致不同勾画者间一致性不佳,全自动识别肿瘤病灶进行特征提取是未来的研究方向之一。
综上所述,影像组学可提供更为客观的、与组织病理学以及IHC 标志物相关的图像特征信息;而深度学习特征又在一定程度上提高了传统手工特征的预测效能,联合基于CT 增强影像的影像组学标签及临床病理信息建立的影像组学诺谟图可用于术前预测胃癌病人Ki-67 状态。本研究所采用的影像组学研究方法,只需要依赖临床可方便获取的常规CT 增强影像进行分析,可减轻病人额外的检测负担,具有方便、无创、可重复的特点,因此在临床应用方面体现出重要的价值,有望作为重要的临床决策辅助工具。未来如何更好地挖掘信息来辅助临床决策,从而使病人得到更精准的个体化治疗,这也是影像组学发展中的机遇与挑战。
