海底沉积物生物气演化特征及气源影响因素分析
2020-12-31刘煜李清林小云孔赟肖七林
刘煜,李清,林小云,孔赟,肖七林
1. 长江大学非常规油气湖北省协同创新中心,武汉 430100
2. 长江大学油气资源与勘探技术教育部重点实验室,武汉 430100
3. 长江大学地球科学学院,武汉 430100
4. 中国地质调查局青岛海洋地质研究所,青岛 266071
5. 长江大学资源与环境学院,武汉 430100
天然气水合物作为具有巨大潜力的清洁新型能源,其主要分布于陆地永久冻土区和海洋大陆陆坡、陆隆或海台区等温压适宜的地区[1-2]。天然气水合物的形成与分解受到诸多因素的影响,而形成天然气水合物的气源受微生物作用尤为显著。天然气水合物是由甲烷形成,且甲烷多为微生物成因气[3],近些年来,国内外学者在煤层气增产以及沉积物生物气模拟实验研究上取得了一定的研究成果,多以沉积物或煤样作为生气基质研究影响因素,其中包括生物群落结构,不同温度、pH 值、盐度、微量元素、碳酸盐含量等[2-14]。但是以海洋沉积物为实验样品,并且探讨以碳源和氮源为主的微生物生长因素的研究较少。本文利用某海域3 个海底沉积物样品进行了不同生气条件下的沉积物微生物演化模拟,根据实验结果作为依据,探讨海底沉积物微生物甲烷产气率的影响因素,为我国海洋天然气水合物生物气源评价体系提供依据。
1 模拟实验方案
微生物演化生烃模拟实验是在实验室条件下尽可能地模拟一个接近自然形成生物气的环境条件,通过人为因素使其生气基质在此环境内按照人工选定的微生物的作用而生气[15-20]。本次实验主要利用某海域3 个海底沉积物样品进行了不同温度、碳源、碳源浓度、氮源和地层盐度条件下的沉积物微生物演化模拟,探讨温度、有机质、酸碱度和盐度对生物气生成的影响。
1.1 样品采集
某海域处于西太平洋活动大陆的边缘,经历晚中新世抬升剥蚀、上新世拉张断陷和第四纪海底扩张3 个主要的构造演化阶段,产生了一定规模的冲断断层与褶皱,发育了较丰富的断裂系统。沉积地层主要为第四系、上新统和中新统,沉积层的最大厚度大于12 km,地层分布呈现出由西向东、由北往南逐渐变新、变厚的特征。较厚的沉积地层既为提供充足的气源奠定了物质基础,也提供了良好的储层条件。海底表层沉积物的有机碳含量相对较高,有机碳在水深大于500 m 的主要海域变化范围为1%~1.25%。
本次实验样品选自3 个不同深度。海底沉积物从采集到运送至实验室全程冷藏保存至约-20 ℃,全程密封隔氧。将采集的海底沉积物放入带塞的广口瓶中,封闭瓶口(整个过程应尽量少接触空气)。样品的基础信息见表1。
1.2 培养基配置
为使产甲烷菌迅速成为优势种群,本次实验选用产甲烷菌培养基,具体配置如下:每 1 000 mL 无菌无氧水中加入 K2HPO40.4 g、MgCl22.0 g、KH2PO40.4 g、酵母浸入液 1.0 g、NH4Cl 1.0 g、刃天青 0.01 g、乙酸钠 2.0 g、KCl 0.2 g、NaCl 2.0 g、微量元素溶液10.0 mL,pH 为 7.0。
配备过程如下:将产甲烷菌富集培养基所需化学用品分别用电子分析天平称取规定克数后按比例加入1 000 mL 水兑入三角瓶制成产甲烷菌基础培养基。配备完毕后分装于厌氧瓶后用立式高压灭菌锅进行高温灭菌(121 ℃,20 min),为后续的富集培养及传统培养做准备。
1.3 微生物演化模拟实验方案
分别称取 5.0 g 海底沉积物于 150 mL 厌氧玻璃瓶中,加入经灭菌的产甲烷菌富集培养基100 mL,根据不同影响因素(表2),分别开展了温度、pH、碳源、碳源浓度、氮源和地层盐度6 组模拟实验,其中,温度组设定了8 个温阶;pH 值设计7 组,通过向培养基中添加无菌无氧 1 mol/L 的 HCl 和 NaOH 溶液来调节pH 值;分别选用1 g/L 的碳酸钠、甲醇、乙酸、葡萄糖、乳糖和石油醚作为6 个碳源实验组;碳源浓度选用5 个乙酸浓度作为实验组;氮源组分别选用1 g/L 的硝酸钠、亚硝酸钠、氯化铵、蛋白胨和酵母膏5 个实验组;地层盐度设计 4 个不同NaCl 浓度实验组。在每个实验组加入试剂后通入氮气5 min 确保厌氧瓶为厌氧环境后于55 ℃温度条件下(温度实验组用额外水浴培养箱控制温度)分别培养4 w、8 w,定期用气相色谱仪专用针管抽取不同对照样各250 μL,然后注入气相色谱仪进行检测,选取在标准甲烷进样后出现最高峰的时间段时出现的峰面积进行记录。

表1 实验用样品基础信息表Table 1 Basic information of experiment samples

表2 不同控制因素实验设计表Table 2 Experimental design upon different control factors
2 结果与讨论
在海洋沉积物中,影响CH4厌氧氧化的因子很多,包括微生物、表层水合物氧的存在、有机质含量、CH4供应率、硫酸盐可获得性、温度、水压、沉积物孔隙度和矿物组成等。微生物演化生烃模拟实验是在实验室尽可能的模拟一个接近自然形成生物气的环境条件,结合当前国内外CH4厌氧氧化的研究成果,本文主要以温度、pH 值、盐度的环境因素和碳源、碳源浓度、氮源的微生物成长因素两个方面进行设计的实验。
2.1 温度对海底沉积物演化生烃效果的影响
在温度作为影响因素的条件下,培养4 w 和8 w之后,产甲烷率均呈现出先增后减的趋势,当温度高于45 ℃时,样品的产甲烷率有明显的提升,温度达到 55 ℃时产甲烷率最大,其中培养4 w 后的C3H 样品最高,达到了 3.5 μg/g。当温度高于 65 ℃,样品的产甲烷率有明显的下降(图1)。

图1 不同温度下的实验样品产气量Fig.1 Gas production of the experimental samples at different temperatures
温度是影响产甲烷菌生存的首要因素,适宜的温度条件不但可以促进产甲烷菌的生长,而且有利于产甲烷菌的繁殖。但是过高的温度或者过低的温度均会在一定程度上抑制产甲烷菌的生长和繁殖[21]。研究者们通常利用温度来划分产甲烷菌的类型。此外,由于海底沉积物中有大量硫酸还原菌,当硫酸盐还原菌活动极为明显时,会产生大量硫化氢,并且抑制产甲烷菌的活动。实验结果显示,实验采用的产甲烷菌生气高峰为55 ℃,为嗜热产甲烷菌[22]。在硫酸盐还原菌活动相对明显的35~45 ℃时,甲烷产气率被抑制。硫酸盐被还原完毕后,产甲烷菌才开始活动产气,在55~65 ℃甲烷的生成量开始有显著的提升,随后进入高温阶段后(75 ℃以上),因为温度过高导致产甲烷菌活动下降,产气率呈现下滑趋势。实验结果表明了较低或者高温都不利于生物成因气的生成,这与前人的研究结果相似[16,23-24]。
2.2 pH 对海底沉积物演化生烃效果的影响
不同的pH 值下,海底沉积物的产气量不同,其中 C1H 样品在 4 w 和 8 w 均表现为产甲烷率随着pH 值的增大呈现先增后减的趋势,在pH 值为8 时达到产气量最大;C3H 样品则在 4 w 和 8 w 均表现为随着pH 值增大产气量逐渐减小;C9H 样品则表现为对pH 值变化并不敏感,仅在pH 值为5 时有小幅度产气量的提升(图2)。
不同微生物消化过程和消化产物所需的pH 值不同[25-27]。pH 值的变化会通过影响微生物表面电荷变化,改变对其营养物的吸收。也会影响到微生物细胞内的酶,改变生物化学过程[27]。研究发现适宜甲烷菌发育的水体pH 值为5.9~8.8,最佳范围值为6.8~7.8,若高于或低于该值,甲烷菌的生长繁殖就会受到抑制,甚至会出现甲烷菌中毒。另外,在一些特定的海底地层中,由于浅层地层水pH 值较高,导致产甲烷菌浅层的活动受到抑制,随着深度的增加,沉积物开始分解出一定的有机酸,使得pH 值降低,产甲烷菌开始活动,从而使产甲烷量得到显著提升。实验结果显示pH 变化对于产甲烷量有着极为明显的改变。pH 值为6~8 时CH4产气量较高,pH 值在过低或过高时下产气效果较差。结果表明海洋微生物产气的最适宜条件为中性偏碱性,酸性和碱性条件均不利于海洋微生物产气。pH 为4 时,仍能有较为明显的甲烷产出,表明可能有嗜酸产甲烷菌的存在。当pH>8 时,因为几乎所有产甲烷菌都是通过使CO2+H2还原成甲烷:

此时的CO2溶解度接近为0,但是仍然有甲烷的产出,推断可能有Methanosarcina甲烷菌依靠乙酸存在[25]。
2.3 碳源对海底沉积物演化生烃效果的影响
在碳源作为影响因素的条件下,培养4 w 和8 w之后,均显示有机碳源条件下,样品的产甲烷率有明显的提升,尤其是培养4 w 后的C3H 样品的乙酸和乳糖实验组,产甲烷率均达到了4.9 μg/g(图3)。
碳源不但是构成微生物细胞和代谢产物中碳素的主要来源,而且是微生物生长发育的重要营养来源。丰富的有机质和适宜的有机质类型是形成生物气的物质基础,有机质类型及其性质决定了被微生物利用的难易程度。在生物甲烷气形成过程中,碳源还是生物气的重要物源。实验结果显示,加入碳源后,海洋微生物的产甲烷率均有一定的提升。其中有机碳源最为明显,而有机碳源中的乳糖(双糖)为最适宜碳源。根据生物气形成机制(图4)[28],可以推断出该地区存在氢解产甲烷菌和酸解产甲烷菌。根据前文温度实验结果推测,在碳源被氧化成二氧化碳后进入产甲烷代谢时需要在温度合适的情况下才会进行其代谢任务,而且海底沉积物中分离出的微生物极有可能具备分解矿化异源有机污染物的潜力[29]。实验结果也显示出碳源的加入有利于加速产甲烷代谢。
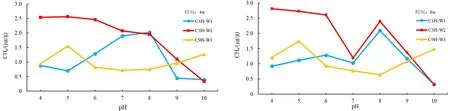
图2 不同 pH 值下的实验样品产气量Fig.2 Gas production of experimental samples at different pH

图3 不同碳源下的实验样品产气量Fig.3 Gas production of the experimental samples with different carbon sources
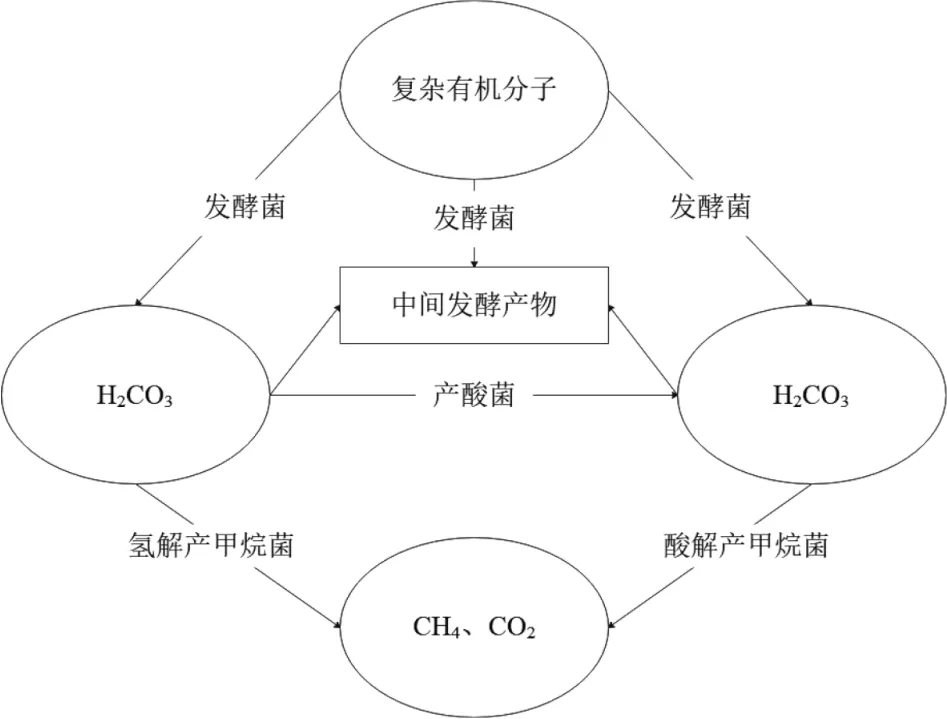
图4 生物甲烷形成途径示意图[28]Fig.4 Biogenic methane formation chart
2.4 碳源浓度对海底沉积物演化生烃效果的影响
在碳源浓度作为影响因素的条件下,培养4 w和 8 w 之后,C1H 和 C3H 样品随着碳源浓度的增加产甲烷率均呈现先增后减的趋势,且乙酸浓度达到2.0 mL/L 时,样品的产甲烷率达到峰值,而埋藏深度更深的C9H 样品则表现为产甲烷率随乙酸浓度增长(图 5)。
虽然如前文所述,碳源的加入有利于加速产甲烷菌的代谢,但是过高的碳源会导致微生物生长旺盛,结果使微生物对培养基中的各类营养因素需求加大,从而导致产气率下降。实验结果显示,C1H和C3H 微生物充足,导致在高碳源浓度(5.0 mL/L)时,生长所需的营养物质不足,产气量出现下降趋势。而C9H 样品由于埋藏深度较深,有活力的微生物较少,使其在高碳源浓度下生长所需的营养物质满足需求,导致实验结果仍呈现出产气量增加的趋势。以乙酸作为碳源,增加碳源浓度的结果也证明了前文所述的酸解产甲烷菌和Methanosarcina甲烷菌靠乙酸存在。
2.5 氮源对海底沉积物演化生烃效果的影响
在氮源作为影响因素的条件下,培养4 w 和8 w之后,均显示有机氮源条件下,样品的产甲烷率有明显的提升,尤其是培养8 w 后的C1H 样品的蛋白胨实验组,产甲烷率均达到 3.2 μg/g(图 6)。

图5 不同碳源浓度下的实验样品产气量Fig.5 Gas production of the experimental samples at different carbon source concentrations

图6 不同氮源下的实验样品产气量Fig.6 Gas production of the experimental samples with different nitrogen source
氮是微生物细胞壁、蛋白质和核酸等重要物质的原料。适量的氮源加入会增加微生物的生长,导致产气量的增加。并且在浅层生物化学作用阶段,碳水化合物的消耗速度大于蛋白质,木质素在厌氧条件下不易分解,脂类也较稳定。因此,甲烷菌的养分在陆源沉积物中主要是纤维素、半纤维素、糖类、淀粉及果胶等有机化合物,在海相沉积物中主要是蛋白质。实验结果表明,加入有机氮源后,海洋微生物的产甲烷率均有一定的提升。其中蛋白胨最为明显,也证实了实验所用海底沉积物中微生物的主要养分是蛋白质。
2.6 盐度对海底沉积物演化生烃效果的影响
在盐度作为影响因素的条件下,培养4 w 和8 w之后,3 个样品均显示在不同浓度的地层盐度条件下,样品的产甲烷率并无明显波动,只有C1H 样品在低盐度时甲烷产气率有一定幅度的降低(图7)。
盐度是控制微生物生成甲烷的一个重要条件,张祥等[5]通过生物气模拟实验结果表明,产甲烷量与Cl-浓度存在正相关性,但是由于产甲烷菌个数与盐度大体上呈消长关系,过高的盐度条件下,产甲烷菌总量会随盐度的增高而逐渐减少,从而导致产甲烷率下降[30]。并且由于钾、钠离子是生物活动必要的元素,其浓度过大或者过低时,产甲烷菌细胞内与外界水介质由于浓度差形成渗透膜,从而引发由于产甲烷菌与外界水介质隔离导致的产甲烷菌活性下降。本次实验的盐度设计是为测试微生物的耐盐度以及不同盐度条件下产甲烷效果。实验结果显示,实验所选用的盐度条件下,产气率的变化浮动不大。有文献指出[31],当盐度大于25 g/L时,产甲烷率会有明显的下降,本次实验结果为以后的25 g/L 盐度实验作有利的铺垫。

图7 不同盐度浓度下的实验样品产气量Fig.7 Gas production of the experimental samples at different salinity concentration
3 海底沉积物微生物演化生烃影响因素的地质意义
某海域具有相对较高的热流值,相应的地温梯度也很高,分布不均匀,变化较大,且高值点和低值点紧邻分布。本次实验借鉴前人的研究方法[32],根据不同温度微生物演化及产气率具有阶段性的特征,将其生物气生成演化过程划分成3 个阶段:生物生气早期阶段、生物生气高峰期阶段、生物生气晚期阶段(图 8)。
3.1 生物生气早期阶段
此阶段处于喜氧带底部至温度达到30 ℃之间。由于产甲烷菌是厌氧菌,因此当环境进入缺氧环境时,生物成因气便开始产生。在海水至海底表层喜氧带,由于存在大量的氧气,沉积有机质会率先被喜氧微生物进行降解。当有机质埋藏至一定深度时,由于游离氧被消耗殆尽,环境转变为厌氧环境。但是由于在厌氧环境下,硫酸盐还原菌摄取H2和乙酸的能力强于产甲烷菌,所以率先进入碳酸盐还原带,在此期间产甲烷菌的活动受抑制,只能生成少量的甲烷,只有当硫酸盐耗尽之后,才有显著数量的甲烷存在[33]。随后进入碳酸盐还原带,但由于地温过低,使其产甲烷菌活性较低,生物气生成量较少。根据某海域实验数据及采样点的地温梯度,分析认为,采样点所在区域的生物气开始生成的深度范围可以从沉积物表层延伸至约100~200 m,该阶段温度小于 20~30 ℃,产气量较低。
3.2 生物生气高峰期阶段
此阶段处于30~80 ℃区间。伴随着沉积有机质的埋藏深度不断增加,其温度也在不断的上升,当温度上升至硫酸盐还原菌不再适宜生存,而环境条件逐渐适合产甲烷菌群的生存时,可溶有机质被浅层的发酵菌优先利用,发酵分解为还原态的有机化合物,随后,在产氢菌与产乙酸菌的作用下分解形成产甲烷菌可利用的最终底物(如:乙酸、二氧化碳、氢等),在产甲烷菌不断利用移除底物的同时,也促使了有机质发酵水解并产生大量甲烷[16,34-37],沉积物生物气生成演化进入生物化学生气高峰期阶段。根据某海域实验数据及采样点的地温梯度,分析认为,该类产甲烷菌的最适生长温度(Topt)为65 ℃,属于嗜热产甲烷菌[21]。推测采样点所在区域的主生气带位于200~500 m,这个阶段的温度大约30~75 ℃,以 55~65 ℃这一温度段的生气作用占主导地位,为生气高峰阶段。

图8 某海域沉积物生物气生成演化模式图Fig.8 Biogas generation and evolution model for the study area
3.3 生物生气晚期阶段
此阶段在达到80 ℃之后。当地温进一步升高之后,如同硫酸盐还原菌一样,产甲烷菌也会因过高的温度而导致其活性降低,伴随着埋藏深度的进一步增加,能够被微生物溶解利用的有机质在高峰期阶段已被大量降解且消耗,加之温度过高和营养匮乏,产甲烷率开始逐渐降低。并且进入了热解作用阶段,此后的甲烷变为由热解作用主导的热解成因气。根据某海域实验数据及采样点的地温梯度,分析认为,当地温达到75 ℃以上,产甲烷率有明显的下降时,有机质进入生物化学生气晚期阶段。
实验结果表明,温度为 45~65 ℃、pH 值为 6~8、地层盐度为1~20 g/L、并且具有充足的碳源和氮源的条件下,海底沉积物微生物最为活跃,产甲烷率最高。这些环境条件与埋藏深度密切相关,随着埋藏深度的增加,会导致温度的升高,pH 值上升,产生有利于产甲烷菌活动的条件。但埋藏深度的增加并不全是有利的条件,微生物的数量以及可被微生物发酵利用形成能够被产甲烷菌利用的底物有机质均会因埋藏深度增加而下降。而且地下水是一个不能忽视的因素,地下水会引起地层的pH值改变、盐度的增加等环境的改变。弱碱性、弱径流的水动力条件应当是生物气生成的有利条件。依据某海域的采样点地温梯度,可以认为采样点所在区域的生物气烃源岩埋藏深度大约为200~500 m,具有弱碱性、弱径流水动力条件的地区可以作为重点勘查地区。
4 结论
(1)根据不同温度微生物演化及产气率特征,海底沉积物微生物演化生烃主要分为生物生气早期、生物生气高峰期和生物生气晚期,生物生气早期和生物生气晚期由于硫酸还原菌和温度过高两个因素导致产甲烷菌群活性较低,生物生气较少;生物生气高峰期由于温度适宜,有机质充沛,生物生气达到一个高峰。
(2)沉积物微生物演化模拟实验结果认为,不同温度、pH、碳源、碳源浓度和氮源对微生物生气有较为明显的影响,其中温度为55~65 ℃、pH 为6~8、碳源选取乳糖(双糖)、碳源浓度 2.0 mL/L 以及蛋白质为主要氮源时,产气率最为显著。
(3)依据某海域采样点地温梯度,采样点所在区域的海底生物气烃源岩埋藏深度大约为200~500 m,具有弱碱性、弱径流水动力条件的地区可以作为重点勘查地区。
