浅析产蛋鸡用药物零日弃蛋期的制定
2020-12-31杨大伟刘艳华梁先明董义春苏富琴
徐 倩,杨大伟,刘艳华,梁先明,董义春,苏富琴
(中国兽医药品监察所,北京 100081)
休药期是食品动物使用兽药治疗疾病后为保证食品安全而制定由停药至屠宰的时间。产蛋鸡(包括蛋鸡、种鸡及后备母鸡)用药除靶组织休药期外还应考虑弃蛋期。由于蛋黄的形成时间约为12日,且不同时期的蛋黄形成是套叠过程,因此弃蛋期不为零日的药物无法合理执行弃蛋,这使得只有零日弃蛋期的药物才会获得批准用于产蛋鸡。国际上获得批准的产蛋鸡用药物屈指可数[1](表1),且部分获批药物因为其他安全性问题撤市,如含二氟沙星、恩诺沙星的兽药产品。食品安全国家标准食品中兽药最大残留限量(GB31650)[2]中蛋有残留标志物及最高残留限量的兽药有:氨丙啉、氨苯砷酸、洛克沙胂、杆菌肽、黏菌素、溴氰菊酯、红霉素、非班太尔、芬苯达唑、奥芬达唑、氟苯达唑、林可霉素、新霉素、土霉素、金霉素、四环素、哌嗪、大观霉素、泰妙菌素和泰万菌素。然而,有最大残留限量并不意味着零日弃蛋期,本文结合欧盟发布的欧盟最大残留限量(MRL)制定指南(EC470/2009)[3]、残留消除指南以及FDA发布的食品动物用新兽药对人类食品安全性评价的一般原则(FDA-2005-D-0155)[4],阐述产蛋鸡用药物弃蛋期制定的考虑因素,尤其是ADI合理分配,为企业研发产蛋鸡用药物提供参考。

表1 部分已经获得批准的零日弃蛋期药物Tab 1 The information of some approved veterinary medicines with zero-withdrawal period
1 人类食品安全性评价的通用方法
为确保人类食用治疗动物可食性组织的食品安全,通过危害识别、危害表征、暴露评估对食品动物用兽药进行食品安全性评价。其过程一般包括通过系列毒理药理实验确定日允许摄入量、计算安全浓度、分配容忍度、制定最大残留限量、计算休药期。一般从毒理学、残留化学和微生物学角度评估食品安全(图1)[4-5]。鸡蛋作为产蛋鸡的可食性产品,其评价过程与一般评价规则相似,但也有其特点。
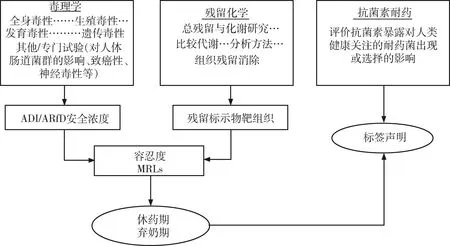
注:虚线表示该部分适用于具有抗菌活性的新兽药。ADI是指日允许摄入量。ARfD是指急性参考剂量。图1 人类食品安全性评价通用方法的流程图Fig 1 Flow diagram illustrating the general approach for the human food safety evaluation
2 确定日允许摄入量
日允许摄入量用于预估兽药残留量,指人体终身每日摄入药物而不引起可察觉的危害的最高剂量。根据药物性质,ADI分毒理学ADI和微生物学ADI。毒理学ADI是基于毒理学终点的一套标准研究,包括急性毒性试验、亚慢性毒性试验、长期毒性试验、繁殖毒性试验、发育毒性试验、遗传毒性试验、致癌性试验,得出最保守的最大无作用剂量(NOEL)/无可见不良反应剂量(NOAEL)/基准剂量单侧置信限下限值(BMDL)[4-5],除以安全系数等于兽药总残留的毒理学ADI,安全系数一般为100,即人群变异系数(10)×物种间外推(10)。ADI旨在评价人类间歇性和长期暴露于相对低浓度的兽药残留物的口服毒性。对于抗菌药物,确定抗菌药残留物是否能够到达人类结肠并保持抗微生物活性,将根据定殖屏障的破坏程度和/或抗菌素耐药菌群的增加幅度这两个微生物学终点分别计算ADI,其中较小值为微生物学ADI。毒理学ADI和微生物学ADI进行比较,较小值为确定的最终ADI,如GB31650中阿莫西林ADI就是微生物学ADI。特别需要注意的是,只有非致癌物才能制定ADI。
评价具有在单餐或单日摄取食物后产生急性毒性的小分子兽药和有特定急性毒理学相关的注射部位残留,可采用药理学终点的急性参考剂量(ARfD)。对于“非传统”新兽药,如生物技术衍生的新兽药,包括某些酶、融合蛋白、合成激素和抗体等,可采用科学的替代方法分析毒理学问题。对于性激素类药物,美国食品药品管理局兽药中心(FDA-CVM)通常用“允许递增量”方法[4],而不是ADI或容忍度进行评价。FDA认为,如果消费者食用肉类中所含激素量小于或等于人体每日激素产量的1%,预期不会产生生理影响。但在我国,农业农村部公告第250号将性激素列为食品动物中禁止使用的药品及其他化合物[6]。
3 ADI合理分配(分配容忍度)[4]
ADI作为消费者终身每日摄入的物质残留总和,根据新兽药的预期用途和每种组织的食用量(食物篮),将为适用的可食性组织分配ADI。食物篮为肌肉300 g、肝脏100 g、肾脏50 g、脂肪或皮脂550 g、奶1500 mL、蛋100 g和蜂蜜20 g。FDA-CVM假定一个人每天除了食用全部可食性组织之外,还食用全部牛奶、全部蛋和全部蜂蜜。在产品开发早期,应考虑对ADI分配的需求,将一定的ADI保留,以满足其他动物物种或可食性组织的预期需求。如果兽药有可能用于植保产品或杀虫剂,也应保留一定比例的ADI。如果兽药不用于奶牛和产蛋鸡,也可不分配ADI。ADI分配时,通常将20%ADI分配给蛋。
氟雷拉钠溶液[7]作为产蛋鸡螨虫的治疗药物研发时,将约1/3ADI分配给可食性组织,27%ADI分配给鸡蛋,40%ADI保留,以备将来分配给其他种属靶动物,或分配给牛奶或蜂蜜。泰万菌素可溶性粉[8]作为治疗蛋鸡支原体病研发时,ADI分配是基于猪和家禽组织已经单独建立的MRLs数据,每个消费者理论上每日最大摄入量(TMDI)约61 μg/天,这相当于ADI的49%,也就是51%ADI还未使用。泰万菌素将51%储备ADI全部分配给蛋鸡,相当于占用了牛奶和蜂蜜的ADI,理由是已经有4种大环内脂类抗生素批准用于奶牛,即替米考星、红霉素、螺旋霉素和泰乐菌素,这四种抗生素与泰万菌素抗菌谱相同,因此可以将泰万菌素储备给牛奶的ADI分配蛋鸡使用。蜜蜂最主要的细菌性疾病是美国蜜蜂腐蛹病(AFB)和欧洲幼虫腐臭病(EFB),推荐土霉素治疗,如果土霉素耐药,可以用泰乐菌素。但是抗菌药病不能根治AFB和EFB,欧盟对待AFB和EFB的首选处理方法是销毁被感染蜜蜂,因此也可以将泰万菌素的储备给蜂蜜的ADI分配给蛋鸡使用。另外,泰万菌素也没有被用作杀虫剂或植物保护产品的可能。但是,蛋鸡全部占满储备ADI还是存在现实风险的,也就是当泰万菌素批准用于奶牛时,要重新评估是否仍能符合零日弃蛋期。可以探索的是行业达成共识,当奶牛和蜜蜂有药可用时,是否可以将部分药物让给最难制定弃蛋期的产蛋鸡使用。
4 计算安全浓度
安全浓度是指人类一生中每天从每种可食性组织中摄入新兽药的总残留量,且使人类的残留物暴露量不会超过ADI。每种可食性组织的安全浓度计算反映了上述ADI分配。兽药在某种动物性食品和产品中的安全浓度=ADI×成年人平均体重60 kg÷每天消耗的某种动物性食品的量。注射部位如果未发现特定的急性毒理学问题,可将肌肉安全浓度乘以系数10估算注射部位安全浓度。当发现特定的急性毒理学问题时,使用ARfD计算肌肉注射部位安全浓度,注射部位安全浓度=ARfD×成年人平均体重60 kg÷每天肌肉的消耗值。
5 残留化学安全性评价
残留限量就是残留标志物在靶组织中的安全浓度。残留靶组织、残留标志物和MRL是通过系列食品动物体内兽药代谢和残留动力学评价研究确定和建立的,包括靶动物代谢研究(热试验)、实验动物和靶动物比较代谢研究(啮齿和非啮齿类热试验)、确立兽药休药期的残留标志物消除研究、残留消除研究用分析方法学验证。
5.1 靶动物代谢研究和残留消除试验 通过靶动物代谢研究和残留消除试验可以确定靶组织和残留标志物,研究代谢物谱,确定残留量并鉴定其性质,明确药物原形及其代谢产物在组织中的分布和消除规律。鸡蛋要作为单独的靶组织研究,残留标志物也可能与可食性组织不同。因此,鸡蛋和鸡可食性组的残留消除试验要分别进行,测定残留物放射性总残留(TRR)浓度、测定残留标志物浓度、计算残留标志物与TRR的比值(MR/TRR)。VICH GL48[3]建议进行鸡蛋残留消除研究时,给药期间和停药至含卵黄发育时间(约12日)每天收集蛋,每个时间点采样不能少于10枚蛋。FDA建议连续使用的产蛋鸡用新兽药,应在药物浓度达稳态后使用12日的给药方案,近似于蛋黄完全发育所需的时间,从停止治疗前2日到停止治疗后2日为鸡蛋采样时间点。对于间断给药的产品,具体问题具体分析。
5.2 实验动物和靶动物比较代谢研究 比较代谢研究可以比较靶动物和实验动物(啮齿类和非啮齿类)放射性标记代谢研究结果,确定在毒性试验中实验动物对靶动物代谢物为“自体暴露”,以便明确是否需要进行额外的毒理学试验,如免疫毒性、神经毒性等。
5.3 建立最大残留限量和确定休药期 可以按照联合国粮农组织和世界卫生组织联合专家委员会(JECFA)、美国食品药品管理局兽药评审中心(FDA-CVM)和欧洲兽药评审局(EMA)方法,对兽药进行暴露评估,制定MRLs。非放射性残留标志物消除研究测定残留标志物(MR)在各组织和蛋中的浓度,乘以分配给各组织和蛋的ADI就可以得到各组织残留量。残留量除以食物篮对应的组织消费量就是MRL,但此时的MRL是放射性总残留物TRR(热值),通过MR/TRR校正(热值×MR/TRR)就得到以残留标志物标示的MRLs。尽管FDA-CVM并未规定制定弃蛋期的计算方法[4],由于弃蛋期与弃奶期的计算方法相似,可参考弃奶期研究方法制定弃蛋期。在确定弃奶期时,FDA-CVM优先推荐采用达到安全浓度的时间方法(TTSC法)进行统计学分析,这是因为达到安全浓度的时间不变。如果所有样品浓度均低于MRL,TTSC法不适用,建议使用每次挤奶时的安全浓度方法(SCPM法)进行统计分析。建立MRL和制定休药期的方法要符合所采用方法的统计学原则。最后,靶动物每种可食性组织按第99百分位的99%置信区间在零休药期时刻的每日摄入量(EDI)要低于ADI进行验证安全性。
综上所述,弃蛋期的制定与其他可食性组一样,都要基于最保守的系列措施,保证动物性食品安全。如从所有毒理学试验中选择最小的NOEL值,毒理学ADI和微生物学ADI比较后也要选择最小值作为最终ADI值。ADI要做符合容忍度的合理分配,MRL要通过MR/TRR进行校正,每日摄入量要低于ADI。另外,由于弃蛋期必须为零日,部分药物需要行业达成一致,在奶牛和蜜蜂有足够药物治疗疾病时,把储备ADI分配给蛋鸡使用。科学合理使用药物[9],才能保证产业的健康可持续发展。
