KPT-6566对肺癌细胞增殖、侵袭、凋亡的影响及机制
2020-12-31陈璐何嘉文李姝君
陈璐,何嘉文,李姝君
1开平市中心医院,广东开平 529300;2广东医科大学附属医院
肺癌已成为世界各国普遍关注的公共卫生问题[1]。据统计,肺癌患者数占全球癌症患者总数的11.6%,是导致癌症患者死亡的首要原因[2,3]。肽脯氨酰基顺反异构酶1(Pin1)是一类进化上十分保守的肽脯氨酰基顺反异构酶家族成员,最初报道于1996年,是由酵母双杂交筛选得到且功能特异、保守的蛋白质[4]。Pin1蛋白由163个氨基酸残基组成,相对分子质量为18 kD。Pin1蛋白质能特异性地催化底物蛋白质中磷酸化的丝/苏-脯氨酸基序(pSer/Thr-Pro)发生顺式和反式间的异构转化,改变其性质及亚细胞定位,进而调节底物蛋白质磷酸化后的功能[5,6]。Pin1在细胞分化、增殖、凋亡等活动中发挥重要调节作用,其功能失调可导致一系列生命活动紊乱。研究表明,Pin1异常高表达与恶性肿瘤细胞的发生发展密切相关,包括肺癌、肝癌、鼻咽癌、白血病、乳腺癌等,表明Pin1是肿瘤诊治的良好靶标[7~10]。KPT-6566是一种新型的Pin1小分子抑制剂,研究表明,KPT-6566可在体内外抑制宫颈癌、乳腺癌、前列腺癌和卵巢癌等细胞的增殖和迁移能力[11,12]。截至目前,KPT-6566对肺癌细胞的抑制作用研究鲜见报道。2019年4-11月,我们探讨了KPT-6566对肺癌A549细胞增殖、侵袭、凋亡的影响及机制。
1 材料与方法
1.1 材料 肺癌细胞株A549购自ATCC公司;KPT-6566药物购自上海陶术生物科技有限公司;胎牛血清购自Gibco公司;DMEM培养基和胰酶购自BI公司;DPBS缓冲液购自索莱宝公司;兔抗Ras、Raf、MEK、ERK单克隆抗体购自CST公司;兔抗PI3K、AKT单克隆抗体购自Abcam公司;兔抗MCL-1、MYC和Pin1单克隆抗体购自ProteinTech公司;TBST缓冲液购自碧云天生物有限公司;CCK-8增殖试剂盒购自日本Dojindo公司;引物由广州艾基生物技术有限公司合成,反转录试剂盒和实时荧光定量PCR试剂盒购自南京诺唯赞生物科技有限公司;Transwell小室购自Corning公司;APC/PI双染凋亡试剂盒购自武汉艾美捷科技有限公司;结晶紫染色液购自上海碧云天生物技术有限公司;倒置显微镜购自德国Leica公司;细胞孵箱购自美国Thermo科技公司;超净工作台购自苏州设备净化设备厂。
1.2 A549细胞培养与分组 将A549细胞置于含10%胎牛血清的DMEM完全培养基(常规加入双抗:100 mg/L链霉素和100 kU/L青霉素)普通细胞培养箱中培养,待细胞密度70%~80%则扩瓶传代培养。选取生长状态良好的A549细胞用于实验,分为对照组、低剂量组、中剂量组和高剂量组,低、中、高剂量组细胞培养液中分别加入终浓度为2.5、5和10 μmol/L KPT-6566溶液,对照组细胞则加入等体积的完全培养基。
1.3 细胞存活率测算 96孔培养板中接种肺癌A549细胞,数量为5×103/孔,普通细胞培养箱中培养24 h后充分去除细胞培养基,分别加入对照组、低剂量组、中剂量组和高剂量组培养液,每组实验设置3复孔,完全培养基组为空白组。各组细胞于培养箱中孵育24 h后加入CCK-8溶液,剂量为10 μL/孔,继续放入培养箱中培养4 h。取出培养板并借助全波长酶标仪检测450 nm处吸光度值(OD值),计算细胞存活率以评估癌细胞增殖能力。细胞存活率=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.4 细胞克隆能力检测 将肺癌A549细胞以2×102/孔数量接种于6孔板中,细胞贴壁后充分去除培养基,分别加入对照组、低剂量组、中剂量组和高剂量组培养液。细胞于孵箱中继续培养2周后用PBS缓冲液清洗3次。4%多聚甲醛固定1 h,PBS缓冲液清洗2次。结晶紫染色1 h后用PBS缓冲液充分洗涤,晾干,倒置显微镜下计算各组细胞克隆形成个数。
1.5 细胞侵袭能力检测 使用DMEM培养基充分湿润Transwell小室,加入50 μL Matrigel胶工作液,晃匀后置于24孔板中并放入培养箱中孵育0.5 h,备用。各组A549细胞以200 μL体积接种于Transwell上室,下室加入相应组别的药物培养基500 μL(胎牛血清浓度为20%),保证上下室药物浓度一致。将培养板置于细胞培养箱中继续培养24 h,实验终点时,充分去除上下室培养液,加入4%多聚甲醛溶液固定1 h后使用生理盐水清洗3次。加入结晶紫染色液充分染色40 min,移除染色液后用棉棒轻轻拭去残余Matrigel胶,Transwell小室于水流下充分清洗掉残存胶和染色液,倒扣放置晾干。倒置显微镜下观察并计算各组侵袭细胞数目。
1.6 细胞凋亡比例检测 将肺癌A549细胞以5×105/孔数量接种于6孔板中,贴壁培养过夜,充分去除培养基后用无菌PBS溶液冲洗1次,分别加入对照组、低剂量组、中剂量组和高剂量组培养液,每组实验设置3复孔,置于细胞培养箱中培养24 h。实验终点时,收集各组细胞离心并用无菌PBS溶液清洗2次,每管细胞以100 μL Binding buffer重悬,按照凋亡试剂盒说明书指示,避光条件下加入PI和APC各5 μL,置于4 ℃冰箱中避光孵育0.5 h,BD流式仪检测细胞凋亡比例。
1.7 各组细胞中Pin1、PI3K、AKT、MCL-1、MYC、Ras、Raf、MEK、ERK、GAPDH mRNA表达检测 各组细胞培养1 d后,利用TRIzol溶液裂解并提取细胞总RNA,将细胞总RNA逆转录成cDNA并储存于-80 ℃冰箱备用。以cDNA为模板,以GAPDH为内参,进行实时荧光定量PCR扩增。引物序列如下: Pin1正向引物为5′-TCGAGGGCCGAATTGTTTC-3′,反向引物为5′-GCTGCCGCATGAGTGTTC-3′; MCL-1正向引物为5′-CAAGAGTCCACAGACCTTTCATC-3′,反向引物为5′- TGTCACAGCACCCATGGTAT -3′;PI3K正向引物为5′-CCTCGGTGATATGGGAAAGAGA-3′,反向引物为5′-AGCCGAAACCAGCTCACTCA-3′;AKT正向引物为5′-GGCCTCAGCCCTCAGAAC-3′,反向引物为5′-TGCCACATTGCGCATAGCT-3′;MYC正向引物为5′-CACATGCCCAAGATTCACTGATAG-3′,反向引物为5′-GAGGTGGCTTGGACAGGTTAG-3′;Ras正向引物为5′-TTGTGGGACATATGCAGTGTG-3′,反向引物为5′-TCACTTCACAGCACATACTCCTA-3′;Raf正向引物为5′-TGACTCCTGTAAGGGAGAGGAAAG-3′,反向引物为5′-AGTCGCCATAAGGTTTGGAGTG-3′;MEK正向引物为5′-AGCCCACCAGCCAATGGAC-3′,反向引物为5′-TCAAGCGTCTAAGGGTTTACAAAC-3′; ERK正向引物为5′-TGCTCTGCATGTGGTAACTTG-3′,反向引物为5′-GAACCCTAGGAGCACTGACATC-3′;GAPDH正向引物为5′-CCTGCACCACCAACTGCTTAG-3′,反向引物为5′-TGAGTCCTTCCACGATACCAA-3′。建立20 μL qRT-PCR扩增体系,包含SYBR Green溶液10 μL,10 μmol/L 的相应基因上反向引物溶液各0.8 μL,cDNA 2 μL和DEPC水6.4 μL。PCR反应条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,共进行40个循环。内参基因选用GAPDH,利用2-ΔΔCt法分析各组细胞中Pin1、PI3K、AKT、MCL-1、MYC、Ras、Raf、MEK、ERK mRNA的相对表达量。
1.8 各组细胞中Pin1、PI3K、AKT、MCL-1、MYC、Ras、Raf、MEK、ERK 、GAPDH 蛋白表达检测 收集各组KPT-6566药物处理24 h后的A549细胞,使用无菌PBS溶液清洗2次。配制全细胞裂解液并向各组细胞中加入适量全细胞裂解液,置于冰上充分裂解20 min,12 000 r/min离心12 min后收集蛋白上清液并使用Bradford试剂盒检测各组细胞蛋白浓度。配制相应浓度的SDS-PAGE凝胶,每个泳道加入30 μg蛋白溶液,80 V恒压电泳约100 min,裁截合适大小的目的凝胶条带并盖上合适大小的PVDF膜,湿转法250 mA恒流转膜约100 min。转膜结束后将PVDF膜放置于5%脱脂牛奶溶液中封闭1.5 h,配制相应一抗溶液并将PVDF膜放置于抗体溶液中孵育过夜。TBST溶液清洗PVDF膜3次,每次8 min。室温下孵育相应的二抗溶液1.5 h,TBST溶液清洗4次,每次12 min。仔细沥干PVDF膜并加入ECL显影液,利用Tanon成像仪显影。使用Image J软件分析各组细胞蛋白相对表达量。
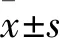
2 结果
2.1 各组细胞存活率比较 对照组、低剂量组、中剂量组和高剂量组细胞培养24 h后细胞存活率分别为100.00%±3.34%、80.80%±4.46%、55.75%±5.98%、29.98%±1.88%,组间相比P均<0.05。
2.2 各组细胞克隆形成能力比较 对照组、低剂量组、中剂量组和高剂量组细胞克隆形成个数分别为(155.33±12.76)、(123.33±12.71)、(62.00±9.90)、(28.00±9.09)个,组间相比P均<0.05。
2.3 各组细胞侵袭能力比较 对照组、低剂量组、中剂量组和高剂量组细胞侵袭细胞数分别为(113.33±6.55)、(80.67±6.02)、(47.33±3.30)、(20.33±3.30)个/HP,组间相比P均<0.05。
2.4 各组细胞凋亡率比较 对照组、低剂量组、中剂量组和高剂量组细胞凋亡率分别为5.81%±1.26%、14.81%±1.59%、36.04%±2.30%、63.23%±3.36%,组间相比P均<0.05。
2.5 各组细胞中Pin1、AKT、MCL-1、MYC、Ras、Raf、MEK、ERK、PI3K mRNA相对表达量比较 对照组细胞中Pin1、AKT、MCL-1、MYC、Ras、Raf、MEK、ERK、PI3K mRNA相对表达量分别为1.00±0.06、1.00±0.10、1.00±0.10、1.00±0.14、1.00±0.06、1.00±0.05、1.00±0.09、1.00±0.07、1.00±0.06,低剂量组细胞中Pin1、AKT、MCL-1、MYC、Ras、Raf、MEK、ERK、PI3K mRNA相对表达量分别为0.80±0.03、0.81±0.03、0.72±0.05、0.76±0.06、0.82±0.03、0.83±0.04、0.77±0.03、0.76±0.05、0.79±0.05,中剂量组细胞中Pin1、AKT、MCL-1、MYC、Ras、Raf、MEK、ERK、PI3K mRNA相对表达量分别为0.52±0.05、0.62±0.03、0.48±0.03、0.46±0.05、0.64±0.04、0.66±0.06、0.55±0.06、0.46±0.06、0.58±0.04,高剂量组细胞中Pin1、AKT、MCL-1、MYC、Ras、Raf、MEK、ERK、PI3K mRNA相对表达量分别为0.31±0.04、0.45±0.03、0.26±0.05、0.25±0.05、0.46±0.04、0.49±0.04、0.32±0.05、0.24±0.05、0.39±0.03,组间相比P均<0.05。
2.6 各组细胞中Pin1、AKT、MCL-1、MYC、Ras、Raf、MEK、ERK、PI3K蛋白相对表达量比较 对照组细胞中Pin1、AKT、MCL-1、MYC、Ras、Raf、MEK、ERK、PI3K 蛋白相对表达量分别为1.00±0.14、1.00±0.12、1.00±0.07、1.00±0.14、1.00±0.07、1.00±0.07、1.00±0.04、1.00±0.15、1.00±0.06,低剂量组细胞中Pin1、AKT、MCL-1、MYC、Ras、Raf、MEK、ERK、PI3K蛋白相对表达量分别为0.72±0.04、0.80±0.02、0.77±0.06、0.71±0.04、0.78±0.03、0.82±0.03、0.75±0.05、0.76±0.04、0.79±0.03,中剂量组细胞中Pin1、AKT、MCL-1、MYC、Ras、Raf、MEK、ERK、PI3K蛋白相对表达量分别为0.41±0.03、0.66±0.06、0.58±0.03、0.52±0.03、0.57±0.03、0.69±0.04、0.55±0.05、0.58±0.04、0.52±0.05,高剂量组细胞中Pin1、AKT、MCL-1、MYC、Ras、Raf、MEK、ERK、PI3K蛋白相对表达量分别为0.17±0.03、0.47±0.03、0.42±0.03、0.35±0.06、0.33±0.06、0.48±0.03、0.35±0.06、0.35±0.05、0.23±0.05,组间相比P均<0.05。
3 讨论
人类Pin1基因位于19号染色体,编码的蛋白质由163个氨基酸残基组成,包含两个结构域,分别为WW(色氨酸—色氨酸)中心区和PPIase(肽基脯氨酰顺反异构酶)区。WW区以两个恒定的色氨酸为特征,可介导酶与底物识别;PPIase区包含活化位点,能够高效地催化蛋白质氨酰残基N-末端的肽键发生顺反异构。另外,WW区与PPIase区中间由可变序列连接[13,14]。前期研究表明Pin1异常高表达于肺癌细胞,与肿瘤细胞的发生发展密切相关,导致肺癌患者预后不良,表明靶向Pin1是拓展肺癌治疗的新方向[15~17]。KPT-6566是一种新型的Pin1小分子抑制剂,以共价键形式结合于Pin1催化活性区-PPIase区,PPIase活性IC50为0.64 μmol/L,可介导细胞中Pin1蛋白质发生降解[12]。本实验结果显示,KPT-6566抑制肺癌A549细胞中Pin1的表达水平,显著抑制A549细胞增殖能力。研究表明,沉默Pin1可减弱肿瘤细胞克隆形成能力,增加细胞凋亡比例,阻滞癌细胞生长周期进展,抑制细胞转移活性[18,19],证明Pin1在恶性细胞生物学活性中发挥着重要作用。本研究发现,Pin1在肺癌细胞恶性生物学活性中扮演着重要的作用,其抑制剂KPT-6566可显著抑制肺癌A549细胞克隆形成活性,增加凋亡细胞比例,减弱癌细胞的侵袭转移能力。
KPT-6566可通过抑制Pin1活性从而调控肺癌细胞恶性生物学功能,但具体机制尚未明确。前期研究显示,PI3K/AKT和MEK/ERK信号转导通路对细胞增殖、迁移及恶性肿瘤血管内皮细胞的生成有重要调节作用,Pin1基因可调控肿瘤细胞中PI3K/AKT和MEK/ERK信号活性,影响PARP、MCL-1表达和DNA损伤从而调节细胞增殖活性[20]。此外,Pin1可协同激活细胞中MYC和NRF2、Raf和FOXM1活性并活化Ras/ERK/NRF2通路,调控癌细胞中线粒体功能和氧化还原稳态,影响抗凋亡蛋白MCL-1活性并介导恶性肿瘤细胞的永生化和化疗耐药作用,促进癌细胞的发生发展,导致临床患者预后不良[21]。与前期研究相似。
本研究发现,Pin1小分子抑制剂KPT-6566可抑制肺癌A549细胞中Pin1介导的PI3K/AKT和MEK/ERK信号通路活性,降低MCL-1和MYC分子表达量,从而抑制癌细胞增殖和迁移等恶性生物学活性。
综上所述,KPT-6566可阻滞肺癌细胞增殖并促进其凋亡,抑制癌细胞迁移扩散能力,其作用机制可能与Pin1调节PI3K/AKT和MEK/ERK信号转导通路相关。
