睾丸原发性非特指类型外周T细胞淋巴瘤3例临床病理分析
2020-12-30李荣岗陈兰花
李荣岗,陈兰花
睾丸原发性淋巴瘤(primary testicular lymphoma, PTL)是临床少见的恶性肿瘤,组织学类型以弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma, DLBCL)最为常见,原发性T细胞淋巴瘤以NK/T最常见[1-3],而非特指类型外周T细胞淋巴瘤(peripheral T cell lymphoma, no otherwise specified, PTCL-NOS)临床罕见,由于其发病率低,国外报道较少[4-7],而国内学者也未将该类型单独进行分析。本文收集3例睾丸原发性PTCL-NOS,并结合文献复习,探讨其临床病理学特征、免疫表型、诊断及鉴别诊断等,提高临床与病理医师的认识水平。
1 材料与方法
1.1 临床资料收集2013年8月~2014年10月广东省江门市中心医院、广东省江门市人民医院及外院会诊的睾丸原发性PTCL-NOS各1例。3例患者年龄分别为58、61和67岁,发生于左侧睾丸2例,右侧1例,均表现为睾丸无痛性肿大。发病时间1~3个月。Ann Arbor分期:ⅠE期2例,ⅡE期1例。
1.2 方法手术标本均经10%中性福尔马林固定,常规取材,3 μm厚连续切片、HE染色,镜下观察。免疫组化染色采用EnVision两步法,抗体CD3、CD4、CD5、CD7、CD8、CD10、CD20、CD79a、TdT、CXCL13、CD43、CD45RO、Granzyme B、Perforin、Ki-67、CD15、CD30、ALK、CK(AE1/AE3)、EMA,均购自北京中杉金桥公司。一抗均设阴、阳性对照。荧光原位杂交EBER试剂盒购自丹麦DAKO公司,TCR基因重排检测试剂盒购自上海源奇公司。具体操作步骤严格按试剂盒说明书进行。
1.3 结果判读Granzyme B、Perforin和CXCL13阳性定位于胞质,TdT和Ki-67阳性定位于胞核,其余抗体均为胞膜着色。EBER原位杂志检测和TCR基因重排根据试剂盒说明书标准进行判读。
2 结果
2.1 影像学及实验室检查3例患者腹部和盆腔超声、MRI均发现睾丸实质性肿块(图1);患者均未发现皮肤结节,也未发现B症状(发热、盗汗、体重下降)。全身CT及ECT(全身骨骼显像)未发现异常,骨髓穿刺未见异常,实验室检查均未发现异常。
2.2 病理特征肿瘤直径4.0~7.0 cm,切面呈结节状,灰白色或灰红色,质软,鱼肉样,边界不清(图2),其中1例见局灶性出血及囊性区域;3例均未见附睾及精索受累。镜下形态基本一致,均见睾丸结构不同程度破坏,仅见生精上皮细胞团及分散的生精小管;肿瘤细胞在上皮细胞团及小管间弥散分布(图3);见肿瘤性淋巴细胞浸润生精上皮巢或小管,形成淋巴上皮病变;肿瘤细胞小至中等大,见少许嗜酸性胞质,核圆形、椭圆形、多角形、杆状、马蹄形及肾形;核膜褶皱明显,少量瘤细胞见核裂;核分裂象易见;背景少量小淋巴细胞及嗜酸性粒细胞浸润,小血管增生、分支,见血管内瘤栓。
2.3 免疫表型3例睾丸原发性PTCL-NOS中CD3(图4)、CD4、CD43、CD45RO均阳性,1例Granzyme B和Perforin共阳性,CD5、CD7、CD8、CD10、CD20、CD79a、TdT、CXCL13、CD15、CD30、ALK均阴性,CK(AE1/AE3)和EMA显示残留生精上皮弱阳性,Ki-67增殖指数为60%~90%。
2.4 分子检测3例睾丸原发性PTCL-NOS中EBER原位杂交检测均阴性(图5),TCR基因重排均阳性(图6)。
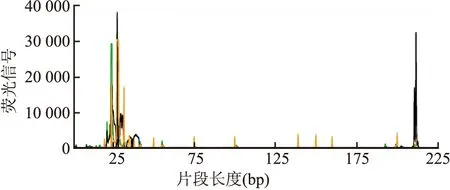
图6 TCR重排阳性
2.5 治疗及随访3例患者均行睾丸完整切除,术后辅助放疗和鞘内注射甲氨蝶呤,2例行CHOEP化疗8个疗程,1例行CHOP化疗7个疗程。3例患者出院时均评估为完全缓解(complete response, CR),国际预后指数(international prognostic index, IPI)2例为1分,1例为0分,PTCL-U预后指数风险评估均为低度危险性。术后3个月,3例患者均行头颈部及盆腔CT和MRI复查;术后6个月1例行MRI复查,其余2例行全身PET-CT复查,均未发现复发及其他脏器累及。随访时间18~60个月,2例患者分别于确诊后18、24个月因脑转移死亡,1例随访中,影像学、骨髓穿刺及实验室检查未发现复发及其他脏器累及征象。
3 讨论
目前,PTL的定义尚存争议。Hurley等[8]认为以睾丸肿块为原发或主要症状,并且无明显其他结外器官受侵。国内学者[9]则认为PTL的诊断标准需满足以下条件:睾丸及其附属结构为首诊部位;诊断时有或无区域淋巴结侵犯;诊断后3个月无其他部位侵犯;有明确的病理诊断。Zucca等[10]从临床角度出发,提出以睾丸肿块为临床表现的淋巴瘤即为PTL,将伴其它结外器官侵犯的病例也纳入其分析范畴,这使该肿瘤的分期(尤其是Ⅲ、Ⅳ期)趋于完善。本组3例参照以上任何标准,均符合PTL的诊断。睾丸原发性PTCL-NOS临床罕见,患者年龄40~67岁,平均55.1岁,与PTL总发病年龄基本一致(表1)[11]。有文献报道[12]PTL右侧睾丸发生率高于左侧(13/11),但本实验显示,睾丸PTCL-NOS左侧病变发生率略高于右侧(4/3)。
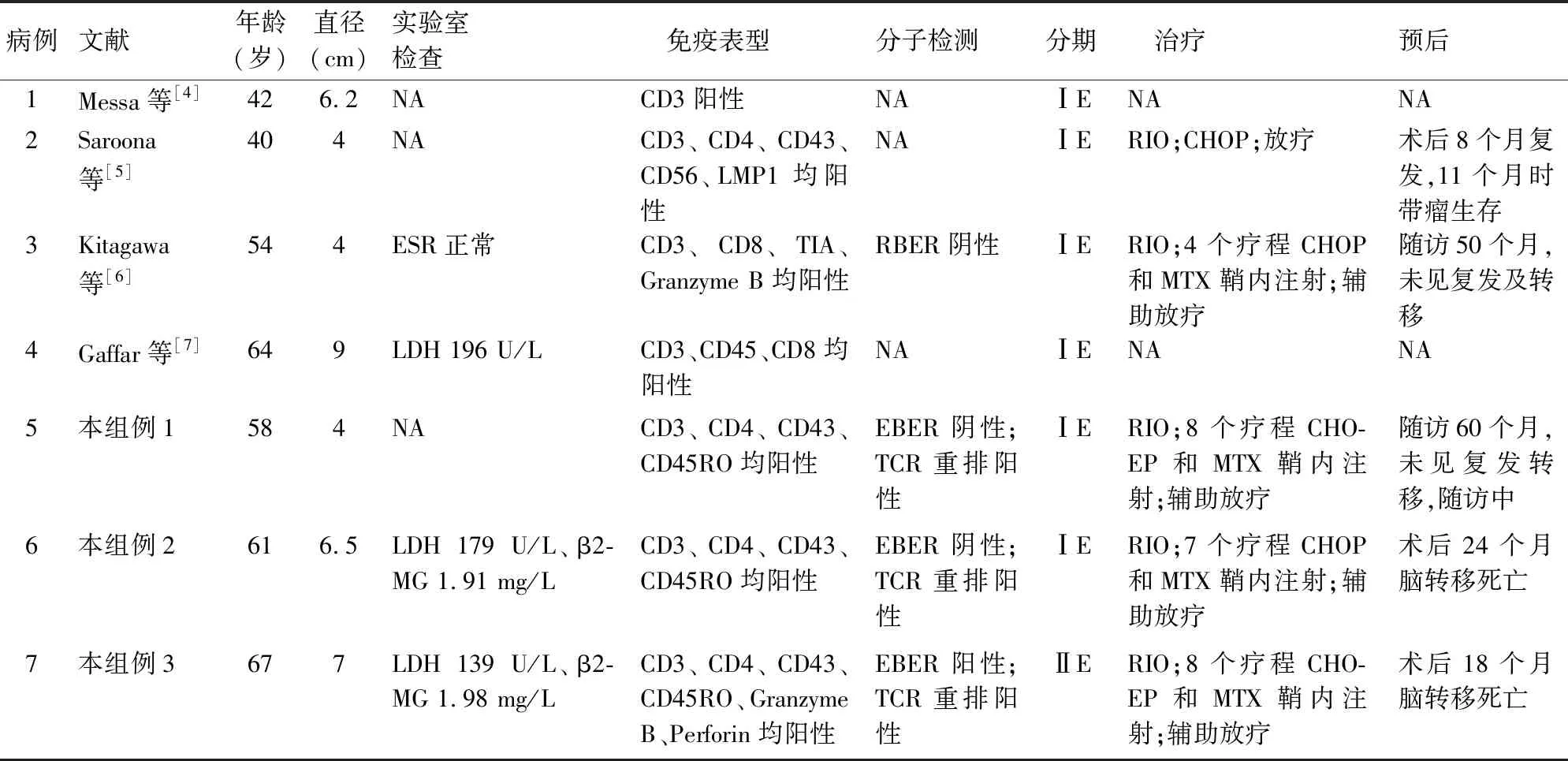
表1 本组及文献报道7例睾丸原发性PTCL-NOS的临床病理资料
目前,PTCL-NOS的发病原因及机制尚不清楚。His等[13]研究发现,SPll、STK6、PDGFRa和SH2D1A等癌基因的过表达是PTCL-NOS发生、发展的驱动因素。段瑞等[14]发现PTCL-NOS的T细胞受体基因在14q11和7q32-36处基因突变,可导致相关癌基因过表达,可能与该肿瘤的发生有关。
睾丸原发性PTCL-NOS初始症状大多表现为单侧或双侧睾丸无痛性、渐进性肿大。临床分期沿用Ann Arbor分期方法,本组及文献报道7例睾丸原发性PTCL-NOS患者中,6例为ⅠE期。
睾丸原发性PTCL-NOS瘤体直径1.5~9.0 cm,呈灰白至粉红色,细腻、鱼肉样,边界不清。镜下生精小管数量明显减少,肿瘤细胞密度较高,弥漫分布,瘤细胞胞质稀少,核多形性显著,卵圆形或不规则、扭曲,核膜不光滑,背景常伴嗜酸性粒细胞、中性粒细胞、组织细胞及浆细胞浸润,可有局灶性坏死,血管浸润比较常见;60%的患者可见脉管内瘤栓,30%的患者间质纤维化伴玻璃样变[5]。本组3例患者均见明显脉管内瘤栓,与文献报道一致[5]。肿瘤细胞表达成熟T细胞标志物,包括CD3、CD4、CD43、CD45RO,小部分病例可表达细胞毒相关标志物如Granzyme B和Perforin,但某些情况下可能会出现肿瘤细胞丢失一种或多种抗原的情况。此时,需用一组抗体并加做相应的分子检测。原发于睾丸的PTCL-NOS分子检测TCR基因重排阳性,EBER原位杂交检测阴性。最近,Amador等[15]根据转录因子GATA3和TBX21将PTCL-NOS分为2个分子亚型:PTCL-GATA3型和PTCL-TBX21型,结果显示两者在致癌机制和预后上均有不同,TBX21阳性组5年总生存率明显低于GATA3阳性组。
鉴别诊断:(1)睾丸慢性炎,患者常有发热和排尿困难等症状,镜下病变呈多灶性,炎细胞成分复杂,IgG/TCR基因重排检测有助于鉴别;(2)精原细胞瘤,多见于40岁以下年轻人,镜下瘤灶内缺乏正常的生精小管,肿瘤细胞核仁显著,表达PLAP,不表达T细胞标志物,可资鉴别;(3)血管免疫母细胞性T细胞淋巴瘤,与PTCL-NOS形态学有重叠,多为系统性疾病,且伴有明显的高内皮分支状血管和滤泡树突细胞增生,CD10和CXCL13阳性有助于鉴别,有研究发现TET2和DDNMT3A对诊断血管免疫母细胞性T细胞淋巴瘤有实用价值[16];(4)NK/T细胞淋巴瘤,患者较年轻,凝固性坏死、核碎片及凋亡小体常见,有血管中心性浸润和血管破坏,典型免疫组化标记CD2阳性、CD3阴性,大部分TCR基因重排阴性。

①②③④⑤图1 MRI呈长T1、长T2信号改变,病灶内T2WI上见片状等、低信号影 图2 肿瘤呈结节状,灰白色或灰红色、质软,鱼肉样图3 睾丸结构破坏,肿瘤细胞在生精小管间弥漫分布 图4 肿瘤细胞CD3呈阳性,EnVision两步法 图5 肿瘤细胞EBER原位杂交检测阴性
睾丸原发性PTCL-NOS临床少见,肿瘤多于2年内复发或转移,复发主要部位为对侧睾丸,中枢神经系统是最常见的转移部位,本组有2例患者于术后2年内因脑转移死亡,提示该组肿瘤临床呈高度侵袭性。目前,尚无统一治疗方案。多数学者推荐睾丸根治切除并术后联合放、化疗。现阶段睾丸原发性PTCL-NOS的治疗仍需积累更多病例进一步分析,以期寻找更好的治疗方案。
