错配修复蛋白联合p53蛋白检测在肝细胞癌预后中的应用
2020-12-30白茹梦陈春妮宋国新张智弘
白茹梦,江 悦,陶 燃,陈春妮,宋国新,张智弘
原发性肝细胞癌是一类病死率高的肿瘤,亚洲患者中尤为常见[1]。流行病学研究已经确定慢性乙型肝炎或丙型肝炎病毒感染以及黄曲霉素B1的饮食暴露是该疾病最主要的致病因素[2-3]。虽然现阶段改进了诊断技术及治疗方法,但有大肿瘤或多发肿瘤的患者预后仍较差[1,4]。基因组不稳定包括两类,染色体不稳定(chromsome instability, CIN)和微卫星不稳定(microsatellite instability, MSI)[5]。微卫星也称为短串联重复(short tandem repeats)或简单重复序列(simple sequence repeats, SSR),由长度为1~6个碱基的重复序列组成[2,6]。MSI是由错配修复(mismatch repair, MMR)基因突变或其基因启动子区的高甲基化引起的超突变表型[2-3],在该过程中起关键作用的4种基因包括:MLH1、MSH2、MSH6和PMS2[7],其编码的蛋白可通过形成异二聚体,识别DNA复制过程中碱基对的错配和小核苷酸的插入或缺失突变[8]。TP53基因定位于染色体17p13.1上,编码p53蛋白[1,9]。野生型p53是众所周知的肿瘤抑制基因,参与调控细胞增殖、周期、凋亡等和DNA损伤修复,p53突变可能导致包括肝癌在内的50多种肿瘤的发生、发展[10-11]。
由于肝细胞癌的病因以及用于筛查MSI的技术变化较大,目前关于肝细胞癌中MSI的发生率仍存在一定差异,并且p53与肝细胞癌患者生存的关系仍存在争议。本文采用免疫组化EnVision两步法检测肝细胞癌中4种MMR及p53蛋白的表达,旨在探讨其与肝细胞癌临床病理特征的关系及预后价值。
1 材料与方法
1.1 材料收集2012年8月1日~2013年12月31日南京医科大学第一附属医院行外科手术切除的肝细胞癌石蜡组织标本220例,除外胆管细胞癌和混合型肝癌。收集患者临床病理资料及随访包括患者年龄、性别、复发和转移、分化程度、纤维化程度、脉管内癌栓、总生存期和无进展生存期等,所有标本均未行放、化疗及针对肿瘤的其他治疗。
1.2 组织芯片选择具有代表性的肝细胞癌区域和正常组织区域进行组织芯片制作,采用美国Beecher组织芯片阵列仪,蜡块分成肝细胞癌块和正常组织块,直径为1.0 mm的代表性组织取自福尔马林固定石蜡包埋(formalin-fixed paraffin-embedded,FFPE)组织,并填充于空白蜡块中。
1.3 免疫组化采用免疫组化EnVision两步法,将组织芯片蜡块4 μm厚切片后,烤片1~2 h,脱蜡水化。高压下修复抗原,分别滴加MLH1(鼠单抗ES05)、MSH2(兔单抗RED2)、MSH6(兔单抗EP49)、PMS2(兔单抗EP51)、p53(鼠单抗MX008)一抗,在4 ℃冰箱中孵育过夜,用PBST洗涤3次后加入二抗,室温下孵育17 min,PBST洗涤3次,DAB(即配即用)显色3~5 min,经苏木精复染后分化、脱水、透明和封固。所用试剂均购自福州迈新公司。
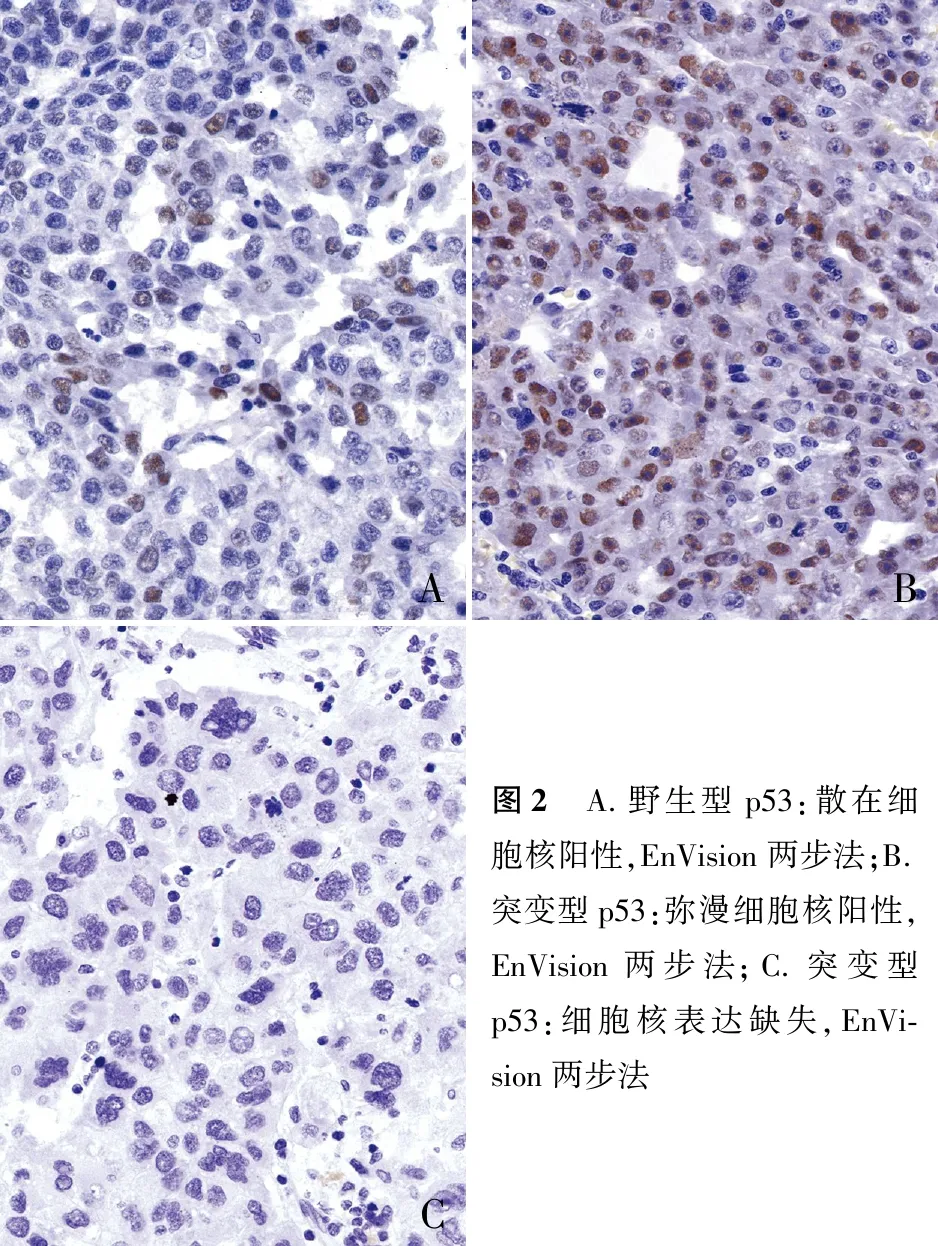
1.4 结果判读免疫组化染色由两名高年资病理科医师采用双盲法阅片。MMR阳性定义:细胞核不着色为表达缺失,超过1%的细胞核着色完整为阳性,4种MMR基因蛋白MLH1、MSH2、MSH6、PMS2均表达者为错配修复基因完整(pMMR),有一种及以上蛋白表达缺失者为错配修复基因缺陷(dMMR)。p53免疫组化染色为细胞核阳性;p53突变型定义为肿瘤细胞中有弥漫强阳性核染色或所有肿瘤细胞中p53完全不表达。
1.5 统计学分析所有数据均采用SPSS 17.0软件进行统计学分析,与临床病理特征之间的关系采用χ2检验和Fisher精确检验,单因素生存分析采用Kaplan-Meier分析、Log-rank检验,Cox多因素回归模型用于评估肝细胞癌患者的死亡风险,以P<0.05为差异有统计学意义。
2 结果
2.1 临床特征220例肝细胞癌组织中,男性178例,女性42例;患者年龄27~84岁,≤60岁者149例,>60岁者71例;肿瘤最大直径为1.0~20.0 cm,其中≤3 cm者68例,>3 cm者152例;高+中度分化179例,低分化41例;纤维化程度分为肝纤维化68例,肝硬化152例;有脉管内癌栓46例和无脉管内癌栓174例;无复发转移83例,有复发转移83例,失访54例;仅肝脏转移56例,有远处转移22例,失访5例;AFP水平≤400 ng/mL者129例,>400 ng/mL者85例,失访6例;总生存时间为0~60.8个月,平均34.3个月,中位生存时间为40.1个月;无进展生存时间为0~58.6个月,平均29.1个月。
2.2 肝细胞癌中MMR表达与临床病理特征的关系肿瘤细胞中dMMR(MLH1、MSH2、MSH6和PMS2)发生率为64.9%(图1);其中肿瘤最大直径≤3 cm者32例,>3 cm者99例,两者相比差异有统计学意义(P=0.015);高+中分化者115例,低分化者16例,差异有统计学意义(P=0.017);复发转移部位仅肝脏转移者38例,伴有远处转移为8例,差异有统计学意义(P=0.027);而与患者性别、年龄、纤维化程度、脉管内癌栓、AFP水平及复发和转移无关(表1)。
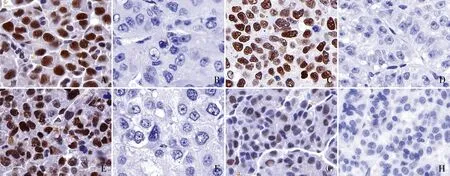
图1 A.肝细胞癌中MLH1细胞核阳性,EnVision两步法;B.肝细胞癌中MLH1细胞核阴性,EnVision两步法;C.肝细胞癌中MSH2细胞核阳性,EnVision两步法;D.肝细胞癌中MSH2细胞核阴性,EnVision两步法;E.肝细胞癌中MSH6细胞核阳性,EnVision两步法;F.肝细胞癌中MSH6细胞核阴性,EnVision两步法;G.肝细胞癌中PMS2细胞核阳性;H.肝细胞癌中PMS2细胞核阴性,EnVision两步法
2.3 肝细胞癌中p53表达与临床病理特征的关系p53在癌旁组织中均为阴性,在肿瘤组织中突变率为72.4%(图2);其中高+中分化者为129例,低分化者为23例,差异有统计学意义(P=0.009);无脉管内癌栓者127例,有脉管内癌栓者25例,差异有统计学意义(P=0.019);AFP水平≤400 ng/mL者为98例,>400 ng/mL者为49例,差异有统计学意义(P=0.003);而与患者性别、年龄、肿瘤大小、复发与转移及其部位无关(表1)。

表1 肝细胞癌中MMR、p53与临床病理特征的关系[n(%)]
2.4 MMR、p53表达与预后的相关性MMR与p53突变之间无显著相关性(表2)。Kaplan-Meier生存分析显示,MMR与肝细胞癌患者的总生存期(P=0.507)和无进展生存期(P=0.538)无相关性(图3);p53突变也与肝细胞癌患者的总生存期(P=0.220)和无进展生存期(P=0.344)无相关性(图4)。pMMR病例中,p53突变与肝细胞癌患者的总生存期(P=0.392,图5A)和无进展生存期(P=0.298,图5B)之间无显著相关性;而dMMR病例中,p53突变与肝细胞癌患者的总生存期(P=0.009,图5C)和无进展生存期(P=0.013,图5D)之间有显著相关性,即野生型p53伴MMR蛋白缺陷的患者预后较差。Cox单因素生存分析表明肿瘤最大径、AFP水平、复发转移及其部位是肝细胞癌预后较差的危险因素(表3)。Cox多因素回归分析表明肝细胞癌患者中伴有肝外转移者的死亡风险是仅有剩余肝脏转移者的3.331倍(表4)。

图3 MMR蛋白与肝细胞癌患者总生存期(A)和无进展生存期(B)的Kaplan-Meier生存分析
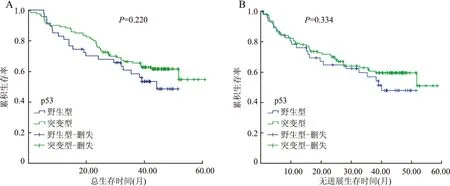
图4 p53与肝细胞癌患者总生存期(A)和无进展生存期(B)的Kaplan-Meier生存分析
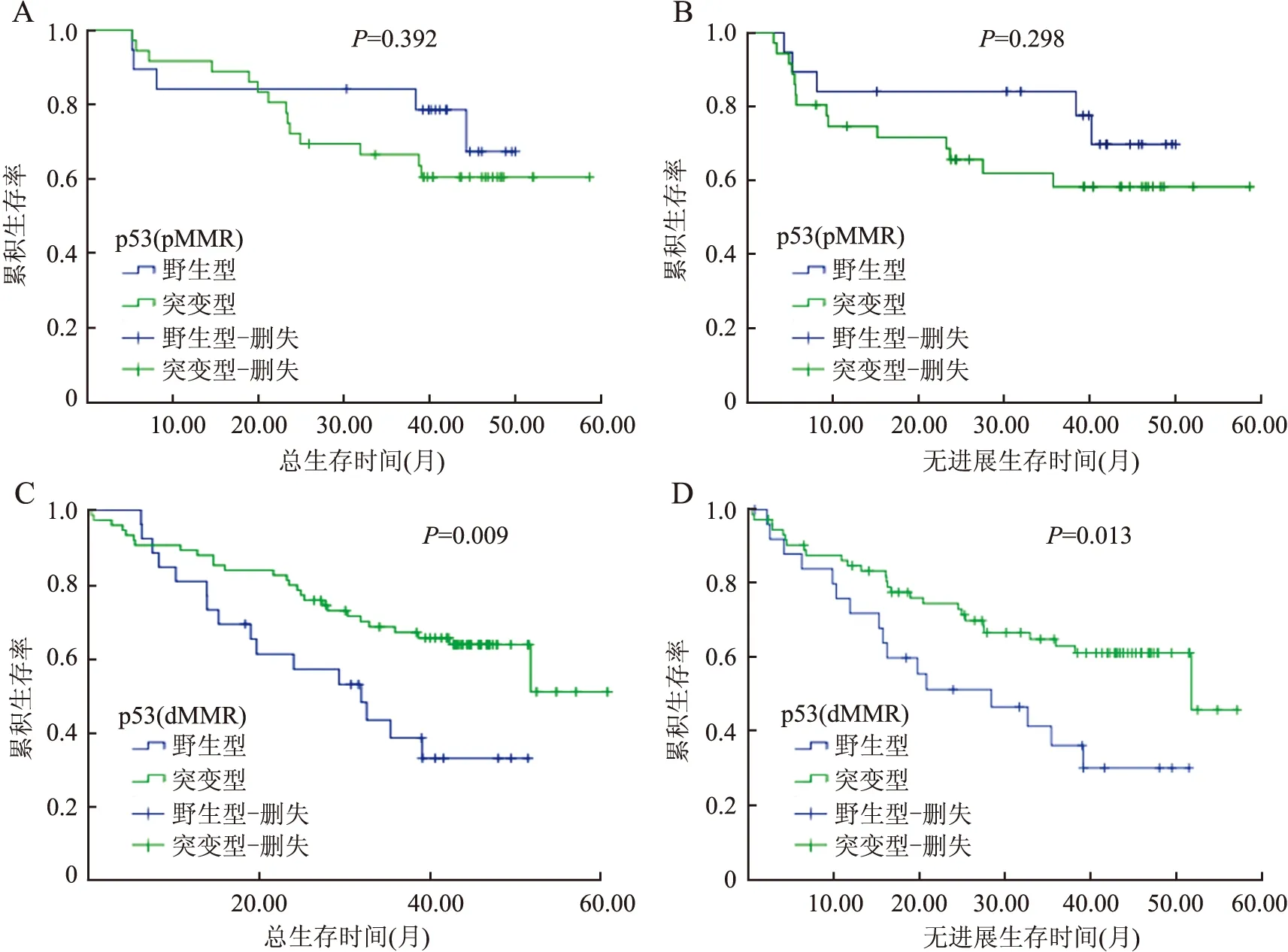
图5 A.pMMR中p53与肝细胞癌患者总生存期的Kaplan-Meier生存分析;B.pMMR中p53与肝细胞癌患者无进展生存期的Kaplan-Meier生存分析;C.dMMR中p53与肝细胞癌患者总生存期的Kaplan-Meier生存分析;D.dMMR中p53与肝细胞癌患者无进展生存期的Kaplan-Meier生存分析
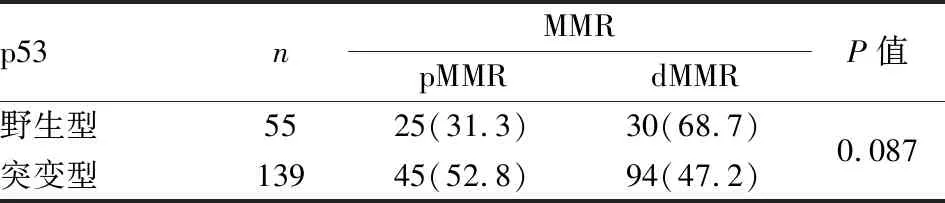
表2 MMR与p53表达的相关性[n(%)]
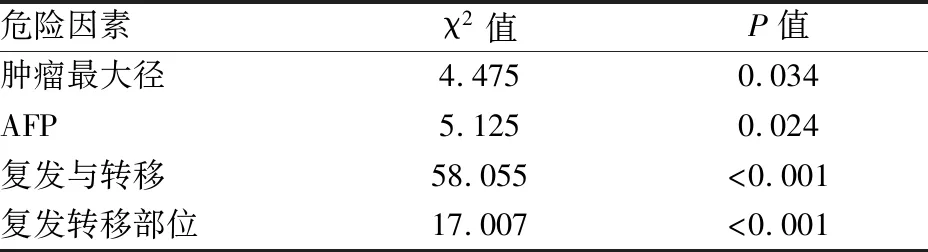
表3 Cox单因素生存分析

表4 Cox多因素生存分析
本组标本220例,由于制片损耗MMR组有效例数为202例,p53组有效例数为210例,共同有效病例数为194例
3 讨论
不同肿瘤类型中MSI频率存在较大的差异,多数研究表明肝细胞癌中MSI的频率为0~48%[2,4]。Han等[12]研究表明:MSI仅存在于15%散发性结直肠癌中,但依然是结直肠癌患者良好预后和免疫治疗的可靠标志物。MSI可有效预测右侧结直肠癌患者的无进展生存期,尤其是女性患者。Zhang等[3]研究表明:在1个或多个位点的56例肝细胞癌中有18例(32.1%)发现MSI,其中有10例(17.9%)伴高度MSI,且肝硬化组织中MSI的发生率(27%)几乎是正常肝组织的3倍,肝细胞癌组织中MSI的发生率与肝硬化的发生率无明显差异。Kazachkov等[13]研究发现MSI可能在10例患者中有4例起促进肝癌发生的作用,且其与p53之间无相关性。本组通过免疫组化EnVision两步法检测4种MMR蛋白(MLH1、MSH2、MSH6和PMS2)和p53蛋白,发现肝细胞癌患者中dMMR的发生率为64.9%(131/202),p53蛋白突变率为72.4%(152/210),两者之间无相关性,与Kazachkov等[13]报道相符。本实验还发现肝细胞癌中dMMR与患者肿瘤大小、分化程度及复发和转移部位相关,差异有统计学意义;与患者性别、年龄、纤维化程度、脉管侵犯、复发和转移等无关。可能是由于MMR蛋白在细胞中主要扮演DNA复制和转录的“监督者”的角色,一旦细胞出现异常突变,MMR蛋白立即启动修复,dMMR往往与细胞生长等指标如肿瘤大小、分化程度和复发等显著相关,而与患者年龄、性别和纤维化程度等差异无显著性。
Nikolova等[14]报道p53突变与肿瘤患者局部复发、治疗失败以及许多类型肿瘤患者低生存率等相关。Yang等[10]则认为虽然p53具有良好的抗肿瘤作用,但其在肝细胞癌中的预后价值较低。因此,p53表达不能用于预测肝细胞癌患者的生存率,与本实验结果相符。
Perez等[5]研究结果表明MMR在结直肠癌中未引起TP53突变,可能是由于其他生长调节基因比TP53更容易在MMR缺乏的背景下产生突变,而这些其他基因的突变可能会降低TP53突变的概率。本组发现尽管单一MMR或p53与肝细胞癌患者的总生存期和无进展生存期无相关性,但MMR缺陷患者中p53突变与肝细胞癌患者的总生存期和无进展生存期有相关性(P=0.009、P=0.013),即MMR蛋白缺陷且p53突变型患者具有较好的预后。Florijan等[15]报道肾肿瘤中携带功能性突变p53的患者预后较好,为预测肝细胞癌患者的预后又提出一项可行的方案。相反MMR蛋白稳定的患者中p53与总生存期和无进展生存期无相关性(P=0.392、P=0.298),可能是由于在MMR蛋白稳定的状态下可以修复DNA复制或转录中的突变,保证基因组的稳定性,同时也包括减少p53突变的概率。本组采用免疫组化EnVision两步法代替PCR法检测MSI,具有成本低、难度小的特点,但只能检测到数量有限的MMR蛋白,由于所选病例不同、试剂敏感性差异、实验操作中的误差以及免疫组化阳性尚无统一标准,均会产生较多假阳性或假阴性结果。DNA测序可通过检测DNA修复基因的突变来评估MSI状态,被誉为检测MSI的“金标准”;Yan等[16]通过对比免疫组化和DNA测序发现,两种检测方法之间存在适度的一致性,联合检测或许会得到更为可靠的结果。
本组使用免疫组化EnVision两步法检测p53和4种MMR蛋白,结果表明dMMR与肿瘤大小、分化程度和复发转移部位相关,而p53突变与分化程度、脉管内癌栓和AFP水平相关,且联合MMR蛋白和p53检测可以较好预测患者的预后,即MMR蛋白缺陷且p53突变型患者的总生存期明显高于其他患者,为临床预测肝癌患者的预后又提出一项可行的方案。
