Polycomb蛋白SUZ12在肝细胞癌组织中的表达及与预后的关系
2020-12-30郑唐辉薛同春
郑唐辉 薛同春
(1 复旦大学附属中山医院厦门医院肝肿瘤内科,福建 厦门 361015;2 复旦大学附属中山医院肝肿瘤内科,上海 200032)
肝细胞癌(hepatocellular carcinoma,HCC)是高致死性的恶性肿瘤之一,其在全球肿瘤致死性病因中排名第4位[1]。目前尽管有外科切除、介入、化疗、口服靶向药物、免疫抑制剂等治疗方法,但由于对肝癌的发生、发展机制仍不十分明确,使其5年总体生存率仍不到20%[2]。因此,探索潜在的促癌基因靶点对指导HCC的临床治疗具有显著必要性。
多梳蛋白SUZ12(suppressor of zeste 12)是由人类SUZ12 基因所编码的蛋白质,近年来该编码基因备受关注。正常情况下,SUZ12基因与EED基因(embryonic ectoderm development)及EZH1/2基因(enhancer of zeste homolog 1 or 2)协同参与染色质形成、基因表达及干细胞分化等,该作用贯穿于果蝇到人类等物种的全生命周期[3]。目前,已发现SUZ12的异常表达与多种恶性肿瘤的发生、发展及临床预后密切相关[4-5],然而在原发性肝癌中的研究仍缺乏足够的报道。本研究应用免疫组织化学的方法检测SUZ12蛋白在HCC中的表达情况,着重探索其与原发性肝癌患者的临床预后关系。
1 资料与方法
1.1 一般资料 由复旦大学附属中山医院随机提供于2007年11月至2008年6月手术切除的肝血管瘤正常肝组织27例,原发性肝癌标本88例及相应的癌旁组织。肝癌患者中,其中男性71例,女性17例;年龄24~79岁,平均年龄(53.47±6.52)岁;临床病例分期按美国联合癌症委员会(AJCC)法:Ⅰ期42例,Ⅱ期20例,Ⅲ期26例,Ⅳ期0例。所有患者术前均无肝外远处转移、放疗、化疗或其他辅助性治疗。全部标本均经病理证实为HCC,并用10%福尔马林固定、常规石蜡包埋。
1.2 主要试剂 兔抗人SUZ12单克隆抗体购买自美国Proteintech公司。工作溶度按1∶40的体积溶度进行稀释;山羊抗兔免疫组织化学染色试剂盒、浓缩型DAB试剂盒、一抗稀释液、柠檬酸缓冲液(抗原修复液)、PBS、盖玻片均购自上海生物科技公司。其余实验器材和常规试剂均为实验室统一配制。
1.3 方法
1.3.1 组织芯片制备 含有88例人HCC,27例正常肝组织。组织芯片由复旦大学附属中山医院病理科按科室建立的技术平台制备,组织芯片直径1.0 mm,石蜡切片厚5 μm。
1.3.2 免疫组织化学检测 组织芯片常规脱蜡、水化,0.01 mol/L柠檬酸缓冲液(pH=6.0)微波抗原修复,0.3% H2O2阻断内源性过氧化物酶,正常山羊血清封闭。兔抗人SUZ12抗体按1∶40稀释后作为第一抗,山羊抗兔抗体作为第二抗进行免疫组化染色,DAB显色,苏木精对比染色。最后常规脱水、透明、干燥、封片、镜检、拍照。
1.3.3 结果判定 由Pannoramic MIDI扫描仪(3D HISTECH公司)对组织芯片进行图像采集,应用配套软件densito quant自动分析出强阳性、阳性、弱阳性及阴性的面积(单位:像素)、阳性的百分比,并自动计算H-score评分。其中H-Score=0~1为阴性及1~50分为弱阳性(低表达组);51~100分为阳性及101~300分为强阳性(高表达组),上限为300分。
1.4 随访 所有患者术后均进行定期随访,随访时间为患者接受手术的时间,随访截止时间为2015年7月1日。采用门诊随访及电话随访结合的方式,平均每3个月随访1次。对死亡患者其死亡时间即为终止时间。中途失访2例,其终止时间为最后1次随访时间,中途失访患者亦纳入生存分析。
1.5 统计学分析 数据采用SPSS20.0统计软件,SUZ12的表达于临床病理学数据的相关性用Chi-square检验或Fisher检验,组间差异分析用t检验,Kaplan-Meier生存分析用Log-rank检验;单因素及多因素生存分析用Cox回归分析检验。P<0.05为差异有统计学意义。
2 结果
2.1 SUZ12的表达情况 免疫组织化学检测发现在本研究中的SUZ12在肝癌组织和正常组织中的表达阳性率分别为89.24%和56.65%。其中肝癌组织中低表达30例(34.09%),高表达58例(65.91%);正常组织均为低表达。PBS染色均未发现特殊染色(图1)。
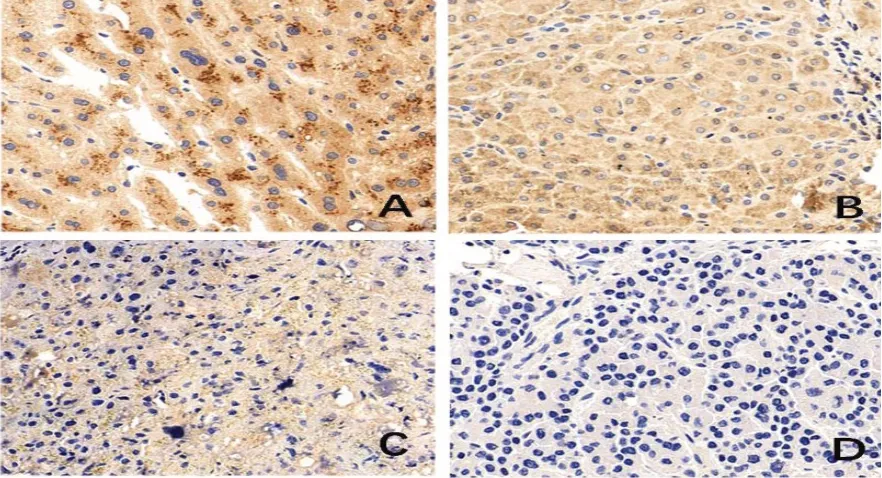
图1 SUZ12在肝癌组织中的表达情况(×400)
2.2 SUZ12的表达与肝癌临床病理因素的关系 Chi-square及Fisher检验发现SUZ12高表达与肝硬化存在负相关(P=0.043),且与HBsAg携带状态(P=0.089)存在正相关趋势,而与患者的性别(P=0.209)、年龄(P=0.541)、甲胎蛋白(P=0.134)、肿瘤大小(P=0.306)、肿瘤数目(P=0.832)、血管侵犯(P=0.759)、分化程度(P=0.728)、AJCC(P=0.557)差异无统计学意义(表1)。
2.3 生存分析
2.3.1 Kaplan-Meier生存分析 对88例肝癌患者术后的生存资料进行Kaplan-Meier生存分析显示:SUZ12低表达者的平均生存时间为75.70个月,中位生存时间为106.00个月;高表达者的平均生存时间为50.50个月,中位生存时间为26.00个月。随着SUZ12标的升高,患者的生存时间明显下降,差异具有统计学意义(χ2=5.212,P=0.022)(图2)。
2.3.2 Cox回归分析 对所有与临床病理指标进行单因素Cox回归分析,将其影响生存率的因素再进行多因素回归分析。统计结果显示:SUZ12高表达是肝癌患者生存的危险因素,SUZ12阳性表达可以作为肝癌患者的生存预测因子(P=0.009)。并且肿瘤>5 cm(P=0.020)、低分化(P=0.037)及AJCC分期(P<0.001)也是肝癌患者独立的不良生存预测因子(表2、3)。
3 讨 论
近年来,尽管索拉菲尼、仑伐替尼等抑制血管生成靶向药物以及PD-1、PD-L1、CTL-A4等免疫抑制剂的临床应用,使得肝癌的5年生存率有所提高,但疗效仍十分有限[6]。这主要是由于恶性肿瘤随着时间推移多数都会发生复发及转移,最终将患者推向终末阶段。SUZ12基因高度保守,广泛存在于从果蝇到包含人类的多种哺乳动物中,在维持染色质结构、调控细胞生命周期、引导干细胞分化、促进胚胎发育等方面有着决定性的作用[7]。目前已有研究发现,SUZ12基因的异常表达可直接或间接参与肿瘤的发生、发展。Hu 等[8]发现,乳腺癌患者若出现TRPS1缺失,则可增强SUZ12的表达活性并进一步促进肿瘤的复发转移。
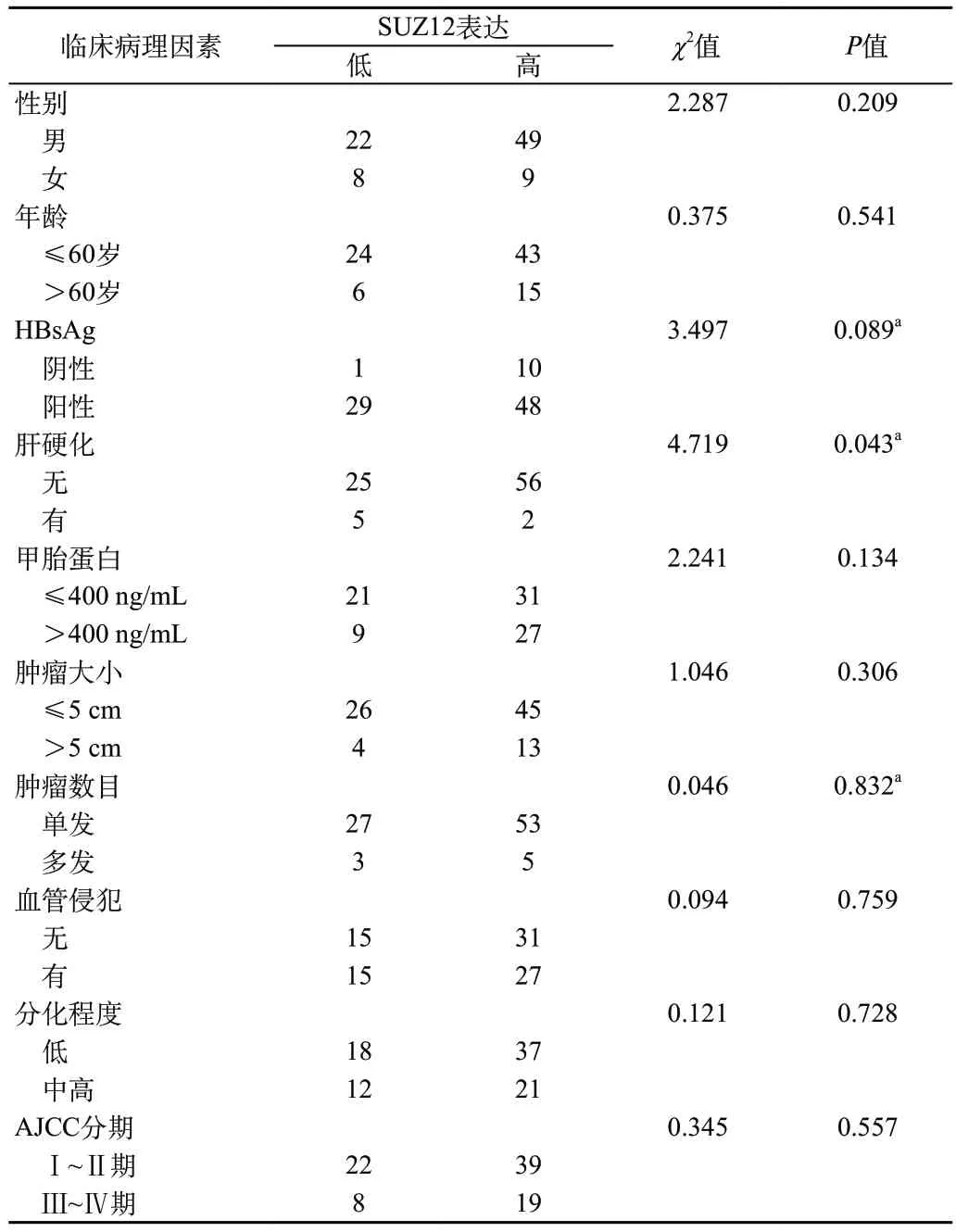
表1 肝癌组织中SUZ12的表达与临床病例特征的关系(例)
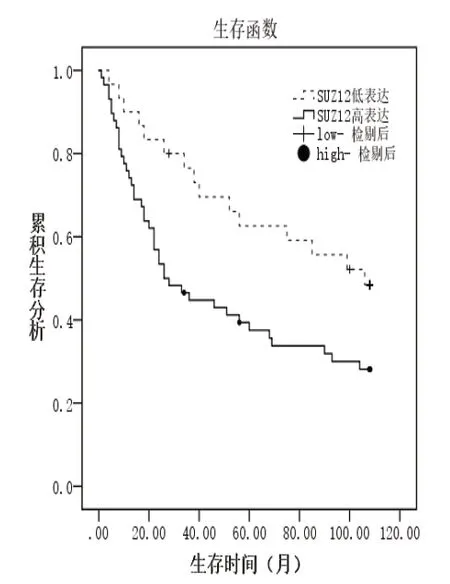
图2 SUZ12高表达组与低表达组Kaplan-Meier生存分析
SUZ12在肝癌中的相关研究大部分仍局限于动物模型或肝癌细胞株,且存在一定的争议。Kirmizis等[9]曾在早期发现,SUZ12在小鼠肝癌模型中的mRNA水平较对照组明显升高,并推测SUZ12是治疗恶性肿瘤的潜在靶点。Liu 等[10]进一步确认SUZ12蛋白在多种肝癌细胞癌株中不同程度的表达上调,并通过EZH2/PAK6信号通路协同促进肝癌的增殖、迁移和侵袭。上述关于SUZ12在肝细胞中的表达水平与本研究结果比较一致。本研究通过免疫组织化学检测发现,SUZ12在HCC患者中的表达水平显著高于正常肝组织。表明SUZ12的异常高表达可能参与了HCC的发生、发展。进一步的生存分析发现,SUZ12的表达升高可显著降低肝癌患者的预期生存时间,多因素分析提示SUZ12是肝癌患者独立的预测生存因子。2019年,Xue 等[11]的研究显示SUZ12在乙型肝炎相关性肝细胞中表现为高表达,该结果与本研究有所差异。推测SUZ12在肝癌的不同发展阶段可能有不同的表现。本研究结果提示,SUZ12的表达随着AJCC分期越晚,其表达水平越高。目前已知原发性肝癌是一种高度异质性恶性肿瘤,其体积大小、血管侵犯、细胞分化等都可能与SUZ12内在互相调控机制相关。本研究内容仍存在一定的局限性,关于SUZ12在HCC发生、发展中的作用机制仍需要进一步探讨,如SUZ12在肝癌远处转移中是否起潜在调控作用等问题仍需更多的临床资料及试验研究进一步验证。
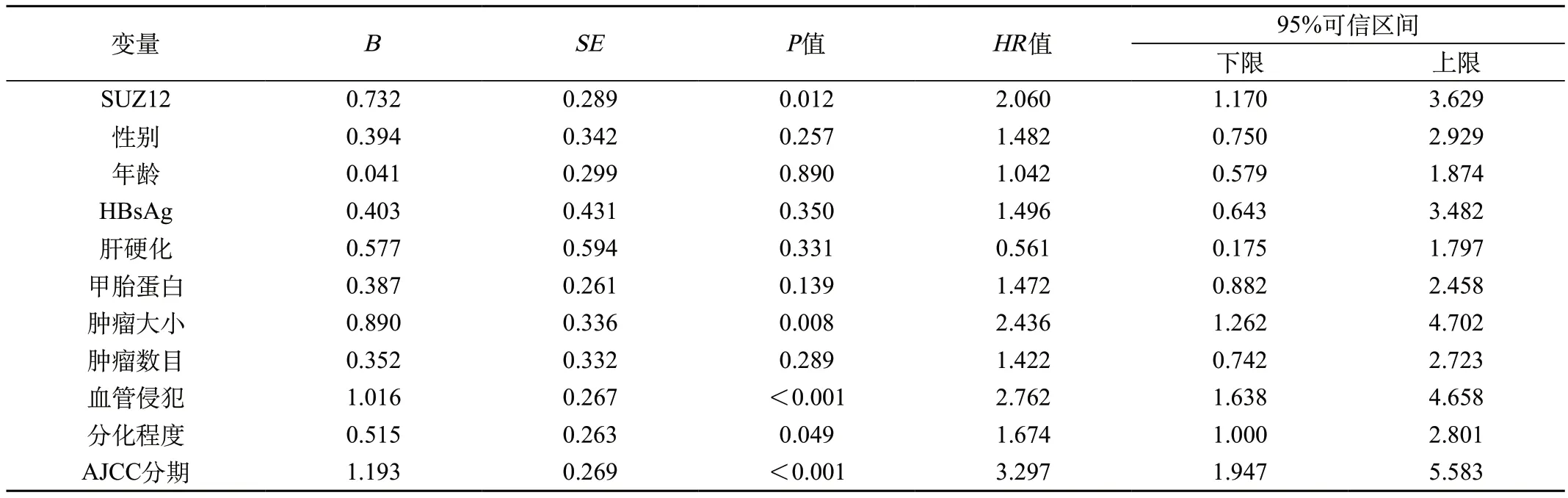
表2 Cox单因素模型参数估计
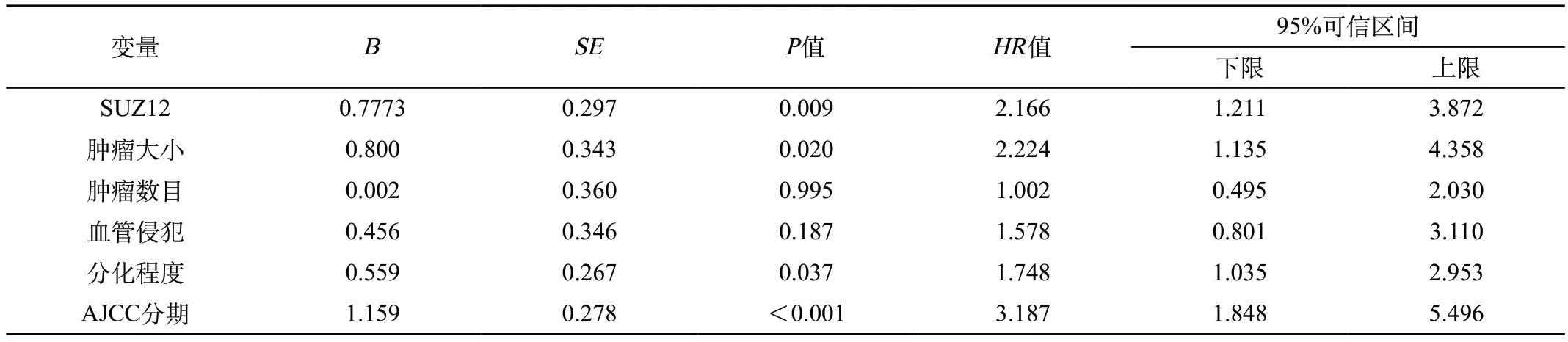
表3 Cox多因素模型参数估计
综上所述,SUZ12蛋白在HCC中具有较高的表达率,其可能参与了肝癌的发生、发展,并且SUZ12蛋白的表达水平可作为判断肝癌患者预后的潜在指标。
