马耳他布鲁氏菌sRNA Bmsr10 缺失株的构建及其对毒力的影响
2020-12-30姜利英赵键龙张慧桐宋甲宝步志高
姜利英,赵键龙,张慧桐,宋甲宝,步志高,胡 森
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
布鲁氏菌病(布病)是由布鲁氏菌引起的一种人兽共患传染病,主要引起动物和人流产及不孕不育[1]。该病呈世界范围分布,中东和亚洲地区流行较广,近些年我国人和动物布病均呈上升趋势[2]。布鲁氏菌为革兰阴性球杆菌,是α 变形杆菌门布鲁氏菌属成员,能够逃避机体免疫系统,有利于其定植在巨噬细胞,进而导致慢性感染[3]。布鲁氏菌主要分为6 个种,对人和家畜危害严重的主要为马耳他种布鲁氏菌、猪种布鲁氏菌和流产种布鲁氏菌,其中马耳他种的感染性和致病力最强。
Small RNA(sRNA)是一类大小为50 nt~300 nt 的小分子非编码RNA,广泛分布于原核和真核生物中,是生命活动中重要的调控因子,通过顺式和反式作用等方式参与基因转录后的调控。目前在大肠杆菌[4]、沙门氏菌[5]、耶尔森菌[6]等中相继发现了参与调控靶基因表达的sRNA,在细菌代谢、毒力决定、环境适应等方面发挥着重要的调控作用。但布鲁氏菌sRNA 的研究较少,本实验室前期研究中,以布鲁氏菌强毒株M28 为研究对象,通过转录组测序、筛选并验证了几个新sRNA,并证明了其中的Bmsr1能够降低布鲁氏菌的毒力[7],Bmsr10也是本团队发现的新sRNA之一。本研究利用同源重组方法构建布鲁氏菌Bmsr10的缺失株,通过对布鲁氏菌体内外增殖能力的检测,分析Bmsr10缺失对布鲁氏菌M28毒力的影响,为进一步研究sRNA对布鲁氏菌毒力作用机制及疫苗的开发提供新思路。
1 材料与方法
1.1 主要实验材料马耳他布鲁氏菌强毒株M28和马耳他布鲁氏菌疫苗株M5-90(由M28致弱)由哈尔滨兽医研究所菌种保藏中心保存并提供。巨噬细胞RAW264.7、pSP72质粒、pBBR1MCS4质粒和pIRES2-EGFP 质粒由本实验室保存。5 周龄~6 周龄SPF 雌性BALB/c小鼠购自北京维通利华实验动物技术有限公司。
1.2 sRNA Bmsr10 二级结构预测和Northern blot 检测采用RNAfold web server(http://rna.tbi.univie.ac.at/cgi-bin/RNAfold.cgi)对Bmsr10 的二级结构进行预测。参照文献[7],以利用RNA Extraction kit 提取的布鲁氏菌M28 总RNA 为模板,以前面加有T7 启动子序列(TAATACGACTCACTATAGGG)的RT-Bmsr10-f/RT-Bmsr10-r 为引物(表1),进行Northern blot,检测Bmsr10 是否表达。
1.3 重组质粒pSP-Bmsr10-K 和pBB-Bmsr10 的构建与鉴定利用CE Design 软件设计sRNA Bmsr10左、右同源臂和卡那霉素抗性基因引物(表1)。以RNA Extraction kit 提取的布鲁氏菌M28 基因组为模板,分别以L-f/L-r、R-f/R-r 为引物,扩增sRNA Bmsr10 的左右同源臂;以含有卡那霉素抗性基因质粒pIRES2-EGFP为模板,以K-f/K-r为引物,扩增卡那霉素抗性基因。sRNABmsr10左、右同源臂片段和卡那霉素抗性基因片段经纯化,利用ClonExpress MultiS One Step Cloning Kit 同时克隆至pSP72 质粒,转化DH5α 感受态细胞,接种卡那霉素平板(50 μg/mL),37 ℃培养16 h,挑取阳性单菌落,进行菌落PCR 鉴定,阳性质粒命名为pSP-Bmsr10-K。以M28 基因组为模板,Bmsr10-com-f/Bmsr10-com-r 为引物,扩增含Bmsr10 调控序列的片段,利用ClonExpress MultiS One Step Cloning Kit 将该片段克隆至pBBR1MCS4 质粒转化至DH5α 感受态细胞,接种氨苄青霉素平板(100 μg/mL)37 ℃培养16 h,挑取阳性单菌落,进行菌落PCR 鉴定,提取阳性质粒命名为pBB-Bm⁃sr10。以上质粒经中量制备并保存备用。

表1 引物和序列Table 1 Primers and sequence
1.4 缺失株M28ΔBmsr10 和回补株M28ΔBmsr10-com 的构建与鉴定参考文献[8]制备M28 感受态细胞,取10 μg 重组质粒pSP-Bmsr10-K 电转(300 V,900 μF,5 ms)入M28 感 受 态 细 胞,37 ℃振 荡(200 r/min)培养12 h 后,将菌液涂布于含卡那霉素(50 μg/mL)的TSA 平皿,37 ℃培养96 h。挑取单个阳性菌落,分别划线培养至含卡那霉素(50 μg/mL)和氨苄青霉素(100 μg/mL)的TSA平皿上。连续传代并纯化5 代后,挑取卡那霉素抗性而氨苄青霉素敏感的单个菌落,利用引物Bmsr10L-f/Bmsr10R-r、L-f/R-r、L-f/K-r和K-f/R-r对阳性菌落进行PCR鉴定,并将PCR产物测序鉴定,阳性菌命名为M28ΔBmsr10。按照同样方法,取10 μg 重组质粒pBB-Bmsr10 电转入(300 V,900 μF,5 ms)M28ΔBmsr10 感受态细胞中,经氨苄青霉素(100 μg/mL)筛选纯化,挑取阳性菌落,以Bm⁃sr10-com-f/Bmsr10-com-r为引物进行PCR 鉴定,阳性菌株命名为M28ΔBmsr10-com。
1.5 缺失株M28ΔBmsr10 生长曲线测定分别挑取新鲜培养的M28ΔBmsr10、M28 和M5-90 单菌落接种于5 mL TSB液体培养基(卡那霉素50 μg/mL),置于37 ℃,振荡培养(200 r/min)至对数生长期(约12 h),测定各菌液OD600nm值,并分别稀释至OD600nm=0.05。以1:100 比例转接于100 mL 的TSB 液体培养基,置于37 ℃,振荡培养(200 r/min)54 h(平台期),期间每6 h 取一次样,每个样品做3 个重复,测定其OD600nm,绘制M28、M28ΔBmsr10 和M5-90 在TSB 液体培养基中的生长曲线。
1.6 缺失株M28ΔBmsr10 巨噬细胞感染试验将RAW264.7 细胞接种于24 孔细胞培养板中,置于37 ℃,5% CO2培养至每孔约5×106个细胞。将M28ΔBmsr10、M28、M28ΔBmsr10-com 和M5-90 按MOI 100,分别感染9个孔的RAW264.7细胞(每个感染时间点做3 个重复),37 ℃5% CO2培养4 h,然后用PBS(pH 7.2)洗3次,加入300 μL DMEM培养基(含终浓度5 μg/mL 庆大霉素)继续培养。分别于感染后6 h、24 h和48 h各取3个孔的细胞,利用Triton X-100裂解,按1:10倍比稀释裂解液至10-4、10-5和10-6,将各稀释度分别取100 μL 涂布于TSA 平皿(做3 个重复),37 ℃培养96 h后进行菌落计数。
1.7 缺失株M28ΔBmsr10 小鼠感染试验将96只5周龄~6 周龄雌性BALB/c 小鼠随机分成4 组,每组24只,分别以1×106cfu/100 μL/只经腹腔接种M28ΔBm⁃sr10、M28 和M5-90,对照组腹腔接种100 μL PBS。接种后第1、3、5和7周迫杀小鼠,无菌分离脾脏,称重后将整个脾脏组织研磨(25 t/s,10 min),将组织悬液按1:10倍比稀释,取适当稀释度100 μL涂布于TSA固体培养基(每个稀释度做3 个重复),37 ℃培养96 h,菌落计数。
1.8 统计分析数据采用软件Graphpad(Version 6.04)进行统计与分析。采用t 检验确定统计学意义。p< 0.05(*)表示差异显著,p< 0.01(**)表示差异极显著,p<0.001(***)表示差异极其显著。
2 结 果
2.1 sRNA Bmsr10 二级结构模式图及Northern blot检测利用生物学软件RNAfold 测定sRNA Bmsr10 的二级结构,结果显示,Bmsr10 有3 个大环,并伸出多个小环,呈典型的颈环结构,符合sRNA 二级结构特征。利用Northern blot 检测Bmsr10 表达情况,结果显示:RNA 探针能够特异性的识别Bmsr10 的表达,其大小与181 nt 理论值一致(图1)。表明,sRNA Bmsr10 能够在布鲁氏菌M28 中正确表达。
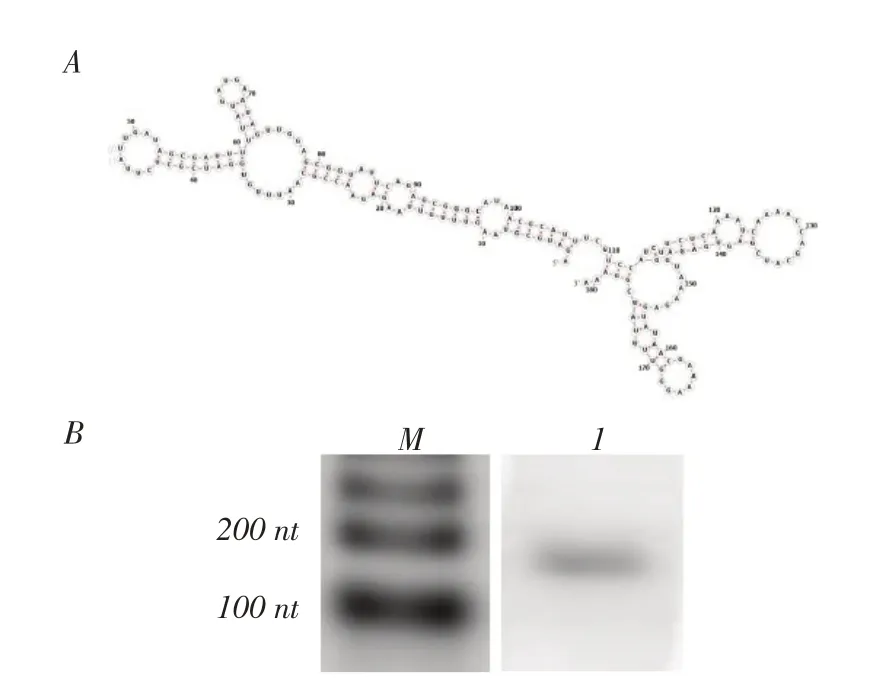
图1 sRNA Bmsr10 二级结构模式图和northern blot 分析Fig.1 sRNA secondary structure pattern and Northern blot analysis
2.2 重组质粒pSP-Bmsr10-K 和pBB-Bmsr10 的构建与鉴定以M28 基因组为模板PCR 扩增Bmsr10左、右同源臂,以pIRES2-EGFP为模板PCR扩增卡那霉素抗性基因。结果显示扩增的3 个基因片段大小分别约为500 bp、500 bp 和1 258 bp,均与预期相符(图2A)。将Bmsr10 左、右同源臂和卡那霉素抗性基因克隆至质粒pSP72,构建重组质粒pSP-Bmsr10-K,通过PCR 鉴定,结果显示,扩增产物为2 258 bp,产物与预期大小相符(图2B)。将扩增的sRNA Bm⁃sr10 序列克隆至pBBR1MCS-4,构建重组质粒pBBBmsr10,PCR 鉴定结果显示扩增片段为512 bp,与预期相符(NC_017245.1)(图2C)。PCR 产物经测序鉴定,测序序列均正确。表明重组质粒pSP-Bm⁃sr10-K 和pBB-Bmsr10 构建 正确。
高中物理知识很抽象,教师如果只是单纯地对理论知识进行讲解,学生理解起来就会有很大的困难.为了取得很好的课堂效果,教师会加入实验进行教学,同时教师还会考虑对实验进行创新,以更好地激发学生的学习热情,使学生能够融入到实验中来,这样不仅能够让学生有体验的机会,帮助学生领略知识的内涵,还能有效地培养学生的动手能力,提高课堂教学效率.
2.3 缺失株M28ΔBmsr10 和回补株M28ΔBmsr10-com 构建与鉴定经卡那霉素和氨苄青霉素连续筛选5 代,得到仅在卡那霉素抗性的平板上生长的阳性菌落,命名为M28ΔBmsr10, PCR 鉴定重组菌M28ΔBmsr10,结果显示,PCR 产物分别为2 366 bp、2 258 bp、1 758 bp 和1 758 bp,并将PCR 产物测序鉴定,结果均与预期相符(图3A)。同样对回补菌M28ΔBmsr10-com,以Bmsr10-com-f/Bmsr10-com-r为引物PCR 鉴定,结果显示,产物大小为512 bp,产物测序鉴定结果,与预期相符(图3B)。结果表明:缺失株M28ΔBmsr10 和回补株M28ΔBmsr10-com正确构建。
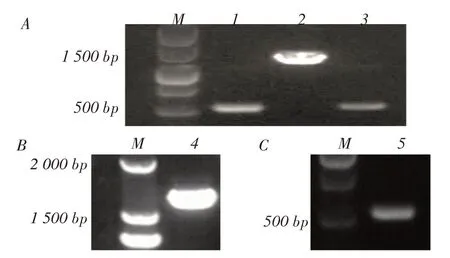
图2 pSP-Bmsr10-K 和pBBR1MCS4- sRNA Bmsr10 质粒的构建与鉴定Fig.2 Construction and identification of plasmid pSP-Bmsr10-K and pBB-Bmsr10

图3 缺失株M28ΔBmsr10(A)和回补株M28ΔBmsr10-com(B)的PCR 鉴定Fig.3 Identification of deletion strain M28ΔBmsr10 and complementation strain M28ΔBmsr10-com by PCR
2.4 缺失株M28ΔBmsr10 体外生长曲线测定每6 h 取3 mL 菌液测定OD600nm值,每个时间点作3 个重复,绘制生长曲线。结果显示,M28ΔBmsr10 和M28生长曲线趋势一致,均在54 h达到平台期,两者生长曲线无显著差异(p>0.05)。但M28 和M28ΔBmsr10 生长滴度均高于M5-90,差异均显著(p<0.01)(图4)。表明在TSB 液体培养基中sRNA Bmsr10 缺失不影响马耳他布鲁氏菌M28 体外的生长增殖。
2.5 缺失株M28ΔBmsr10 巨噬细胞感染试验将M28ΔBmsr10、M28、M5-90 和M28ΔBmsr10-com 分别感染RAW264.7 巨噬细胞后于各时间点进行细菌计数。结果显示:M28ΔBmsr10、M28、M5-90 和M28ΔBmsr10-com 均在感染48 h 时分菌数最多。感染6 h,M28ΔBmsr10 与M28 和M28ΔBmsr10-com 差异不显著(p>0.05)(图5)。感染24 h,M28ΔBmsr10 分菌数为7.09 log,显著低于M28 的7.26 log(p<0.05);感染48 h,M28ΔBmsr10 和M28 分菌数分别为8.39 log 和8.60 log。结果表明:sRNA Bmsr10 缺失降低了布鲁氏菌M28在巨噬细胞内的增殖能力。

图4 缺失株M28ΔBmsr10 体外生长曲线Fig.4 Growth curve of M28ΔBmsr10 strain in vitro
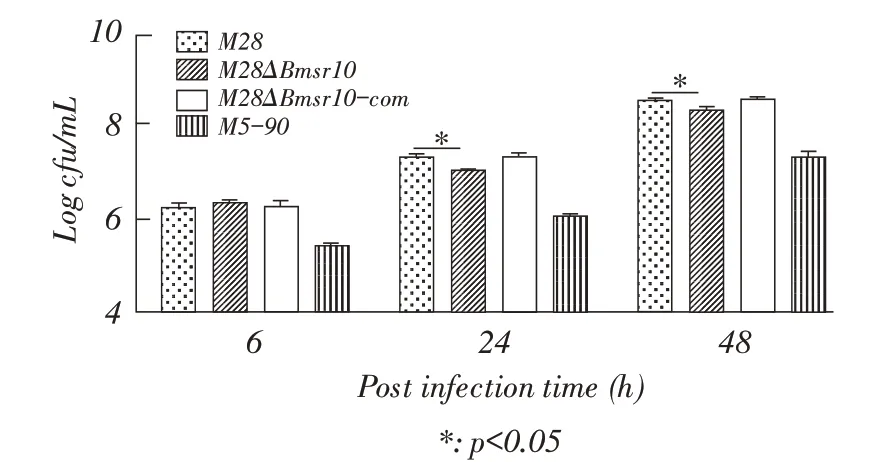
图5 缺失株M28ΔBmsr10 在RAW264.7 巨噬细胞中的增殖Fig.5 Propagation of M28ΔBmsr10 strain in RAW264.7macrophagocytes
2.6 缺失株M28ΔBmsr10 小鼠体内感染试验将M28ΔBmsr10、M28 和M5-90 分别腹腔感染小鼠,比较感染后不同时间脾脏分菌数及脾重情况。结果显示:M28ΔBmsr10、M28 和M5-90 在感染1 周时脾脏分菌数均达到峰值(图6A),随后逐渐下降。M28ΔBmsr10与M28相比,感染后1周、3周、5周和7周小鼠脾脏分菌数(p<0.01)和脾脏重量(p<0.01)均显著降低。尤其是感染5 周时,M28ΔBmsr10 与M28 的小鼠脾脏分菌数差异最大,M28ΔBmsr10 为4.27 log显著低于M28 5.44 log(p<0.001)(图6A)。感染后3周时,M28ΔBmsr10 小鼠脾脏重量为0.41g,显著低于M28 0.58 g(p<0.01)(图6B)。结果表明:sRNA Bmsr10 缺失显著降低了M28 在小鼠体内的增殖能力和炎症反应。
3 讨 论
布鲁氏菌是革兰氏阴性、无典型毒力因子的胞内菌,其中马耳他布鲁氏菌对人和动物的致病力最强,是导致目前我国布病流行的主要菌种。因此,本研究以马耳他种布鲁氏菌M28 株(强毒株)为研究对象,探究sRNA Bmsr10 缺失对其在毒力方面的影响。

图6 M28ΔBmsr10 感染小鼠脾脏分菌数(A)和脾脏重量(B)Fig.6 Spleen counts(A)and spleen weights(B)of BALB/c mice after M28ΔBmsr10 infection
sRNAs 作为重要的转录后调控分子,广泛参与细胞对环境变化的适应,如温度变化、营养胁迫、渗透休克和代谢失衡等[9-10]。有文献报道布鲁氏菌抵抗和适应巨噬细胞内杀菌或抑菌的能力,也是通过调控基因的协调表达来实现[11]。本研究在前期实验基础上进一步利用在线生物软件(RNAfold web serv⁃er http://rna.tbi.univie.ac.at/cgi-bin/RNAfold.cgi)发现其具有典型的茎环结构(图1A),符合sRNA 二级结构特征◦sRNA 的表达需要Northern blot 来验证,因此本研究进一步利用Bmsr10 探针与M28 的总RNA 杂交,胶片显影结果证明其能够表达(图1B),大小也与理论值一致。另外,Blast N 分析结果也显示,Bmsr10 在马耳他布鲁氏菌和流产布鲁氏菌中是保守的(结果略)。
利用质粒pSP72[8]和pBBR1MCS4[7]作为自杀和回补质粒的布鲁氏菌基因缺失-回补系统是本实验室通过长时间摸索并建立,多个研究证明该系统具有较高效率,能够满足实验要求[7-8,12-13]。
已有研究发现OmpR 基因缺失会导致M28 在固体培养基(TSA)上生长受到抑制[13],本研究结果显示在液体培养基(TSB)上观察Bmsr10 缺失对M28 生长曲线无变化,表明缺失Bmsr10 并未影响M28 菌落的生长速度◦
研究表明sRNA Bmsr1 的缺失会降低布鲁氏菌M28 在巨噬细胞内的复制能力[7],本研究结果显示,M28ΔBmsr10 感染巨噬细胞后分离的细菌数显著低于M28。表明缺失Bmsr10 显著降低了布鲁氏菌在巨噬细胞内的增殖能力。
为了进一步检测Bmsr10 对体内布鲁氏菌的生长增殖/毒力是否有影响,本研究选择小鼠作为动物感染模型。与巨噬细胞相比,体内环境更接近于细菌的真实生存条件,更能有效地反映Bmsr10 对布鲁氏菌M28 的毒力是否有影响。结果显示,感染后无论脾脏分菌数还是脾脏重量,Bmsr10 缺失株均显著低于M28 株(图6)。但Bmsr10 是如何调控其靶基因来降低毒力具体机制仍需进一步验证。
本研究多处以M5-90 作为对照(M5-90 是由强毒株M28 驯化致弱,是我国防治牛、羊布病的疫苗株之一),目的是将其与M28ΔBmsr10 进行比较,观察M28ΔBmsr10 毒力下降是否能够达到疫苗株下降的程度。结果显示,M28ΔBmsr10 与亲本株相比虽有显著下降,但未达到疫苗株的程度。目前对sRNA 缺失标记疫苗研究不多,有文献报道删除多个sRNA 构建的鼠伤寒沙门氏菌弱毒疫苗具有良好的保护性[14]。因此,在M28ΔBmsr10 基础上进行多缺失是否可以获得更低毒力的疫苗株值得进一步研究。
综上,Bmsr10 的缺失会降低布鲁氏菌M28 毒力,该研究为进一步探究布鲁氏菌的毒力作用机制及构建候选疫苗提供了新的思路。
