猪OLR1基因对肌内前脂肪细胞分化的影响
2020-12-29黄藏宇吴俊静武华玉万绪玲周佳伟刘贵生梅书棋彭先文
乔 木,黄藏宇,吴俊静,武华玉,万绪玲,周佳伟,刘贵生,梅书棋,彭先文,*
(1.湖北省农业科学院 畜牧兽医研究所,动物胚胎工程及分子育种湖北省重点实验室,湖北 武汉430064; 2.武汉市江夏区动物卫生监督所,湖北 武汉 430200)
脂肪沉积在猪生产中具有重要意义,影响着猪肉的品质和生长效率[1]。肌内脂肪含量与肉的风味、嫩度和多汁性相关,能够影响肉质和胴体组成[2]。脂肪沉积主要依赖于脂肪前体细胞的增殖、分化和聚酯成熟,这是一个多基因和转录因子相互调控的复杂过程[3]。因此,鉴定脂肪细胞分化的相关基因并研究其对脂肪细胞分化的作用,对于阐明猪脂肪沉积的分子机制和肉质改良具有重要的意义。
氧化型低密度脂蛋白受体1(oxidized low-density lipoprotein receptor1, OLR1)是一类可以结合氧化低密度脂蛋白(oxLDL)的受体。Sawamura等[4]首次在牛内皮细胞上发现了OLR1基因,随后有学者在大鼠和小鼠等物种相继获得了OLR1基因[5-6]。有研究表明,OLR1基因在脂肪代谢过程中发挥着重要的作用。Chui等[7]首次在脂肪细胞中证明OLR1参与脂代谢;Ajuwon等[8]和孙超等[9]研究表明,OLR1基因在脂肪细胞分化和增殖过程中有一定作用;此外,OLR1基因与牛的乳脂率、牛肉品质、脂肪沉积等性状相关[10-13]。本课题组前期研究发现,OLR1基因在猪背部脂肪组织表达量比较高,并且关联分析表明其与猪的脂肪沉积性状相关[14];但是对于其在脂肪沉积中的作用机制尚不清楚。本研究构建OLR1基因过表达载体和OLR1-siRNA,转染猪肌内前脂肪细胞,初步验证OLR1基因对肌内脂肪细胞成脂分化的作用,为深入研究OLR1基因在调控肌内脂肪沉积中的功能和改善猪肉品质奠定理论基础。
1 材料与方法
1.1 猪肌内前体脂肪细胞的分离
选取养殖于湖北省农业科学院畜牧兽医研究所恩施来凤县种猪场的3日龄恩施黑猪,放血处死,用75%乙醇擦拭全身,无菌条件下分离背最长肌肌肉组织,去除肉眼可见的结缔组织,剪成1~2 mm3的组织块,用0.2% Ⅱ型胶原酶(GIBCO)消化液37 ℃细胞培养箱消化2 h;消化产物经网筛过滤、离心、弃上清、漂洗、红细胞裂解、DMEM漂洗(重复从过滤到漂洗这个流程1次),用含5%小牛血清的DMEM/F12(GIBCO)完全培养液重悬,接种于T25细胞培养瓶中,置于37 ℃、5% CO2培养箱培养,具体方法参照张罕星等[15]的方法。
1.2 猪OLR1过表达载体的构建
根据GenBank中猪OLR1基因序列(登录号:NM_213805)和pcDNA3.1载体上的酶切位点,设计上下游分别带有HindⅢ和XhoⅠ限制性内切酶位点的引物,同时在5’端加入Kozak序列GCCACC(F1:CCAAGCTTGCCACCATGACACTTGATGACCTCA;R1:CCCTCGAGTCACTGTGCTCTCAAGAG)。以恩施黑猪脂肪组织的cDNA为模板,进行PCR扩增,退火温度见表1。
对PCR产物进行琼脂糖凝胶电泳,回收产物与载体pcDNA3.1同时进行双酶切,酶切体系为:回收产物3 μg或者pcDNA3.1质粒1 μg,10×Buffer 2 μL,HindⅢ和XhoⅠ各1 μL,加ddH2O至20 μL,37 ℃ 酶切4~6 h。酶切产物纯化后用Takara公司T4连接酶进行连接,连接产物转化至大肠埃希菌感受态细胞DH5α,筛选阳性克隆进行测序;测序正确的菌体进行扩大培养,用去内毒素试剂盒进行质粒抽提,获得重组质粒OLR1-pcDNA3.1,并进行双酶切鉴定。具体操作过程参照Qiao等[16]的方法。
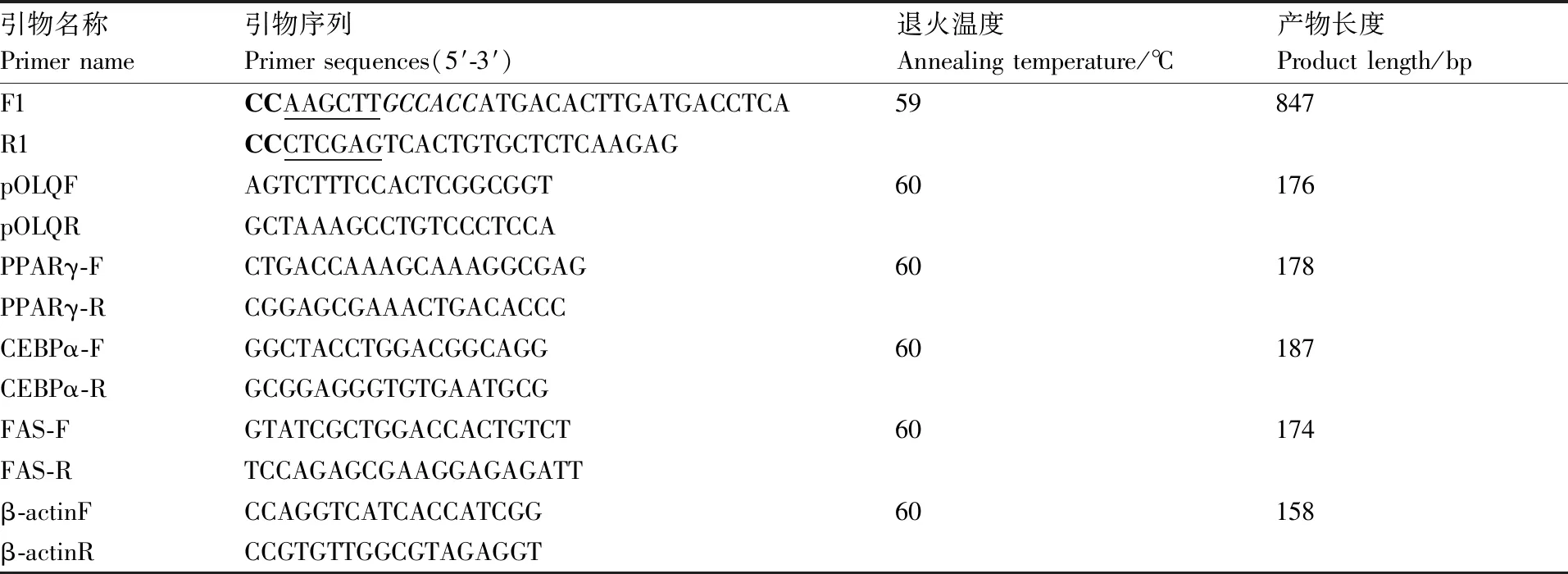
表1 PCR引物信息
1.3 OLR1-siRNA设计与细胞转染
由上海吉玛公司设计并合成猪OLR1基因的siRNA序列和对照NC,siRNA序列见表2。
1.4 细胞转染和诱导分化
将猪肌内前脂肪细胞接种于6孔板,当细胞达到70%~80%融合时进行转染。按照脂质体Lipofectamine 3000(Invitrogen)使用说明进行操作。将质粒OLR1-pcDNA3.1转染猪肌内前脂肪细胞,以转染质粒pcDNA3.1的细胞作为阴性对照,将3.75 μL脂质体Lipofectamine 3000(Invitrogen)和2.5 μg质粒OLR1-pcDNA3.1或者pcDNA3.1,分别用125 μL Opti-MEM稀释,室温静置5 min,充分混合转入细胞。siRNA的转染方法为:当猪肌内前脂肪细胞生长至70%~80%融合时进行转染。按照转染试剂Lipofectamine 3000(Invitrogen)的说明书进行操作,每个孔转染siRNA(20 μmol·L-1)和对照NC(20 μmol·L-1)各5 μL。设3个重复。选择干扰效果最好的siRNA进行转染。转染的细胞贴壁后,换成诱导分化培养基[0.85 μmol·L-1胰岛素,1 μmol·L-1地塞米松,0.5 mmol·L-1IBMX(1-甲基-3-异丁基黄嘌呤)],2 d 后,换为维持培养基(0.85 μmol·L-1胰岛素,1 μmol·L-1地塞米松)促使其继续分化,此后每2 d更换一次维持培养基。具体操作方法可参照胡濒月等[17]的方法。上述所用诱导试剂均购自Sigma公司。

表2 猪OLR1基因siRNA序列
1.5 脂肪沉积相关基因的表达量检测
收集诱导分化至第6天的细胞,用Trizol法提取总RNA,按照Takara公司试剂盒PrimeScriptTMRT说明进行反转录,具体方法参照Qiao等[16]。根据NCBI数据中猪的OLR1、PPARγ、C/EBPα和FAS基因mRNA序列,利用Primer Premier 5.0设计实时荧光定量PCR引物,由北京奥科生物技术有限责任公司合成,引物序列见表1。反应在LightCycler ®480 II(Roche公司)实时荧光定量PCR仪上进行,反应体系为20 μL:cDNA模板1 μL,正、反向引物各0.5 μL,FastStart Universal SYBR Green Master 10 μL(Roche公司),ddH2O补至终体积20 μL。以猪β-actin作为内参基因(引物β-actinF/β-actinR)。基因的相对表达量用2-ΔΔCt计算,每个样品设3个重复。反应程序参照孙瑞萍等[18],退火温度见表1。数据用SPSS18.0软件进行分析。
1.6 油红O染色和甘油三酯含量测定
将上述4种不同处理的细胞诱导分化至第6天,用PBS洗3次;加入4%多聚甲醛固定30 min,去掉固定液,PBS清洗3次;加入预先配制好的油红O染色液(配制方法参照文献[19]),37 ℃染色15 min,去除染料,PBS洗2次,显微镜下观察、拍照。采用甘油三酯测定试剂盒(E1025,北京普利莱技术有限公司)测定细胞内甘油三酯含量,按照说明书进行操作,用酶标仪(Promega,美国)测定在波长550 nm处的吸光度。
2 结果与分析
2.1 猪OLR1过表达载体的鉴定
以猪脂肪组织cDNA为模板,用引物F1/R1进行PCR扩增,获得序列长度为847 bp的产物(图1)。测序结果表明,PCR产物包括OLR1基因完整的编码区(CDS)序列825 bp。利用Blast软件与NCBI中猪OLR1基因(登录号:NM_213805)序列进行比对,相似性达到99.2%,说明成功克隆出猪OLR1基因。
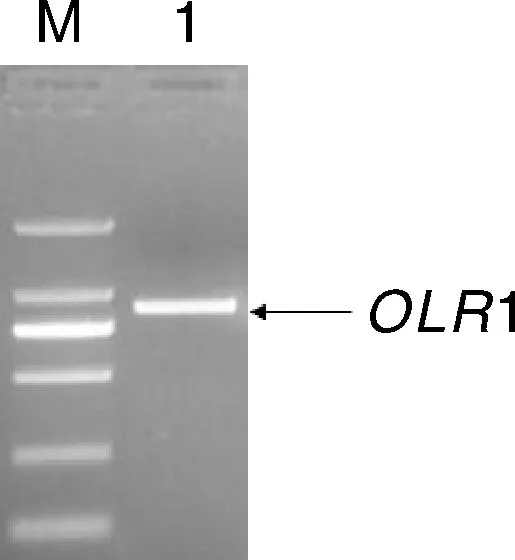
M, DL 2 000 marker; 1, PCR扩增片段。M, DL 2 000 marker; 1, PCR amplification fragment.图1 OLR1基因扩增产物电泳结果Fig.1 Electrophoretic results of amplified products of OLR1 gene
将上述带有双酶切位点的OLR1基因CDS序列进行回收、纯化、双酶切,连入pcDNA3.1载体,转入DH5α感受态细胞,挑取阳性克隆送北京奥科鼎盛生物科技有限公司进行测序。同时,进行双酶切鉴定,酶切体系:HindⅢ和XhoⅠ各1 μL,10×buffer 1 μL,OLR1-pcDNA3.1质粒5 μL,加H2O至总体积10 μL。37 ℃酶切过夜,琼脂糖凝胶电泳检测,酶切结果见图2。双酶切之后获得5 428 bp和847 bp 2个条带,分别为pcDNA3.1载体和OLR1基因CDS序列,证明重组质粒OLR1-pcDNA3.1构建成功。
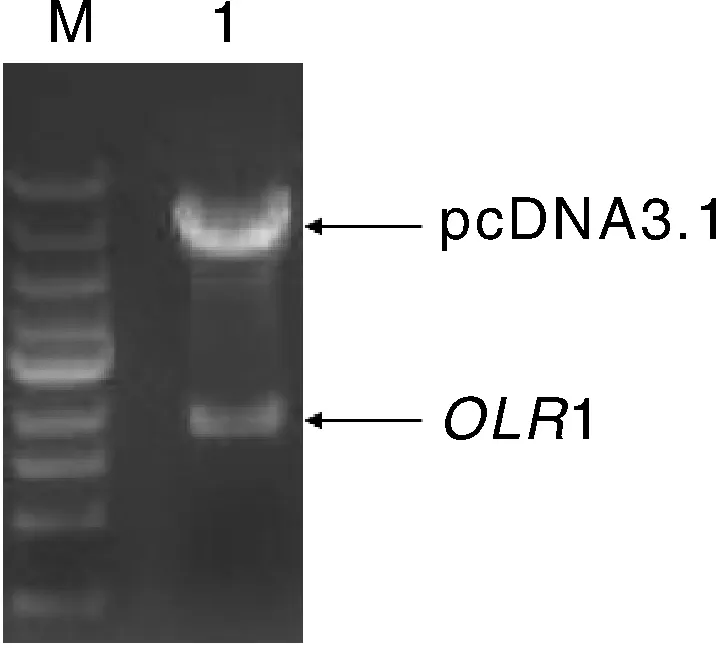
M,DL 10 000 marker;1,双酶切片段。M, DL 10 000 marker; 1, Double digestion fragment.图2 OLR1基因过表达载体Hind Ⅲ和XhoΙ酶切鉴定结果Fig.2 Digestion result of OLR1 overexpression vector by enzyme Hind Ⅲ and XhoⅠ
2.2 OLR1-siRNA筛选
收集转染OLR1-siRNA和对照NC 24 h后的细胞,用Trizol法提取总RNA。按照Takara公司试剂盒PrimeScriptTMRT说明进行反转录,用引物pOLQF和pOLQR(表1)检测各处理中OLR1基因的表达量。结果显示,siRNA1的干扰效果最好,其OLR1基因表达量下降了86%(P<0.01)(图3)。因此,选择siRNA1用于后续试验。
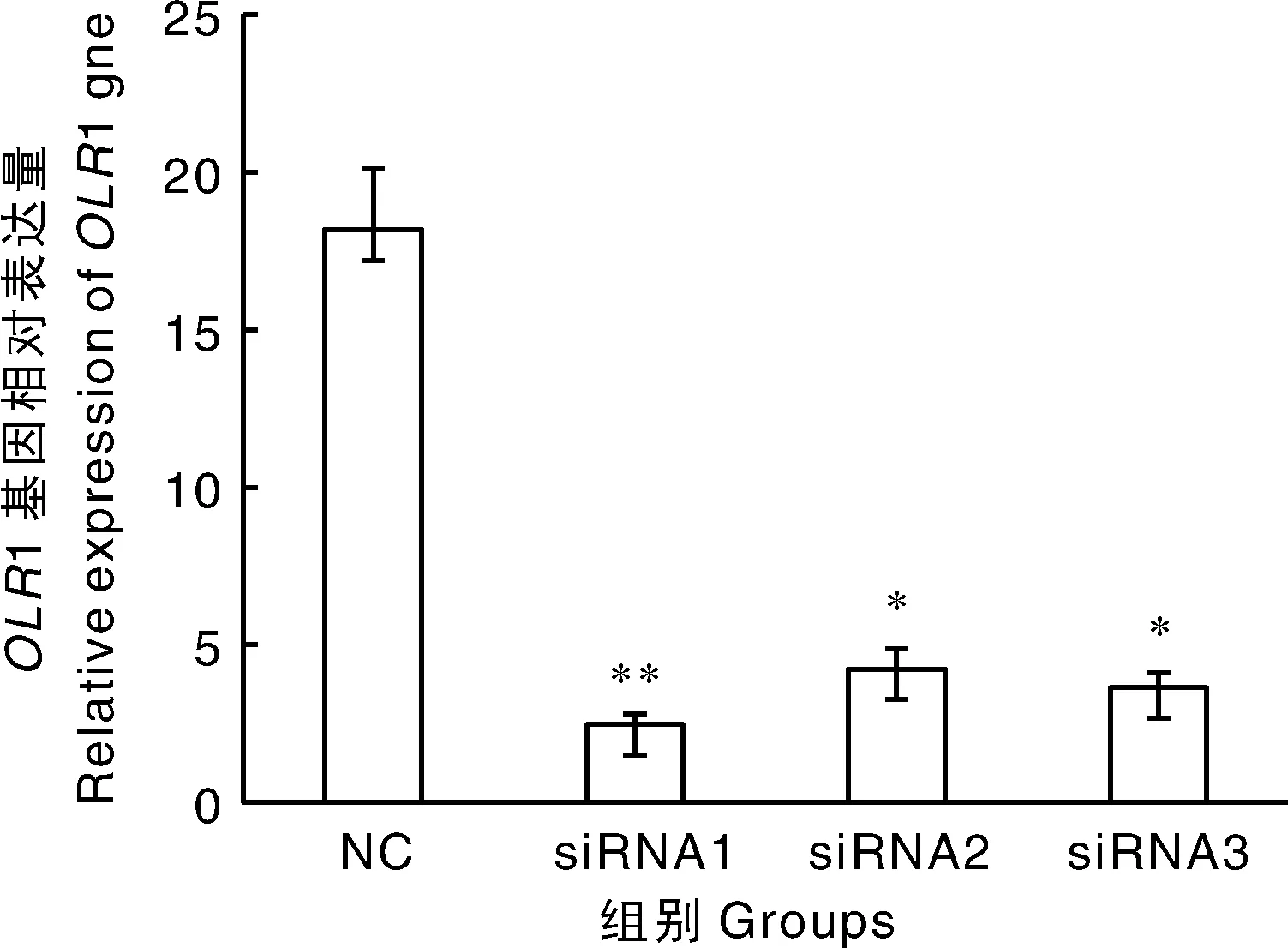
*、**分别表示与对照组相比在P<0.05 和P<0.01 水平差异显著。下同。* and ** meant significant differences at the levels of P<0.05 and P<0.01 compared with the control group, respectively. The same as below.图3 转染siRNA后OLR1基因的相对表达量Fig.3 Relative expression of OLR1 gene after transfection with siRNAs
2.3 OLR1过表达或抑制表达对脂肪沉积相关基因的影响
荧光定量PCR检测结果表明:过表达组(OLR1-pcDNA3.1)中OLR1、PPARγ、C/EBPα和FAS基因的mRNA表达量显著(P<0.05)或者极显著(P<0.01)高于对照组(pcDNA3.1)(图4-A)。干扰组(OLR1-siRNA)与对照组(NC)相比,OLR1、PPARγ、C/EBPα和FAS基因的mRNA表达量显著(P<0.05)或者极显著(P<0.01)下降(图4-B)。
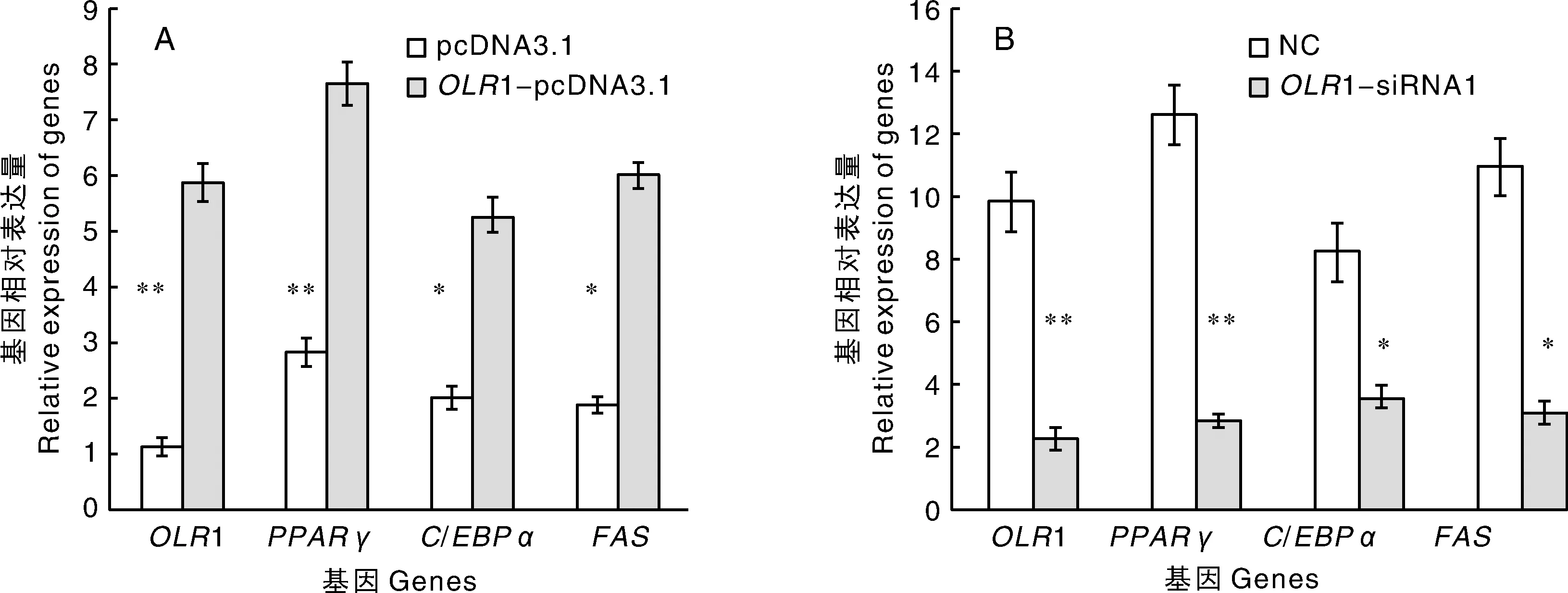
图4 转染OLR1-pcDNA3.1或OLR1-siRNA后PPARγ,C/EBPα和FAS基因的相对表达量Fig.4 Relative expression of PPARγ, C/EBPα and FAS genes after transfection with OLR1-pcDNA3.1 or OLR1-siRNA
2.4 油红O染色和甘油三酯含量
为进一步从表型上阐明OLR1基因对脂肪细胞分化的影响,将上述4种不同处理的细胞诱导分化至第6 d,进行油红O染色和甘油三酯含量测定。结果显示,OLR1干扰组(OLR1-siRNA)脂滴的数量和甘油三酯含量均显著(P<0.05)低于对照组(NC)(图5-A);相反,OLR1过表达组(OLR1-pcDNA3.1)脂滴的数量和甘油三酯含量均显著(P<0.05)高于对照组(pcDNA3.1)(图5-B)。说明OLR1基因有促进脂滴和甘油三酯形成的作用。
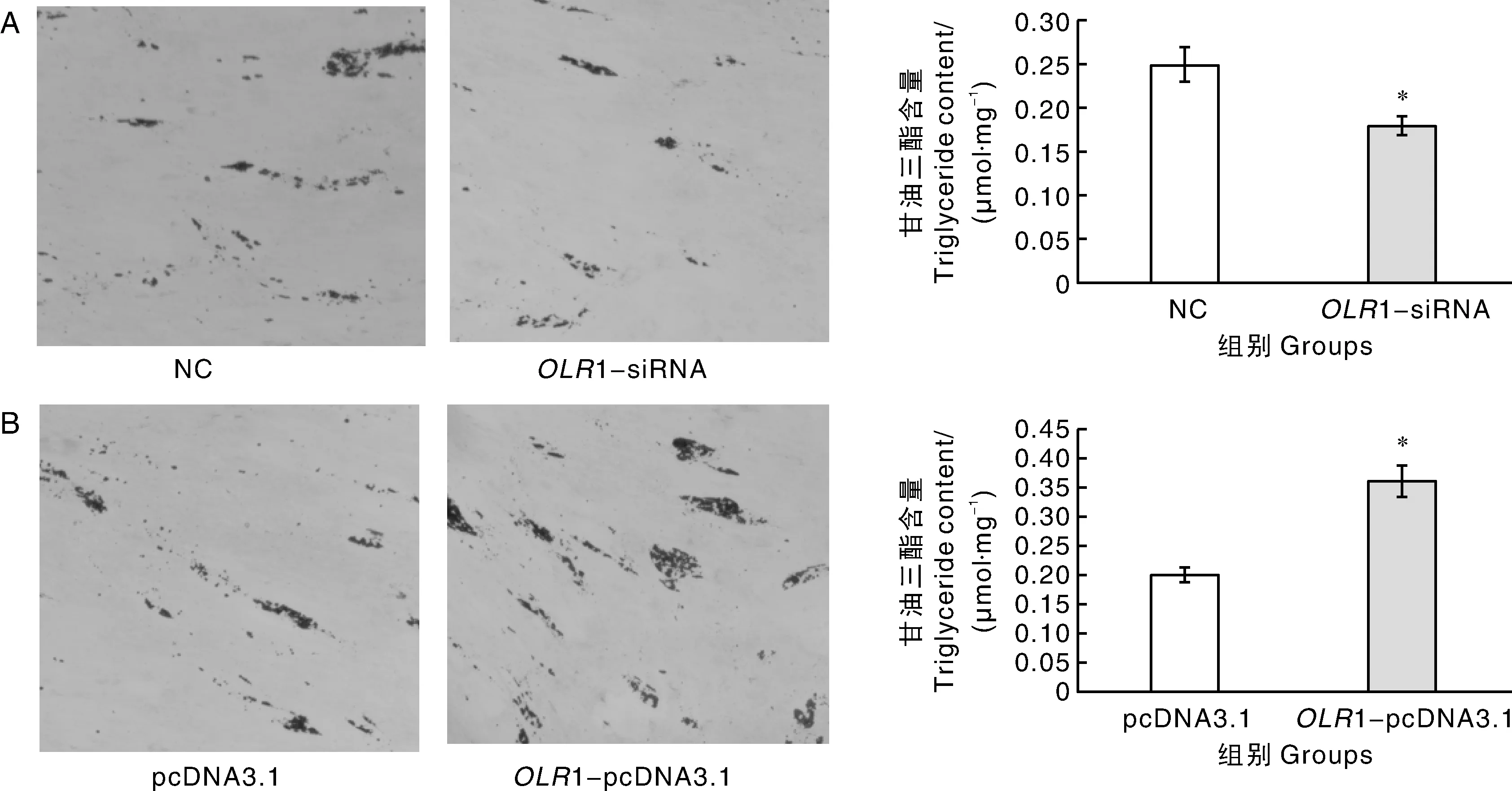
红色表示脂滴的沉积,*表示差异显著(P<0.05)。Red indicated the deposition of lipid droplets, * indicated significant difference at P<0.05.图5 油红O染色和甘油三酯含量测定Fig.5 Oil red O staining and determination of triglyceride content
3 结论与讨论
肌内脂肪含量是影响猪肉品质的重要因素之一,它影响着猪肉的嫩度、风味和多汁性[2,20],探究肌内脂肪沉积规律和调控机制对改善肉质性状具有积极意义。肌内脂肪的沉积受遗传、环境和营养等多种因素影响,而基因水平的调控起着重要的作用[20]。因此,分离鉴定影响脂肪沉积的基因,可以为猪脂肪沉积性状的改良奠定基础。
研究表明,OLR1基因参与人类心脑血管和脂蛋白代谢等相关疾病,但是其在家畜中的研究较少。近年来有研究发现,OLR1基因与猪的脂肪沉积、牛的肉质和乳脂率等性状存在一定的相关性,可以作为影响家畜重要经济性状的候选基因[13]。Sun等[21]对猪OLR1基因的生物信息学分析表明,其具有CLECT_NK_receptors_like保守结构域,位于第144~256位,该结构域在不同物种中高度保守,可能与脂肪的代谢调控有关。本课题组前期对OLR1基因在不同猪种中的组织表达谱进行了研究,发现其在脂肪组织中表达量较高,并且在梅山猪(肥胖型)中的表达量高于大白猪(瘦肉型),推测该基因与脂肪沉积有一定的关系[9],但其具体作用机制尚不明确。
动物的脂肪沉积主要是脂肪细胞数量增加、体积增大和脂滴聚集的过程[22]。目前,对动物脂肪细胞分化和调控机制的研究多采用的细胞模型为前脂肪细胞,前脂肪细胞是一类具有增殖和脂肪细胞定向分化能力的特异化前体细胞[23]。猪体内不同部位的脂肪沉积对肉质的影响不同,肌内脂肪是影响肉质、嫩度、风味的重要因素[2,20]。本研究主要是为了阐明OLR1基因在肌内脂肪沉积中的作用,因此以肌内前体脂肪细胞作为模型进行研究。
本研究成功构建了OLR1基因过表达载体,并且筛选了OLR1基因干扰siRNA。结果表明,OLR1基因过表达极显著(P<0.01)促进了PPARγ基因的表达,显著(P<0.05)促进了C/EBPα和FAS基因的表达;OLR1基因表达量降低会极显著(P<0.01)抑制PPARγ基因的表达,显著(P<0.05)抑制C/EBPα和FAS基因的表达。PPARγ和C/EBPα基因是脂肪分化的标志性基因,在脂肪分化过程中起着重要作用[24]。FAS即脂肪酸合成酶,其表达量升高能显著增加甘油三酯的沉积,对动物体脂的沉积有重要影响[25]。此外,油红O染色和甘油三酯含量测定发现,过表达OLR1促进了脂滴的形成和甘油三酯含量的增加,反之,抑制了脂滴的形成,降低了甘油三酯含量。综上所述,OLR1基因具有促进肌内前脂肪细胞成脂分化的作用,为深入研究OLR1基因对脂肪沉积的功能奠定了基础,为猪肉质性状的遗传改良提供了新的候选基因。
