超高效液相色谱-荧光检测法测定禽肉组织中乙氧酰胺苯甲酯残留量
2020-12-28吴蓉朱晓军周玮李洁莉傅嘉星
吴蓉 朱晓军 周玮 李洁莉 傅嘉星
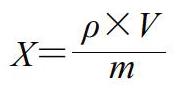
摘 要:建立超高效液相色谱-荧光检测法测定禽肉组织中乙氧酰胺苯甲酯(ethopabate,ETP)残留量的分析方法。样品用乙腈提取,采用C18色谱柱(2.1 mm×100 mm,1.8 μm),乙腈-水(30∶70,V/V)为流动相,流速0.3 mL/min,柱温30 ℃,进样量5.0 μL,采用荧光检测器,在激发波长272 nm、发射波长394 nm条件下测定。结果表明:ETP在5~500 ng/mL质量浓度范围内呈良好的线性关系(R2=0.999 7);檢出限为2 μg/kg,定量限为5 μg/kg;平均回收率为83.0%~91.5%,相对标准偏差为1.6%~2.9%。本方法适用于检测禽肉组织中ETP残留量。
关键词:超高效液相色谱法;禽肉组织;乙氧酰胺苯甲酯;荧光检测器
Abstract: An analytical method for the determination of ethopabate residues in poultry muscle tissues was established using ultra-high performance liquid chromatography-fluorescence detection (UPLC-FLD). Samples were extracted with acetonitrile and separated on a C18 column (2.1 mm × 100 mm, 1.8 μm) using a mobile phase consisting of acetonitrile and water (30:70, V/V) at a flow rate of 0.3 mL/min. The column temperature and injection volume were set as 30 ℃ and 5.0 μL, respectively. The eluate was detected using a fluorescence detector at an excitation wavelength of 272 nm and an emission wavelength of 394 nm. The results showed that good linearity was observed in the concentration range of 5–500 ng/mL (R2 = 0.999 7). The limit of detection was 2 μg/kg, and the limit of quantitation was 5 μg/kg. The average recoveries of spiked samples were 83.0%–91.5% with relative standard deviation (RSD) of 1.6% to 2.9%. The method proved to be applicable for the determination of ethopabate residues in poultry muscle tissues.
Keywords: ultra-high performance liquid chromatography; poultry muscle tissue; ethopabate; fluorescence detector
DOI:10.7506/rlyj1001-8123-20200811-196
中图分类号:O657.7 文献标志码:A 文章编号:1001-8123(2020)10-0053-05
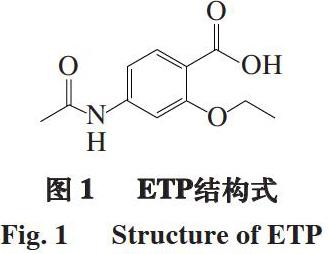
乙氧酰胺苯甲酯(ethopabate,ETP),又名4-乙酰胺基-2-乙氧基苯甲酸甲酯(结构式见图1),分子式为C12H15O4N,是一种广谱抗球虫增效剂[1-2],常被添加在家禽饲料中,与其他抗球虫药物配伍使用,可以降低抗药性,提高药效[3-5],因此,被广泛用于预防和治疗球虫病[6]。
ETP在养殖行业长期大量使用后易在动物肌肉、肝、肾和蛋中残留[7-8],对消费者健康构成潜在威胁[9-10],我国现行标准GB 31650—2019《食品安全国家标准 食品中兽药最大残留限量》[11]规定,ETP在鸡肉中最大残留限量(maximum residue limit,MRL)为500 μg/kg,在鸡肝和鸡肾中MRL为1 500 μg/kg,但并未规定ETP在其他禽肉组织中的MRL。因此,探讨并建立禽肉组织中ETP残留量的检测方法有利于加强养殖行业的监管机制。
目前,我国现实施标准GB 31660.9—2019《食品安全国家标准 家禽可食性组织中乙氧酰胺苯甲酯残留量的测定 高效液相色谱法》[12]规定了家禽可食性组织中ETP残留量的检测方法,但该方法前处理繁琐,耗时费力,不适合样品高通量分析。国内外文献报道检测禽肉组织中ETP残留量的方法主要有高效液相色谱-紫外检测法[13-15]、液相色谱-质谱法[16-21]和荧光分光光度法[22-23]等。高效液相色谱-紫外检测法重现性好、准确度高,但前处理需要使用固相萃取柱净化[24-25],成本较高,灵敏度较低,且仪器分析时间较长;液相色谱-质谱法因其灵敏度高、选择性强被广泛应用于兽药残留分析[26-28],但该法前处理繁琐、耗时且仪器成本较高,更适用于多残留测定;荧光分光光度法灵敏度高,但选择性较差。
本研究以已报道文献[18,24-25]为基础,优化前处理条件,采用乙腈进行提取,利用荧光检测器的强选择性和高灵敏度特点,对鸡、鸭、鹅肌肉组织中ETP残留量进行分析,建立禽肉组织中ETP残留量测定的超高效液相色谱-荧光检测法,国内外鲜见相关报道,为禽肉组织中ETP残留量的准确测定和安全控制提供参考。
1 材料与方法
1.1 材料与试剂
样品为市售鸡、鸭、鹅肌肉组织。无水硫酸钠(分析纯)、丙酮(色谱纯) 国药集团化学试剂有限公司;甲醇(色谱纯)、乙腈(色谱纯) 德国默克股份两合公司;正己烷(色谱纯) 永华化学科技(江苏)有限公司;水均为超纯水;ETP(纯度≥98.83%) 德国Dr.Ehrenstorfer公司。
1.2 仪器与设备
1290 InfinityⅡ超高效液相色谱仪、1260荧光检测器、1290 InfinityⅡ FS二极管阵列检测器 美国Agilent公司;PL2002电子天平 美国梅特勒-托利多仪器公司;SB-4200DTS超声波双频清洗机 宁波新芝生物科技股份有限公司;Avanti JXN-26离心机 美国Beckman Coulter公司;R-205旋转蒸发仪 瑞士Buchi Manschette公司;硅酸镁固相萃取柱(1 g/6 mL) 美国Supelco公司。
1.3 方法
1.3.1 标准溶液的配制
标准储备液:准确称取适量ETP标准品于10 mL容量瓶中,用甲醇溶解并定容,配制成質量浓度为1.0 mg/mL的标准储备液。
标准工作液:吸取不同体积的标准储备液,用甲醇逐级稀释成质量浓度分别为5、10、20、50、100、200、500 ng/mL的标准工作液。
1.3.2 样品前处理
准确称取新鲜或解冻后的绞碎匀浆试样5.0 g于50 mL具塞塑料离心管中,加入15 mL乙腈和5 g无水硫酸钠,涡旋混匀1 min,振荡5 min,4 000 r/min低温离心5 min,收集提取液于离心管,残渣用10 mL乙腈按照上述步骤重复提取1 次,合并2 次提取液,加入10 mL乙腈饱和的正己烷,振荡混匀后离心分层,取乙腈层60 ℃旋蒸至干,加入2.5 mL甲醇溶解(样品中目标物含量较高时,可用甲醇稀释样液),经0.22 μm滤膜过滤后作为待测液供超高效液相色谱仪分析。
1.3.3 色谱条件
色谱柱:Agilent Eclipse Plus C18柱(2.1 mm×100 mm,1.8 μm);流动相:乙腈、水体积比30∶70;流速0.3 mL/min;柱温30 ℃;进样量5.0 μL;荧光检测器;激发波长272 nm;发射波长394 nm。
1.3.4 结果计算
样品中目标物含量按下式计算。
式中:X为样品中目标物含量/(μg/kg);ρ为测试溶液中目标物质量浓度/(ng/mL)(由仪器工作站软件直接计算得出);V为试样实际稀释液总体积(2.5 mL);m为样品质量/g。
1.4 数据处理
超高效液相色谱图采用Agilent OpenLAB CDS-Acquisition软件进行采集,使用Agilent OpenLab Analysis软件对实验数据进行统计分析,采用Origin 8.0软件绘图。
2 结果与分析
2.1 前处理方法参数选择
2.1.1 前处理方式的选择
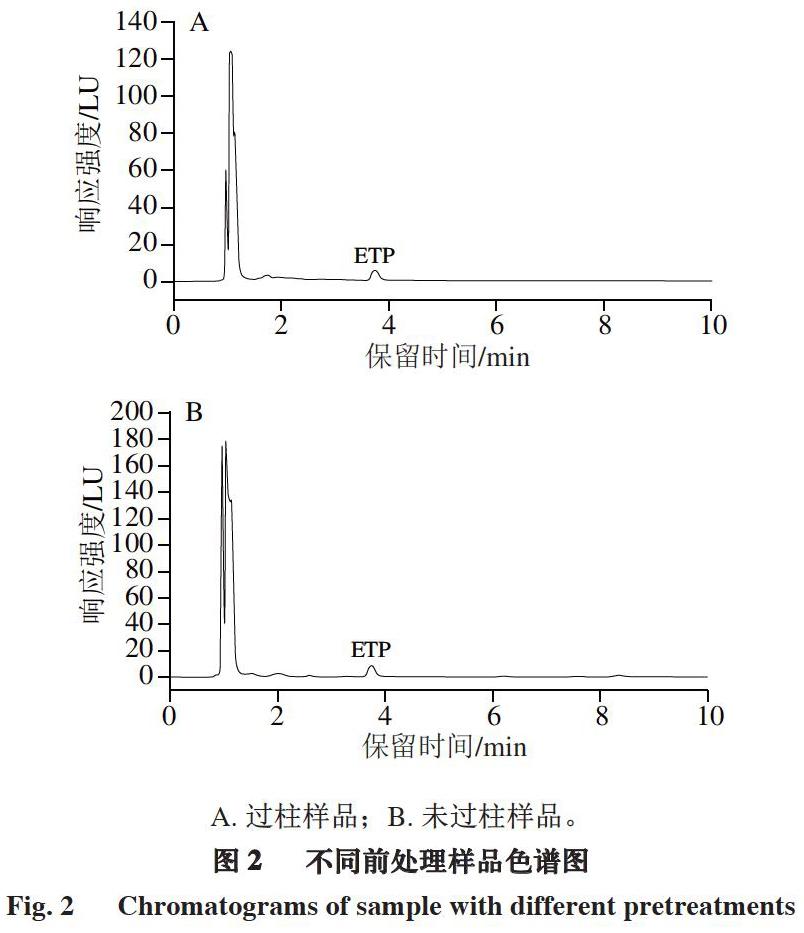
采用高效液相色谱法测定ETP含量时多采用硅酸镁固相萃取柱。固相萃取的选择性吸附和洗脱可以对样品进行富集、分离及净化,采用固相萃取柱能有效去除干扰杂质,因此,常应用于实验室的样品前处理步骤。以鸡肌肉组织为空白基质,添加50 μg/kg ETP标准品,以乙腈为提取试剂,按照1.3.2节进行样品前处理。与采用硅酸镁固相萃取柱的样品前处理方法进行对比分析,比较2 种前处理方式对ETP回收率的影响。
由图2可知,2 种前处理方式均能有效分离目标物,无明显杂峰干扰,但选用本研究方法处理,目标物峰面积较大,回收率更高。因此,选用本研究中前处理方法不仅简便、快速、节约成本,且回收率高、无明显杂峰干扰。
2.1.2 旋蒸温度的选择
以鸡肌肉组织为空白基质,添加100 μg/kg ETP标准品,以乙腈为提取试剂,对比分析不同旋蒸温度对ETP测定结果的影响。由图3可知,旋蒸温度分别为40、45、50、55、60 ℃时,旋蒸温度对ETP回收率几乎没有影响,因此,选择60 ℃为本方法的最佳旋蒸温度,不仅可以缩短前处理时间,还可以提高检测效率。
2.2 色谱条件的选择
2.2.1 检测器的选择
目前,现有液相色谱法测定ETP残留量的检测器有紫外检测器和荧光检测器,紫外检测器适用性广,但灵敏度低,杂质峰干扰多且基线不平稳,而荧光检测器的高灵敏度和强选择性弥补了紫外检测器的不足。由图4可知,在激发波长272 nm、发射波长349 nm条件下,采用荧光检测器测定ETP残留量的响应强度是紫外检测器的近10 倍,因此,本研究选用荧光检测器测定禽肉组织中ETP残留量。
2.2.2 检测波长的选择
激发波长和发射波长是荧光检测的必要参数,通过仪器软件参数设置,获取目标物的最优激发波长和发射波长,可以很大程度地提高检测灵敏度。由图5可知,本方法的最佳荧光检测条件为激发波长272 nm,发射波长349 nm。
2.3 线性方程、方法检出限和定量限
采用外标法对ETP进行定量分析,按1.3.3节色谱条件,以标准品质量浓度为横坐标,峰面积为纵坐标计算回归方程和相关系数,得到回归方程为y=0.109 5x+0.091 3(R2=0.999 7),该方法在质量浓度5~500 ng/mL范围内线性良好,满足定量分析要求。
在最优实验条件下,向空白基质样品中添加ETP标准溶液,按1.3节实验方法测定,以测定结果的3 倍信噪比(RS/N≥3)为检出限(limit of detection,LOD),10 倍信噪比(RS/N≥10)为定量限(limit of quantification,LOQ),计算可得,方法LOD为2 μg/kg,LOQ为5 μg/kg。我国现行标准GB 31660.9—2019《食品安全国家标准 家禽可食性组织中乙氧酰胺苯甲酯残留量的测定 高效液相色谱法》[12]中规定,禽肌肉组织中ETP的LOD为20 μg/kg,LOQ为50 μg/kg,均大于本研究测定值,因此,本方法具备更灵敏的定量检测能力,满足禽肉组织中ETP残留量的分析要求。
2.4 方法准确度和精密度
为考察本方法的准确度和精密度,选择不同基质样品(鸡肉、鸭肉、鹅肉),以5、50、500 μg/kg(方法LOQ、选一合适点、国标最高残留限量)3 个水平将ETP添加到阴性基质样品中,每组6 个平行。
由表1可知,各基质样品中ETP平均回收率为83.0%~91.5%,相对标准偏差为1.6%~2.9%,表明该法准确度高、精密度好,能满足兽药残留[29]定量分析要求和实验室质控[30]要求。
3 结 论
建立超高效液相色谱-荧光检测法测定肉类食品中ETP残留量。综合现有分析方法,简化了前处理步骤,优化了仪器参数,確立了LOD和LOQ,提高了方法灵敏度和准确度。实验结果表明,该法具有前处理操作简单、成本低、重复性好、灵敏度和准确度高、基线平稳、杂峰干扰小等特点,解决了现有文献报道中前处理繁琐耗时、成本高、分析时间长等问题。本研究方法的建立有利于样品的通量分析,提高了实验室检测效率,为测定肉类食品中ETP残留量提供了可靠、准确的分析方法。
参考文献:
[1] 李兆周, 李智丽, 陈秀金, 等. 氧化还原引发制备乙氧酰胺苯甲酯分子印迹微球及其表征[J]. 分析测试学报, 2015, 34(7): 768-774. DOI:10.3969/j.issn.1004-4957.2015.07.003.
[2] BASHA M A, ABD EL-RAHMAN M K, BEBAWY L I, et al. Validated TLC stability indicating methods for the quantitative determination of some veterinary drugs[J]. Microchemical Journal, 2019, 146: 157-163. DOI:10.1016/j.microc.2018.12.057.
[3] 田永民. 养鸡生产中常用的抗球虫药及其使用注意事项[J]. 当代畜牧, 2019(9): 64-65.
[4] 余永鹏. 常用抗球虫药及使用[J]. 广东饲料, 2016, 25(10): 45-47. DOI:10.3969/j.issn.1005-8613.2016.10.013.
[5] 丁佳雯, 翁亚彪, 朱建荣. 乙氧酰胺苯甲酯等药物防治鸡盲肠球虫病的疗效试验[J]. 养禽与禽病防治, 2004(10): 2-3.
[6] 张腊梅, 李道敏, 李兆周, 等. 乙氧酰胺苯甲酯表面分子印迹聚合物的制备与吸附特性[J]. 食品科学, 2016, 37(4): 226-232. DOI:10.7506/spkx1002-6630-201604041.
[7] 陆臻. 抗球虫药物在治疗鸭病中的合理选用研究[J]. 当代畜牧, 2014(20): 61-63.
[8] PIATKOWSKA M, JEDZINIAK P, ZMUDZKI J. Multiresidue method for the simultaneous determination of veterinary medicinal products, feed additives and illegal dyes in eggs using liquid chromatography-tandem mass spectrometry[J]. Food Chemistry, 2016, 197: 571-580. DOI:10.1016/j.foodchem.2015.10.076.
[9] 苏立强, 张慧洁, 姜国强, 等. RAFT沉淀聚合法制备乙氧酰胺苯甲酯分子印迹材料及其应用[J]. 分析试验室, 2018, 37(8): 927-931. DOI:10.13595/j.cnki.issn1000-0720.2018.0179.
[10] NASR J J, SHALAN S, BELAL F. Determination of ethopabate residues in chicken muscles, liver, and eggs after aqueous SDS extraction by micellar liquid chromatography with fluorescence detection with application to baby food[J]. Food Analytical Methods, 2013, 6(6): 1522-1528. DOI:10.1007/s12161-013-9564-1.
[11] 中华人民共和国农业农村部, 中华人民共和国国家卫生健康委员会, 国家市场监督管理总局. 食品安全国家标准 食品中兽药最大残留限量: GB 31650—2019[S]. 北京: 中国标准出版社, 2019.
[25] 农业部畜牧兽医局. 动物源食品中乙氧酰胺苯甲酯残留检测方法: 高效液相色谱法[J]. 中国兽药杂志, 2002, 36(10): 7-8. DOI:10.3969/j.issn.1002-1280.2002.10.004.
[26] MOLONEY M, CLARKE L, OMAHONY J, et al. Determination of 20 coccidiostats in egg and avian muscle tissue using ultra high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2012, 1253: 94-104. DOI:10.1016/j.chroma.2012.07.001.
[27] CHANG S H, LAI Y H, HUANG C N, et al. Multi-residue analysis using liquid chromatography tandem mass spectrometry for detection of 20 coccidiostats in poultry, livestock, and aquatic tissues[J]. Journal of Food and Drug Analysis, 2019, 27(3): 703-716. DOI:10.1016/j.jfda.2019.02.004.
[28] 徐伟, 耿士伟, 刘路, 等. 高效液相色谱-串联质谱法同时检测猪肉中125 种兽药残留[J]. 天津农业科学, 2020, 26(2): 50-57. DOI:10.3969/j.issn.1006-6500.2020.02.012.
[29] 中国兽医药品监察所, 华南农业大学, 中国农业大学, 等. 兽药残留实验室质量控制规范: NY/T 1896—2010[S]. 北京: 中国标准出版社, 2010.
[30] 中華人民共和国浙江出入境检验检疫局, 中国合格评定国家认可中心. 实验室质量控制规范 食品理化检测: GB/T 27404—2008[S]. 北京: 中国标准出版社, 2008.
