食盐对传统发酵肉成熟过程中微生物菌群、理化性质及盐溶性蛋白特性的影响
2020-12-28汤兴宇王浩东吴念黄佳卉黄豪田星李宗军
汤兴宇 王浩东 吴念 黄佳卉 黄豪 田星 李宗军
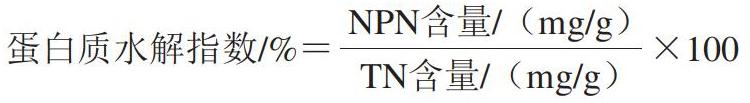
摘 要:以不同食盐添加量(0%、1%、3%、5%、7%)发酵肉(戊糖片球菌∶木糖葡萄球菌=1∶1)为研究对象,测定发酵肉微生物菌群、pH值、水分含量、亚硝酸盐残留量,以及最终成熟发酵肉中食盐、总氮、非蛋白氮及盐溶性蛋白含量,研究食盐添加量对发酵肉成熟过程中微生物菌群、理化性质及盐溶性蛋白特性的影响。结果表明:随着食盐添加量的增加,微生物菌群数量基本呈先上升后下降的趋势;食盐添加量3%的发酵肉,蛋白质水解指数最高,盐溶性蛋白含量最低,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳条带最为清晰。
关键词:发酵肉制品;食盐添加量:微生物菌群;理化特性;盐溶性蛋白
Abstract: To investigate the effects of salt content on the microbial flora, physicochemical properties and salt-soluble protein characteristics of traditional fermented meat made with a mixed starter culture of Pediococcus pentosaceus and Staphylococcus xylose (1:1) during fermentation, microbial populations, pH value, water content, and nitrite residue of fermented meat samples with different initial salt contents (0%, 1%, 3%, 5% and 7%) were measured as a function of fermentation time, and the contents of salt, total nitrogen, non-protein nitrogen and salt-soluble protein in the final product were determined as well. It was found that microbial populations showed a trend of rise and then decline with the increase in salt content. Fermented meat with 3% salt content exhibited the highest proteolytic index, lowest salt-soluble protein content, and clearest bands in sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE).
Keywords: fermented meat products; salt content; microbial flora; physicochemical properties; salt-soluble protein
DOI:10.7506/rlyj1001-8123-20200701-166
中圖分类号:TS251.1 文献标志码:A 文章编号:1001-8123(2020)10-0001-07
发酵肉制品是指在自然和人工控制条件下利用微生物发酵作用,产生具有特殊风味、色泽和质地且具有较长保存期的肉制品[1-2]。随着现代人们生活质量和水平的进一步提高,对于肉制品的营养要求越来越高,营养、健康和特殊风味相结合也成为肉制品的主要研发方向[3]。而传统发酵肉制品加工过程中,发酵肉中的蛋白质经微生物作用分解为氨基酸,而氨基酸进一步分解形成大量的香味物质和营养成分[4],从而促使发酵肉产品产生独特的风味和营养价值。因此,发酵肉制品能够很好地满足现代消费者对高档优质肉制品特殊风味和营养的需求[5-7]。
食盐(NaCl)是肉制品加工中不可或缺的腌制材料,不仅能赋予产品咸度,增加鲜度,而且对产品加工及品质特性的形成具有重要贡献。一方面,食盐增强了肉制品的保水能力,从而促进理想凝胶质地的形成;另一方面,食盐可通过控制生化和酶促反应来促进香气和风味的产生。此外,食盐能够降低水分活度,抑制微生物的生长繁殖[8]。事实上,肉类食品在人类饮食钠消耗量中的占比约为20%~30%,尤其是发酵肉制品,其食盐含量一般高于其他食品数倍,由于长时间发酵过程中水分迁移和蒸发,食盐含量可能达到5.0%~8.0%[9]。但是,过量摄入高盐食品会增加高血压、中风和血管疾病的患病风险[10],如何降低肉制品中的食盐添加量已成为肉制品加工领域的研究热点和全民健康的焦点之一。国内外肉制品行业也在积极采取多种降盐措施,但在工业化生产中降低肉制品中食盐用量仍存在困难[11-13]。目前,国内外研究主要集中于降低肉制品中钠盐的途径,而从发酵成熟过程的角度出发,针对食盐对传统发酵肉成熟过程中微生物菌群、理化性质及蛋白特性变化影响的研究较少[14-16]。事实上,食盐在发酵肉制品成熟过程中具有重要作用,添加量不同,食盐对发酵肉成熟过程中微生物菌群和理化性质的影响也不尽相同。
本实验以同一批次的新鲜优质猪里脊肉为原料,以戊糖片球菌(Pediococcus pentosaceus)和木糖葡萄球菌(Staphylococcus xylosus)为发酵剂,研究不同食盐添加量发酵肉在成熟过程中微生物菌群、理化性质及盐溶性蛋白特性的变化,为提高发酵肉制品安全性提供理论指导和数据支持。
1 材料与方法
1.1 材料与试剂
新鲜优质猪里脊肉 湖南伟鸿食品有限公司;52°白酒、食鹽、味精、白糖 长沙嘉而惠超市。
戊糖片球菌由中国科学院微生物保藏中心提供;木糖葡萄球菌由本实验室分离自传统湘西腊肉。
MRS培养基、平板计数培养基、MSA培养基、马丁孟加拉红-链霉菌琼脂培养基、结晶紫中性胆碱盐培养基 广东环凯微生物科技有限公司。
三氯乙酸、盐酸、氢氧化钠、硼酸、硫酸、硫酸钾、硫酸铜、对氨基苯磺酸、盐酸萘乙二胺、亚硝酸钠、乙酸锌、氨水、醋酸铅、硫酸钠、氯化钠、酚酞、铬酸钾、硝酸银(均为分析纯) 天津市化学试剂一厂。
1.2 仪器与设备
K9860全自动凯式定氮仪 山东海能科学仪器有限公司;CP114分析天平 奥豪斯仪器有限公司;Testo 250 pH计、LabTech分光光度计 北京莱伯泰科仪器有限公司;D2S2-LJ080高压灭菌锅 山东新医疗器械股份有限公司;101-3HB干燥箱 天津泰斯特仪器有限公司;SKY-2102C摇床 上海浦东生物光学仪器厂;SW-CJ-IFD超净工作台 苏州净化设备有限公司;KQ-100E超声清洗仪 昆山市超声仪器有限公司;LG10-24A高速台式离心机 常州中捷实验仪器制造有限公司;GZ-250-HSII恒温恒湿箱 广智科技设备有限公司;TG16-WS离心机 长沙湘仪离心机仪器有限公司;XMTD-7000水浴锅 北京市永光明医疗仪器有限公司。
1.3 方法
1.3.1 发酵剂和发酵肉的制备
取适量已活化的戊糖片球菌和木糖葡萄球菌菌种分别接种于MRS肉汤培养基和MSA液体培养基中,37 ℃摇床培养24 h。
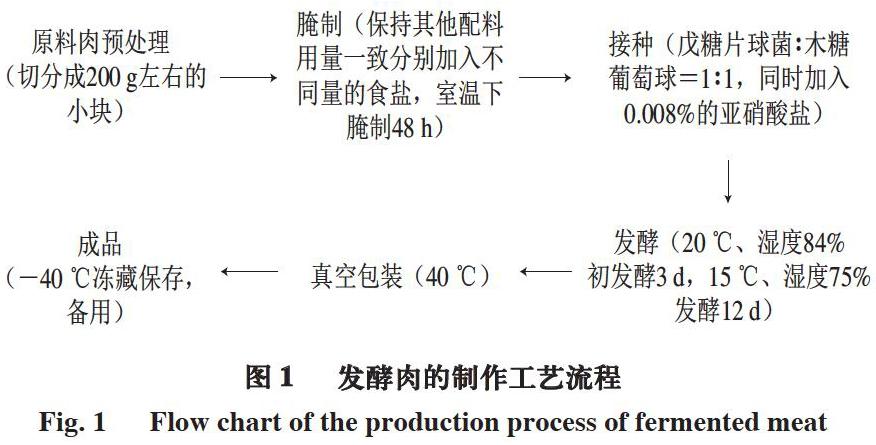
选取新鲜的无脂猪里脊肉,以每块质量约(200±2) g按纹理进行切分,分别添加不同质量分数(0%、1%、3%、5%、7%)食盐,并与其他辅料(白酒2%、白糖1.5%、味精0.3%)充分混合,常温腌制48 h后,按照每100 g原料肉,添加1 mL菌体浓度108 CFU/g的发酵剂菌液(戊糖片球菌∶木糖葡萄球菌=1∶1),同时加入0.008%亚硝酸钠。工艺流程如图1所示。
1.3.2 样品采集
在发酵0、5、10、15 d时,分别对不同食盐添加量发酵肉取样,每次随机取2 块,每块取3 个不同点,每次至少取50 g。取样后,各样本取一部分直接进行微生物指标测定,剩余部分真空包装后于-40 ℃冷冻保存,用于其他指标测定。
1.3.3 微生物指标测定
取不同发酵成熟阶段肉样置于无菌超净工作台中,切碎,取25 g肉样置于含有225 mL无菌生理盐水的三角瓶中,封口后于摇床中振荡40 min,取1 mL上清液于含有9 mL无菌生理盐水的试管中,对上清液进行梯度稀释,分别稀释至10-3、10-4、10-5,每个稀释度做3 个平行。细菌菌落总数计数采用PCA平板计数培养基,28 ℃培养48 h;葡萄球菌计数采用MSA培养基,37 ℃培养72 h;乳酸菌计数采用MRS培养基(含100 mg/L放线菌酮),37 ℃培养48 h;肠杆菌计数采用结晶紫中性胆碱盐培养基,37 ℃培养24 h;酵母菌计数采用马丁孟加拉红-链霉菌琼脂培养基,28 ℃培养72 h;每个实验重复3 次,结果取平均值。
1.3.4 理化指标测定
1.3.4.1 pH值
参照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》[17]中的玻璃电极法。
1.3.4.2 水分含量
参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》[18],采用直接干燥法进行测定。称取4 g搅碎肉样置于已烘干至恒质量的称量瓶中(前后2 次质量差不超过2 mg即为恒质量),105 ℃烘干至样品恒质量。每个样品做3 次平行。
1.3.4.3 亚硝酸钠残留量
参照GB 5009.33—2016《食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定》[19]的盐酸萘乙二胺法。
1.3.4.4 食盐含量
参照GB 5009.42—2016《食品安全国家标准 食盐指标的测定》[20]中的间接滴定法。
1.3.5 蛋白质水解情况测定
1.3.5.1 总氮(total nitrogen,TN)和非蛋白氮(non protein nitrogen,NPN)含量TN含量:参照张会丽等[21]的方法,称取0.5 g肉样,放入消化管内,加入10 mL浓硫酸(体积分数98%)和由0.2 g硫酸铜和3 g硫酸钾组成的混合催化剂,在380 ℃条件下消化2 h,冷却至室温后用凯氏定氮仪进行测定。
NPN含量:参照吴雪燕等[22]的方法,称取(1.000±0.001)g肉样,加入15 mL预冷的10 g/100 mL三氯乙酸溶液,5 000 r/min匀浆1 min,4 ℃放置过夜。将匀浆液以4 500 r/min离心5 min,弃去沉淀,上清液用定性滤纸过滤到消化管中,按照TN含量测定过程相同步骤进行消化,冷却至室温后,用凯氏定氮仪进行测定。
1.3.5.2 蛋白质水解指数
按下式计算:
1.3.6 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析盐溶性蛋白质的提取:准确称取(2.000±0.001) g肉样于50 mL离心管中,加入16 mL 0.2 mol/L pH 6.5的磷酸盐缓冲液(含0.6 mol/L NaCl和0.03 mol/L MgCl2),5 000 r/min匀浆2 min,每30 s暂停1 次防止过热,4 ℃静置18 h后,再于10 000 r/min条件下离心15 min,取上清液,即为盐溶性蛋白质溶液,立即使用或置于-40 ℃条件下冷冻备用。用双缩脲法测定蛋白质量浓度。
将上述盐溶性蛋白质提取液稀释至质量浓度为1 mg/mL,等质量等体积与上样缓冲液混合,沸水浴5 min,10 000 r/min离心2 min,取上清液待测。按照试剂盒说明配制12%分离胶和5%浓缩胶,上样量10 μL,120 V恒压电泳20 min后,150 V恒压电泳至终点。用考马斯亮蓝R250染色1 h,脱色至背景无色,扫描图谱并分析条带。
1.4 数据处理
所有指标测定均重复进行3 次。用SPSS 25.0软件采用方差分析进行显著性差异分析,P<0.05表示差异显著;用Excel软件绘图。
2 结果与分析
2.1 发酵过程中不同食盐添加量发酵肉的微生物指标变化
2.1.1 细菌菌落总数
由图2可知,发酵期间随着发酵时间的延长,不同食盐添加量发酵肉的细菌菌落总数均呈波动降低的趋势,食盐添加量0%~5%发酵肉的细菌菌落总数在发酵10 d时达到最高,食盐添加量7%发酵肉在发酵15 d时达到最高。这可能是由于发酵前期微生物作用使蛋白质降解,为细菌生长繁殖提供了充足营养,而发酵后期水分含量降低,氯化钠质量浓度上升,营养物质含量也减少,细菌生长速率受到抑制,细菌数量逐渐减少。此外,在腌制过程中加入食盐也能够有效抑制杂菌的生长,并加速发酵进程[23],因此,随着腌制过程中食盐添加量的增大,发酵肉中的细菌总数呈现一定波动性。
2.1.2 葡萄球菌数
由图3可知,随着发酵时间的延长,不同食盐添加量发酵肉葡萄球菌数整体呈先升高后下降的趋势,发酵5~15 d期间,食盐添加量3%发酵肉的葡萄球菌数显著低于其余4 组(P<0.05),其原因可能是与乳酸菌相比,3%的食盐添加量对葡萄球菌的抑制作用更强,同时乳酸菌产生的乳酸降低pH值,使葡萄球菌数量进一步降低。
2.1.3 肠杆菌数
由图4可知,不同食盐添加量发酵肉的肠杆菌数随着发酵时间的延长整体呈下降趋势。整个发酵期间,食盐添加量0%与1%发酵肉的肠杆菌数(除发酵5 d)差异不显著,当食盐添加量增大至3%~7%时,发酵肉肠杆菌数量明显降低,由此可见,高食盐添加量对于发酵肉中大肠杆菌有明显的抑制作用。
2.1.4 乳酸菌数
由图5可知:腌制时加入的食盐、发酵剂在一定程度上抑制乳酸菌的生长,随着发酵时间的延长耐受性逐渐增强,乳酸菌数缓慢上升;发酵期间随着食盐添加量的增加乳酸菌数先增加后降低,但发酵15 d时食盐添加量3%发酵肉中的乳酸菌数最低;发酵期间食盐添加量1%发酵肉的乳酸菌数始终高于其他食盐添加量的发酵肉,由此可知,1%的食盐添加量较为适合乳酸菌的生长。发酵肉成熟过程中,乳酸菌一直处于优势地位,从而抑制腐败菌和致病菌的生长[24]。
2.1.5 酵母菌数
酵母菌作为兼性好氧菌,能够消耗发酵肉中的氧气,并且产生蛋白酶和脂肪酶,使肉制品产生大量的风味物质[25]。由图6可知,不同食盐添加量发酵肉中的酵母菌数均在发酵前期(0~5 d)急剧增长,发酵后期(10~15 d)快速下降,但始终高于初始酵母菌数。酵母菌有较强的抗逆能力,可抵抗低水分活度,且耐酸、耐厌氧。
2.2 发酵过程中不同食盐添加量发酵肉理化指标的变化
2.2.1 水分含量和pH值
由图7可知:发酵初期(0~5 d),随着食盐添加量增加,发酵肉中的水分含量逐渐减少,这是由于食盐不仅能增强渗透压,并且随食盐添加量增加,Na+迁移速率增大,促使发酵肉脱水[25],而且还会导致蛋白质持水力下降;发酵后期(10~15 d),由于高添加量的食盐抑制了微生物生长,减缓了发酵肉中水分含量的下降。
成熟过程中pH值的变化影响发酵肉中水解酶的活性,从而影响蛋白和脂质水解进程,挥发性风味成分的释放,并影响最终发酵肉的品質[26]。较低pH值会抑制肉中蛋白质水解酶的活性,并改变最终产品的风味。由图8可知,发酵初期(0~5 d),3%食盐添加量的发酵肉pH值最低,这可能是由于食盐添加量适中,微生物大量繁殖分解肉中碳水化合物导致酸类物质增多。而发酵后期,微生物分解蛋白质产生的胺类物质积累导致pH值升高。
2.2.2 食盐含量
由图9可知,随着食盐添加量的增加,发酵肉终产品中的食盐含量逐渐增加,并且相比腌制时均略有上升。食盐添加量3%和5%发酵肉终产品中的食盐含量接近,可能是由于5%食盐添加量的发酵肉中,部分Na+被细胞吸收,细胞发生脱水,但细胞膜仍具有生理活性,进一步提高食盐添加量,肌肉细胞脱水死亡,细胞液外泄,使终产品中的食盐含量增大。
2.2.3 亚硝酸盐残留量
本实验发酵肉腌制时的亚硝酸盐添加量为0.008%,由图10可知,发酵0 d,亚硝酸盐残留量均低于80 mg/kg,这可能是腌制阶段亚硝酸盐与肉样中的其他物质发生反应导致含量降低[27]。发酵初期(0~5 d),食盐添加量0%、1%和5%发酵肉中的亚硝酸盐残留量显著降低(P<0.05),食盐添加量7%发酵肉中的亚硝酸盐残留量显著升高(P<0.05),这是因为在发酵初期,亚硝酸盐主要起到发色和抑菌作用。发酵后期(10~15 d),亚硝酸盐残留量明显降低。整个发酵期间,食盐添加量3%发酵肉中的亚硝酸盐残留量变化不大。
2.3 不同食盐添加量发酵肉终产品的蛋白质水解相关指标变化
蛋白质水解是传统发酵肉制品加工过程中重要的生化反应,而蛋白质水解指数可以反映蛋白质的水解程度以及风干过程中蛋白质分解的宏观进程[28]。由表1可知,随着食盐添加量的增加,发酵肉终产品中的TN含量逐渐降低,蛋白质水解指数基本维持不变,其中3%~5%食盐添加量的发酵肉蛋白质水解程度最高。
2.4 不同食盐添加量发酵肉终产品的盐溶性蛋白特性
由图11可知,随着食盐添加量的增加,发酵肉终产品中的盐溶性蛋白含量呈先减少后增加再减少的趋势。研究表明,蛋白质溶出量与其盐溶性存在函数关系,食盐是影响盐溶性蛋白提取的重要因素[29-30]。本研究中,食盐添加量3%时盐溶性蛋白流失最快,导致其终产品中的盐溶性蛋白含量最少。
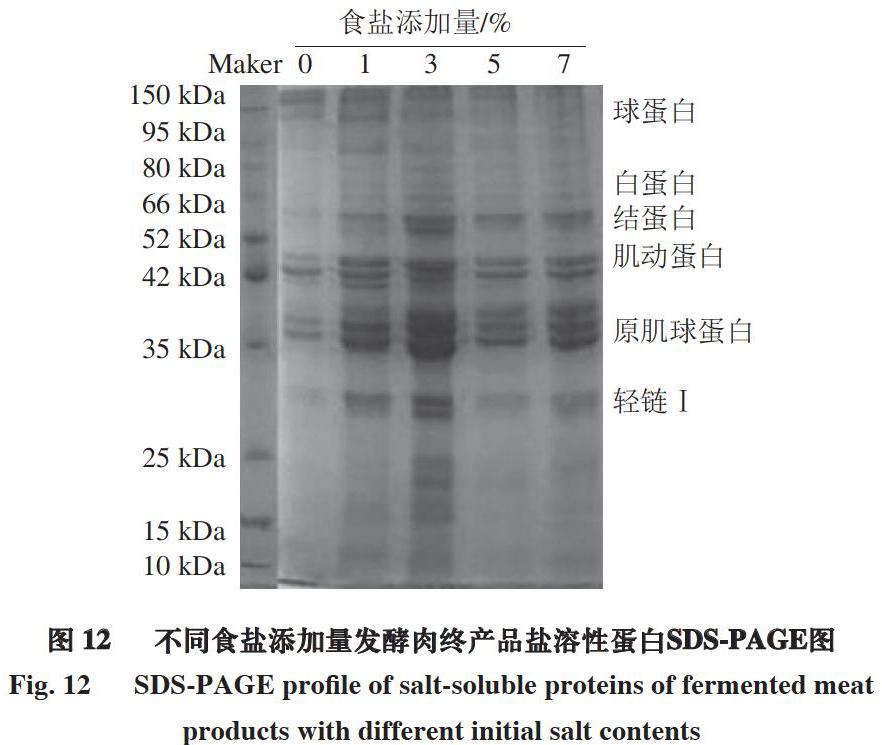
由图12可知,盐溶性蛋白质分子主要集中在20~66 kDa,添加食盐后条带颜色加深,食盐添加量3%时条带最为清晰,表明其所含目标蛋白(结蛋白、肌动蛋白、原肌球蛋白以及轻链Ⅰ)最多。这可能是因为3%食盐添加量较为适合发酵肉中微生物生长,此外,盐溶性蛋白含量的减少与pH值变化有关,酸碱环境的改变会导致盐溶性蛋白聚集,蛋白变性成不溶性蛋白质,从而导致蛋白质提取液中溶出量减少。
3 结 论
发酵肉成熟过程中,随着食盐添加量的增加,发酵肉微生物菌群数基本呈先上升后下降的趋势。食盐添加量对发酵肉的pH值、亚硝酸钠残留量等指标有重要影响,蛋白质水解指数基本维持不变,其中3%食盐添加量发酵肉的蛋白质水解指数最高、盐溶性蛋白含量最低、SDS-PAGE电泳条带最为清晰。从健康方面考虑,3%食盐添加量的发酵肉,其盐含量适中,明显低于市场销售的5%~8%食盐含量的高盐发酵肉制品,这说明在保证发酵肉风味和营养的同时,可以适当控制和减少食盐添加量,从而确定最佳的发酵肉制品加工配方。如何生产出高品质、营养健康的功能性发酵肉制品将成为肉制品加工行业的新热点。
参考文献:
[1] 王艳梅, 马俪珍. 发酵肉制品的研究现状[J]. 肉类工业, 2004(6): 41-42. DOI:10.3969/j.issn.1008-5467.2004.06.016.
[2] 马菊, 孙宝忠, 郝永清. 国内外发酵肉制品歷史及发展现状比较[J].肉类工业, 2006(9): 69-71. DOI:10.3969/j.issn.1001-8123.2006.09.019.
[3] 周传云, 聂明, 万佳蓉. 发酵肉制品的研究进展[J]. 食品与机械, 2004(2): 11-13. DOI:10.3969/j.issn.1003-5788.2004.02.017.
[4] 苏丹, 赖雪雷, 康健波, 等. 肉制品加工研究进展与新技术应用[J]. 农产品加工(学刊), 2011(5): 51-56. DOI:10.3969/jissn.1671-9646(C).2011.05.001.
[5] 周亚军, 闫琳娜, 钱曦, 等. 发酵鹿肉制品的发酵特性与工艺配方优化[J]. 食品与发酵工业, 2009, 35(6): 130-134. DOI:10.3969/j.issn.1009-3044.2008.34.162.
[6] 郭晓芸, 张永明, 张倩. 发酵肉制品的营养、加工特性与研究进展[J]. 肉类工业, 2009(5): 47-50. DOI:10.3969/j.issn.1008-5467.2009.05.021.
[7] 向聪. 肉类发酵技术[J]. 肉类研究, 2009, 23(4): 62-65.
[8] 李大宇, 张苏苏, 董学文, 等. 低盐肉制品降盐与品质改良加工技术研究进展[J]. 食品安全质量检测学报, 2017, 8(6): 1947-1953. DOI:10.3969/j.issn.2095-0381.2017.06.002.
[9] 张露, 张雅玮, 惠腾, 等. 低钠盐对干腌肉制品加工过程中理化特性的影响[J]. 食品科学, 2014, 35(17): 77-82. DOI:10.7506/spkx1002-6630-201417016.
[10] 扈莹莹, 温荣欣, 陈佳新, 等. 低盐对发酵肉制品品质形成影响及减盐手段研究进展[J]. 食品工业科技, 2019, 40(16): 324-328; 335. DOI:10.13386/j.issn1002-0306.2019.16.054
[11] TIAN X, FISK I D. Salt release from potato crisps[J]. Food & Function, 2012, 3(4): 376-380. DOI:10.1039/c2fo10282j.
[12] WYNESS L A, BUTRISS J L, STANNER S A. Reducing the populations sodium intake: the UK Food Standards Agencys salt reduction programme[J]. Public Health Nutrition, 2012, 15(2): 254-261. DOI:10.1017/S1368980011000966.
[13] 刘宗敏. 发酵肉制品研究现状及发展趋势[J]. 山东食品发酵, 2014(1): 50-52. DOI:10.3969/j.issn.1008-5467. 2008.09.020.
[14] 赵丽华, 靳烨, 马长伟, 等. 戊糖片球菌与复合发酵剂对羊肉干发酵香肠质地剖面分析(TPA)和色泽的影响[J]. 食品科技, 2009(10): 122-126.
[15] 郝红涛, 赵改名, 柳艳霞, 等. 肉类制品的质构特性及其研究进展[J].食品与机械, 2009, 25(3): 125-128.
[16] CHENG J H, WANG S T, OCKERMAN H W. Lipid oxidation and color change of salted pork patties[J]. Meat Science, 2007, 75(1): 71-77. DOI:10.1016/j.meatsci.2006.06.017.
[17] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品pH值的测定: GB 5009.237—2016[S]. 北京: 中国标准出版社: 2016.
[18] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品中水分的测定: GB5009.3—2016[S]. 北京: 中国标准出版社: 2016.
[19] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品中亚硝酸钠残留量的测定: GB 55009.33—2016[S]. 北京: 中国标准出版社: 2016.
[20] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品中氯化钠的测定: GB/T 5009.42—2016[S]. 北京: 中国标准出版社, 2016.
[21] 张会丽, 余翔, 张弘, 等. 鲈鱼风干成熟工艺及对蛋白质水解和感官品质的影响[J]. 食品科学, 2010, 31(16): 47-51.
[22] 吴雪燕, 张培培, 汪淼, 等. 中式香肠蛋白氧化降解对产品品质的影响[J]. 食品工业科技, 2014, 35(14): 151-156. DOI:10.13386/j.issn1002-0306.2014.14.025.
[23] 邢云霞, 马敏杰, 巴吐尔·阿不力克木. 食盐添加量对草鱼腌制效果的影响[J]. 肉类研究, 2018, 32(10): 38-43. DOI:10.7506/rlyj1001-8123-201810005.
[24] 周慧敏, 张顺亮, 赵冰, 等. 木糖葡萄球菌和肉葡萄球菌混合发酵剂对腊肉品质的影响[J]. 食品科学, 2018, 39(22): 32-38. DOI:10.7506/spkx1002- 6630- 201822006.
[25] ESSID I, HASSOUNA M. Effect of inoculation of selected Staphylococcus xylosus and Lactobacillus plantarum strains on biochemical, microbiological and textural characteristics of a Tunisian dry fermented sausage[J]. Food Control, 2013, 32(2): 707-714. DOI:10.1016/j.foodcont.2013.02.003.
[26] 潘曉倩, 成晓瑜, 张顺亮, 等. 不同发酵剂对北方风干香肠色泽和风味品质的改良作用[J]. 食品科学, 2015(14): 107-112. DOI:10.7506/spkx1002-6630-201514016.
[27] ARMENTERO M, ARISTOY M C, BARAT J M, et al. Biochemical changes in dry-cured loins salted with partial replacements of NaCl by KCl[J]. Food Chemistry, 2009, 117(4): 627-633.DOI:10.1016/j.foodchem.2009.04.056.
[28] 纪韦韦, 臧明伍, 张迎阳. 狼山鸡腌制风干成熟过程中蛋白质分解及游离氨基酸变化规律[J]. 食品科学, 2014, 35(7): 72-76. DOI:10.7506/spkx1002-6630-201407015.
[29] LAWRIE R A, LEDWARD D. Lawries meat science[M]. Seventh Edition. Woodhead: Woodhead Publishing, 2006: 371-415. DOI:10.1016/j.ijfoodmicro.2003.08.003.
[30] TOBIN B D, O SULLIVAN M G, HAMILL R M, et al. Effect of varying salt and fat levels on the sensory and physiochemical quality of frankfurters[J]. Meat Science, 2012, 92(4): 659-666. DOI:10.1016/j.meatsci.2012.06.017.
