苎麻根部内生细菌的分离鉴定及促生潜力评价
2020-12-26杨琦刘淳劼郭兵段盛文成莉凤冯湘沅郑科彭源德
杨琦,刘淳劼,郭兵,段盛文,成莉凤,冯湘沅,郑科,彭源德
(中国农业科学院麻类研究所,湖南 长沙 410205)
苎麻(Boehmerianivea)是荨麻科苎麻属的多年生作物,具有重要的纤用、饲用及药用价值[1]。苎麻原产中国,其栽培历史已达4000年以上,是我国极具特色的经济作物,国际上称其为“中国草”。我国的苎麻产量约占全世界苎麻产量的90%以上,具有较大的经济效益和国际影响力[2]。近年来,苎麻栽培过程中大范围施用化肥,导致有害物质在土壤中滞留,造成了土壤板结、盐碱化等危害。人们逐渐意识到减少环境污染,实现农业的可持续性发展,需要发现并使用一些新型生物肥料,减少化肥施用量,优化传统种植模式。植物内生菌是指能够寄生在健康植物活组织内而不引起寄主植物明显病变的一大类微生物,主要包括细菌、真菌和放线菌[3]。其中,内生细菌是内生菌的重要组成部分,植物内生细菌可以从植物周围组织环境中吸取营养来进行生长繁殖,同时也可以通过菌株生长、生理代谢活动等影响植物宿主的生长和发育[4]。由于植物与内生细菌以及内生菌群之间复杂的互作关系,内生细菌在植物促生长以及病害生物防治方面具有较好的应用潜力。因此,寻找既可以促进生长,又可以促进植物免疫能力提高的内生菌,最终以微生物菌剂、菌肥等形式应用于农业生产是现代生物防治的发展趋势之一。
内生细菌是植物微生态系统的重要组成部分,在不同植物器官内的分布数量存在差异。研究[5]发现,内生细菌在植物的根部分布最多,其次为茎和叶。内生菌是植物微生态系统的组成成分,与寄主植物形成共生关系。一些内生细菌具有促进植物生长和拮抗病原菌的作用,属于植物促生菌范畴。理论上,以促生细菌为原料制成的生物菌剂或菌肥可代替传统化肥,对其深入研究并力求产品化,可减少施用化肥对环境和作物造成的污染,对可持续农业的发展具有重要理论意义和实用价值。因此,分离鉴定苎麻根部的内生细菌,对于探究苎麻的内生细菌群落结构和发现功能菌株等具有重要意义。目前,对苎麻内生细菌的研究较少,尤其是可用于苎麻农业生产中的微生物菌肥稀少,因此,本文拟采用传统培养方法分离苎麻根部的内生细菌,并鉴定其种属信息,从溶磷能力、固氮能力及具ACC脱氨酶活性三个方面评估其促生潜力,旨在为促生菌菌种资源的开发和促生菌制剂的研制奠定理论和技术基础。
1 材料与方法
1.1 材料
1.1.1 试验材料
供试材料为12年麻龄的健康苎麻根(品种为中苎1号),2020年5月采集于中国农业科学院沅江试验站,采集后的苎麻根装于密封袋中,于实验室 4℃低温保存,并及时进行内生细菌的分离。
1.1.2 培养基
LB培养基:胰蛋白胨 10.0 g,酵母提取物5.0 g,NaCl 10.0 g,固体培养基另加琼脂粉15.0 g,加双蒸水至1000 mL,121℃灭菌20 min。
TSB液体培养基:胰蛋白胨 17.0 g,植物蛋白胨 3.0 g,NaCl 5.0 g,K2HPO42.5 g,葡萄糖 2.5 g,pH 7.3,115℃灭菌30 min。
NBRIP无机磷固体培养基:葡萄糖 10.0 g,Ca3(PO4)25.0 g,MgCl25.0 g,MgSO4·7H2O 0.25 g,KCl 0.2 g,(NH4)2SO41.0 g,琼脂 15.0 g,加双蒸水至 1000 mL,pH 7.0,115℃灭菌 30 min。
无氮固体培养基:蔗糖 10.0 g,K2HPO40.5 g,MgSO4·7H2O 0.2 g,NaCl 0.2 g,CaCO31.0 g,琼脂 15.0 g,加双蒸水至1000 mL,pH 7.2,115℃灭菌30 min。
ADF液体培养基:购自北京雷根生物技术有限公司。
1.2 方法
1.2.1 内生细菌的分离
内生细菌的分离方法参照文献[6],略做修改。将生长状况良好的苎麻根样品置于流动的自来水下冲洗干净,用滤纸吸干根部表面水分。将洗净吸干后的材料放入超净工作台内,在工作台内用剪枝剪将枝干剪成2~3 cm的小段,然后在超净工作台内用无菌水洗涤苎麻根3次,每次约3 min。将洗涤后的苎麻根浸在75%的乙醇中消毒3 min,无菌水洗涤3次,再用Cl-浓度约为3%的NaOCl浸泡3 min,无菌水洗涤5次。为验证苎麻根表面消毒成功,取最后的清洗液200μL涂布于LB固体培养基上,若没有长菌,则证实灭菌成功[7]。将洗净的苎麻根置于无菌滤纸上,吸去多余水分。随后将处理好的苎麻根置于无菌研钵中,加入10倍体积的无菌生理盐水(0.9%的NaCl溶液)进行研磨,匀浆后静置5 min,取悬液进行10倍系列的梯度稀释,分别取不同稀释梯度的悬液200μL涂布于LB固体培养基上,封口膜封好培养皿,置于30℃培养箱中暗培养,培养期间每隔12 h观察1次,待菌落长出后及时分离纯化并编号记录。
1.2.2 内生细菌的纯化与鉴定
将长出的内生细菌菌落挑取至液体LB培养基中进行扩培,培养温度为30℃,摇床转速为200 r/min,培养时间为24 h。采用多步梯度稀释涂布的方法对培养液中的细菌进行纯化,直至在LB固体平板上获得多个菌落形态一致的单菌落。对纯化后的菌株进行试管斜面和甘油管保存。
采用16S rRNA基因序列分析法鉴定内生细菌[8-9]。将试管斜面或甘油保藏管中的内生细菌置于液体LB培养基中进行活化,培养温度为30℃,培养时间约为24 h,摇床转速为200 r/min。采用平板划线的方法将活化后的细菌转接于LB固体培养基上,30℃倒置暗培养。培养24 h后从平板上随机挑取3个单菌落置于LB液体培养基中扩培,第二天提取基因组DNA,提取步骤按照细菌基因组试剂盒的操作说明(天根生化科技有限公司,北京,中国)。以基因组DNA为模板,利用通用引物 27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和 1492R(5’-GGTTACCTTGTTACGACTT-3’)扩增基因组中的16S rRNA基因序列。建立50μL PCR扩增体系:34μL无菌双蒸水,5μL 10×PCR缓冲液,4.5μL dNTP,2μL 27F引物,2μL 1492R引物,1.5μL细菌基因组模板,1μL rTaq DNA聚合酶(Takara,宝生物工程有限公司,大连,中国)。采用Bio-Rad PCR仪进行PCR反应,反应程序:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸90 s,30个循环;72℃延伸10 min;12℃停止程序并保存。用1%的琼脂糖凝胶电泳检测PCR扩增结果,利用凝胶成像系统观察PCR扩增结果并拍照。将PCR产物送往生工生物工程(上海)股份有限公司进行测序,利用NCBI上的BLAST工具对菌株的测序结果进行对比,通过软件MEGA 6.0进行序列相似性分析,并构建系统发育树[10]。
1.2.3 促生潜力分析
将纯化并鉴定后的内生细菌在TSB液体培养基中进行扩培,培养温度为30℃,培养时间为24 h,摇床转速为200 r/min。扩培好的内生细菌用于评估其促生潜力,本研究从溶磷能力、固氮能力及具ACC脱氨酶活性三个方面评估了内生细菌的促生潜力。所有试验重复3次。
溶磷能力测定[11]:取5μL菌液点接于NBRIP无机磷固体培养基上,置于30℃培养箱中培养6 d,观察有无解磷圈及解磷圈大小,根据解磷圈与菌落比值大小确定其对无机磷的解磷作用。
固氮能力测定:根据赵希俊等[12]的方法并作少量修改,取5μL菌液点接于无氮固体培养基,30℃培养6 d,观察其生长情况,根据菌斑大小推测内生细菌的固氮潜力。
产ACC脱氨酶潜力分析:以2%的接种量将菌液转接至5mL ADF液体培养基中,培养24 h后于OD600nm下测定吸光值,观察各内生细菌的生长情况,以转接前后吸光值的比值大小评估其产ACC脱氨酶的潜力。
1.2.4 数据分析
所获得的数据采用Excel 2007记录及绘制图表,并采用SPSS软件统计分析,利用t检验分析极值是否具有显著性差异(p<0.01)。
2 结果与分析
经过对苎麻根部内生细菌的分离,从最初的LB分离平板上共获得19个单菌落,编号分别为Strain 1至Strain 19。进一步扩大培养和纯化发现,仅有12株内生细菌可以在LB液体或固体培养基上生长,后续对这12株内生细菌进行了16S rRNA基因序列鉴定和促生潜力分析。
2.1 16S rRNA基因序列与系统发育分析
用引物27F和1492R从12株内生细菌基因组中分别扩增出约1.5 kb的PCR产物,所得PCR产物送往生工生物工程(上海)股份有限公司进行测序。在NCBI网站上利用BLAST工具进行序列比对分析,结果显示除了Strain 19外,其余11株内生细菌的16S rRNA基因序列与NCBI数据库中已报道的相关菌株16S rRNA基因序列的相似性均为100%(表1)。其中,Strain 2、Strain 4、Strain 5、Strain 6、Strain 12、Strain 15、Strain 18与菌株 Pseudomonas frederiksbergensis strain PgBE257的16S rRNA基因序列的相似性均达到100%,说明这7株内生细菌为同一株或同一种属的细菌,菌株间的同源性极高。

表1 内生细菌的16S rRNA基因序列相似性Table 1 16S rRNA gene sequence similarity ofendophytic bacteria from ramie roots
通过MEGA 6.0软件构建了12株内生细菌和6株参考菌株16S rRNA基因序列的系统进化树(图1)。结果显示,Strain 14与Bacillus solani strain DSS-ERY-4在同一分支,Strain 19与Pseudomonas umsongensis strain JZY5-53在同一分支,且这4株菌株同属于一个簇群中。Strain 16与Pseudomonas sp.strain WR9在同一分支,Strain 7与Lysinibacillusxylanilyticus strain YEBFR4在同一分支,Strain 1与P.frederiksbergensis strain BF5-2在同一分支,其余内生细菌则与P.frederiksbergensis strain PgBE257在同一分支,且这12株内生细菌同属于一个簇群中。根据12株内生细菌16S rRNA基因序列系统发育分析,将Strain 14鉴定为B.solani,Strain 7鉴定为L.xylanilyticus,其他内生细菌均属于假单胞菌属(Pseudomonas),Strain 19鉴定为 P.umsongensis,Strain 1、Strain 2、Strain 4、Strain 5、Strain 6、Strain 12、Strain 15与 Strain 18鉴定为 P.frederiksbergensis,而 Strain 16属于Pseudomonas属菌种。
2.2 内生细菌的促生潜力分析
分别对鉴定的12株苎麻根部内生细菌的溶磷能力、固氮能力和产ACC脱氨酶潜力进行了测定,其相关的促生指标如表2所示。结果显示,不同菌株间的促生潜力差异较大。其中,Strain 18是溶磷能力最强的内生细菌;Strain 12在无氮培养基上的生长最旺盛,具有明显菌斑;Strain 19则是最具有产ACC脱氨酶潜力的菌株。

图1 基于16S rRNA基因序列构建的内生菌株与参考菌株系统进化树Fig.1 Phylogenic tree of endophytic bacteria and reference strains based on 16S rRNA gene sequences
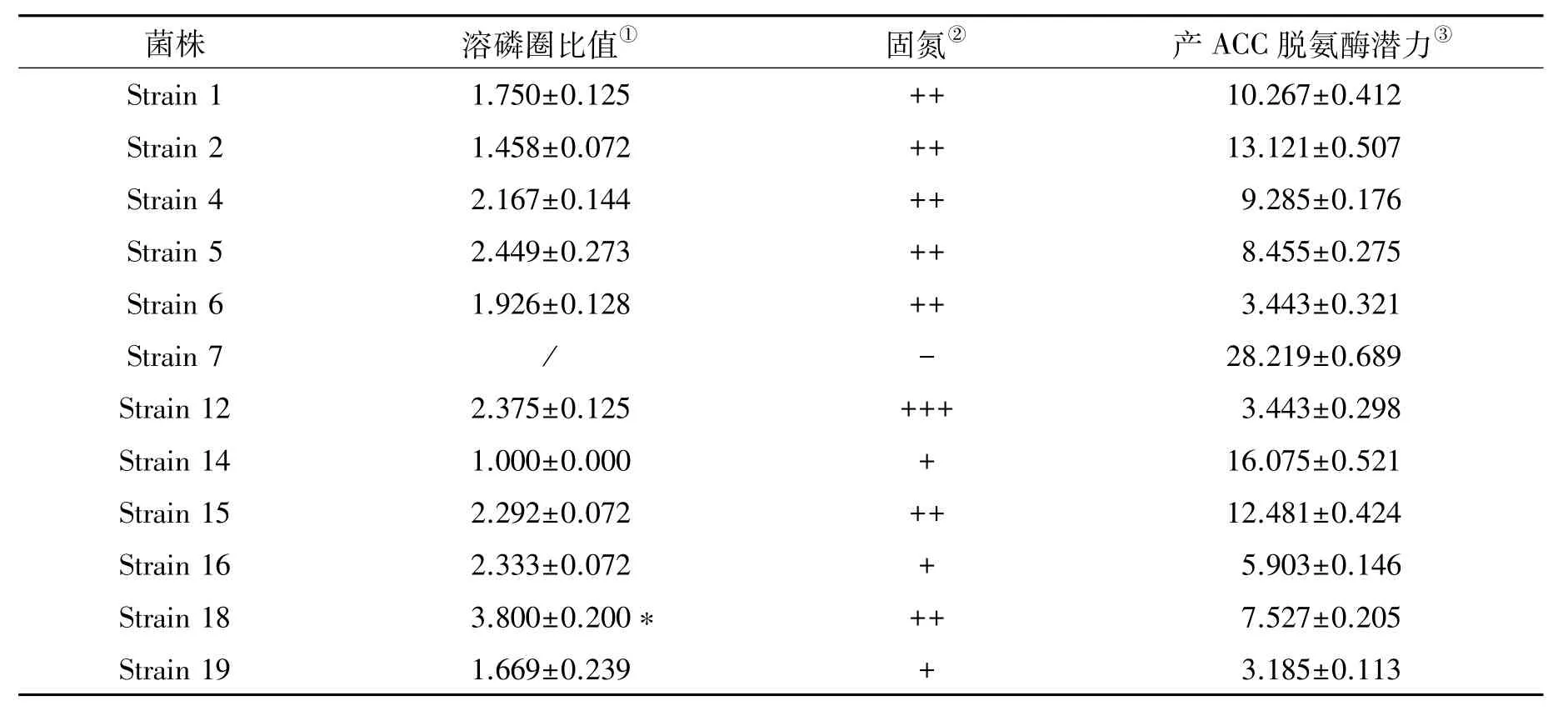
表2 内生细菌的促生指标Table 2 The results of growth-promoting indexes of endophytic bacteria
通过促生试验发现,大部分内生细菌具有溶磷作用,其中溶磷能力最强的菌株为Strain 18,经测量溶磷圈直径与菌落直径比值为3.800,说明该菌株有较强的溶磷能力;Strain 14虽然可在NBRIP无机磷固体培养基生长,但是没有出现明显的溶磷圈,其溶磷圈直径与菌落直径比值为1.000,说明该菌株不具有溶磷的能力;Strain 7在NBRIP无机磷固体培养基不能生长,说明该培养基的营养成分不利于Strain 7的生长(图2)。

图2 内生细菌在NBRIP平板上的生长情况Fig.2 The growth of endophytic bacteria on NBRIP culturemedium
根据内生细菌在无氮培养基上的生长情况差异,对各内生细菌的固氮能力进行评估分级,不同固氮能力级别的细菌生长情况如图3所示。Strain 7不能在无氮培养基上生长,固氮能力级别为“-”,表示没有固氮能力;Strain 14可在无氮培养基上生长,固氮能力级别为“+”,表示具有固氮能力;Strain 18在无氮培养基上生长较好,固氮能力级别为“++”,表示具有较强固氮能力;Strain 12在无氮培养基上生长良好,固氮能力级别为“+++”,表示具有很强固氮能力。12株内生细菌中,仅有1株细菌(Strain 7)在无氮培养基上不能生长,不具有固氮能力,其余11株内生细菌均具有固氮能力(表2)。其中,具有固氮能力的内生细菌有3株(Strain 14、Strain 16与Strain 19),具有较强固氮能力的内生细菌有 7株(Strain 1、Strain2、Strain 4、Strain 5、Strain 6、Strain 15与 Strain 18),最具固氮潜力的内生细菌是Strain 12,该细菌在无氮培养基上的生长情况显著优于其他菌株。

图3 内生细菌在无氮固体培养基上的生长情况Fig.3 The growth of endophytic bacteria on N-freemedium
3 结论与讨论
本研究采用稀释涂布的方法从健康苎麻根中分离到12株内生细菌,内生细菌分别属于假单胞菌属(10株)、赖氨酸芽孢杆菌属(1株)和芽孢杆菌属(1株)三个种属,说明苎麻根部内生细菌的种属丰富度不高,例如,刘鲁峰等[16]从甘蔗的不同组织分离获得的内生细菌和真菌分属于21个属和17个属,显示了丰富的多样性。后续研究中,可采用多种非选择性或选择性培养基相结合的分离方法,同时对苎麻植株的不同组织进行内生菌的分离和纯化,以期获得较多具有种属差异性的内生菌。研究结果表明,假单胞菌在苎麻根内显著富集,是苎麻根部内生细菌的优势菌群。根据现有报道,从苎麻中筛选获得的内生细菌主要属于芽孢杆菌属细菌(Bacillus)[13-15]和伯克霍德菌属(Burkholderia)[17],内生真菌主要属于曲霉属(Aspergillus)[18-19]。本研究初次从苎麻根部分离鉴定到多株假单胞菌属内生细菌,这与其他植物中(如黄芪与高寒草甸优势植物等)根部内生细菌的种属丰富度具有一致性[20-21],说明不同植物的内生细菌具有种属相似性。
对这些内生细菌的促生潜力进行评估,筛选获得具有较强固氮能力的内生菌1株,具有较强溶磷能力的内生菌1株,以及具有产ACC脱氨酶潜力的内生菌1株,且这三株细菌均属于假单胞菌。有趣的是,尽管有8株细菌同属于P.frederiksbergensis,且这些菌株的16S rRNA基因序列与P.frederiksbergensis strain BF5-2的相似性均达到100%,它们的促生潜力却具有较大差异,这说明同一种属的内生细菌的促生潜力存在菌株间的差异,引起菌株间促生潜力差异的机理有待于进一步研究探索。
目前,已从杨树根际土壤和玉米根际土壤中分别分离筛选得到具有良好溶磷能力的P.frederiksbergensis JW-SD2[22]和 P.frederiksbergensis11-D3[23],但具有良好溶磷作用的 P.frederiksbergensis植物内生细菌鲜见报道。本研究中获得的苎麻根部内生细菌P.frederiksbergensis strain 18可直接定植于植株根部,作为菌肥使用时能降低根际土壤复杂微生态环境对其促生性能的影响,更有利于进一步在农业生产上的推广与应用。具有固氮能力和产ACC脱氨酶潜力的内生假单胞菌较为少见,秦宝军等[24]从小麦中新分离一株具有固氮酶活性的假单胞菌属内生细菌,具有产ACC脱氨酶潜力的假单胞菌属内生菌株主要有杜仲内生菌Pseudomonas koreensis JDM-2[25]和人参内生菌Pseudomonas fluorescens JJ8-3[26]等。从苎麻根中分离获得的 P.frederiksbergensis strain 12和 P.umsongensis strain 19,丰富了假单胞菌属中具固氮能力和具产ACC脱氨酶潜力的内生细菌的多样性。
研究[27]表明,植物的内生细菌在发挥促生作用时通常存在协同效应,利用筛选出的优良促生细菌进行合理的组合与复配,开发出多菌剂联合促生的微生物菌肥,可进一步提高内生细菌的促生作用[28]。本研究发现同一种属的不同菌种间,其促生作用与促生潜力具有显著性差异,说明苎麻内生细菌在发挥促生作用时可能具有协同效应,研究该协同效应对于开发复合微生物菌肥具有重要意义。综上所述,本研究从苎麻根部分离获得多株具溶磷能力、固氮能力或产ACC脱氨酶潜力的内生细菌,丰富了植物促生细菌的资源,为进一步研发单一或复合微生物菌肥奠定了基础,具有良好的开发潜力和应用前景。
