Rochow反应中助催化剂氧元素的作用
2020-12-26张政委薛彩龙李节宾张爱华李梦雪
张政委,王 强,薛彩龙,李节宾,张爱华,李梦雪
(1.晋中学院化学化工学系,山西晋中030619;2.中国科学院新疆理化技术研究所,新疆维吾尔族自治区乌鲁木齐830011;3.中国兵器工业第213研究所,陕西西安710061)
有机硅产业最基础的原料甲基氯硅烷主要由Rochow反应合成[1],即硅粉与氯甲烷在铜催化剂作用下反应合成甲基氯硅烷。铜是反应的经典催化剂,甲基氯硅烷是主产物,通常采用添加助催化剂的方法提升主产物的产率或增收副产物。因此,助催化剂被广泛关注。Ehrich等[2]将CsCl和RbCl两种碱金属盐作为Rochow反应的助催化剂,研究发现这两种碱金属盐只对工业级硅粉具催化促进效果;Sun等[3]在超高真空条件下,将甲基自由基和氯原子分别吸附于多晶Cu3Si合金表面,研究发现三甲基硅和SiCl4分别是这两个过程的表面物种,助催化剂Sn,Zn和Al对表面含氯物种的产生具更好的助催化作用。Brookes等[4]研究了Al和Ca在直接法合成氯硅烷中的助催化效果,结果表明:添加助催化剂Al能提升催化剂的活性,也能增强二甲基二氯硅烷的选择性;添加助催化剂CaCl2降低了催化剂的活性,但主产物的选择性不受影响。Lewis等[5]研究了磷对铜催化剂的助催化作用,发现P可促进η-Cu3Si相的形成,也可增强二甲基二氯硅烷的选择性,且铜原子的扩散可促进η-Cu3Si 相表面的更新,但不控制反应速率;Lewis 等[6]以1,4-二氯丁烷和硅为原料、CuCl 为催化剂、Cd 为助催化剂合成二氯环戊硅烷;Luo 等[7]以CuCl 为Rochow 反应催化剂,研究发现硅表面高度分散的Cu—Si 活性中心起到催化作用。Gordon 等[8]比较分析了Sn 和P 两种助催化剂对Rochow 反应的影响,发现Sn助催化剂能增加表面反应过程中甲基的浓度,提升硅烷合成速率;P则能促进表面反应过程中甲基分裂。Wang等[9]研究了Zn和Sn的助催化效果,结果表明Zn促进Cu3Si相的生成,Sn加速Cu3Si相的消耗;文献[10-14]中研究了系列含O催化剂的性质,如部分还原的CuO超微颗粒、CuO-CeO2和Cu-O-Sn超薄片等,结果表明O赋予催化剂一些特殊性质,可提高催化活性。
本课题组[15]研究了Rochow反应中Cu和Cl的催化作用,认为硅表面存在的电偶极子诱使CH3Cl分子中C—Cl 键极化并断裂,即硅表面的Cuδ-—Siδ+电偶极子只是触发Rochow 反应,Siδ+—Clδ-电偶极子才是Rochow反应的主要催化活性中心。Al,Zn和Sn等助催化剂均处于实验研究阶段,工业生产中应用成熟的助催化剂是O元素,特别在商品化的Rochow反应催化剂中,铜的氧化物含量高,可高效促进反应。但O元素的助催化机理未被细致阐明,因此在本课题组提出“极化”观点[15]的基础上,以第一性原理为工具,进一步研究O元素的助催化机制。
1 模型和计算方法
硅粉的X 射线粉末衍射谱图中,(111)晶面是优势暴露面。文中将Si(111)晶面作为研究Rochow反应表面过程的基本模型。模型厚度为5层Si原子,具2 nm的真空层厚度。计算过程中固定最下方3层Si原子的坐标,允许最上方2层Si原子、吸附于表面的催化剂和表面反应的CH3Cl分子发生弛豫。O助催化剂通常以CuO或Cu2O[11]的形式加入铜催化剂中,文中O元素以与铜物种键合的方式加入主催化剂铜中。构建的12种模型分别对应于Si(111)面可能存在的具不同分散程度及不同氧含量的12种催化剂(依次为Cu,CuO,Cu2O,Cu4,OU-Cu4,OD-Cu4,Cu10,OU-Cu10,OD-Cu10,Cu20,OU-Cu20和OD-Cu20)。含4,10,20 个Cu 原子的正四面体结构稳定,故未采用含其他数目Cu原子的团簇结构。将12种催化剂分别随机放置于Si(111)面,如图1。
采用基于密度泛函理论的第一性原理方法中的DMol3程序(Materials Studio软件包)计算模拟CH3Cl分子在不同催化剂Si(111)表面的催化反应过程。采用广义梯度近似(generalized gradient approximation,GGA)中的PW91[16-17]泛函描述电子交换关联作用,基组采用双数值加极化[18](dynamic nuclear polarization,DNP)。用Grimme提出的色散修正密度泛函理论(dispersioncorrected density functional theory,DFT-D)的方法[19]校正范德华力,采用超软赝势描述Si,Cu,O,C,H 和Cl 的电子,通过Mulliken 电荷分析[20]、态密度分析(density of state,DOS)等方法分析电子结构。
2 结果与讨论
2.1 催化剂在Si(111)面的吸附
催化剂在Si(111)面上的吸附能Eads和平均吸附能Emean按如下公式计算:

式中:Hcat/Si为硅表面吸附催化剂时的焓;Hcat为催化剂的焓;HSi为硅表面的焓;n 为催化剂中直接与硅表面键接的原子数。
Cu,CuO和Cu2O 3种催化剂吸附于硅表面的模型如图1。催化剂在Si(111)面上的吸附能如表1。由表1可看出,Cu,CuO和Cu2O的吸附能Eads依次增大,分别为330,383,530 eV,n 依次为1,2,3,对应的平均吸附能Emean依次为330,191,177 eV。Si—Cu 键的电荷分布如表2。由表2和图1(b)和(c)可知,O原子具足够大的电负性,与之键接的Cu和Si原子均带正电荷,导致Cu和Si原子间的库仑斥力增大,间接表现为O原子的加入降低了CuO和Cu2O的平均吸附能。
用四面体团簇Cu4,Cu10和Cu20模拟未高度分散的铜催化剂,分别对应图1(d)~(f)。由表1 知,Cu4,OU-Cu4,OD-Cu43 种催化剂的吸附能Eads依次是371,326,332 eV,n 依次为3,3,4,平均吸附能Emean依次为124,109,83 eV。在OU-Cu4和OD-Cu4中,高电负性的O 原子吸引催化剂与硅表面接界处Cu 和Si 上的电子,致使接界处原子带正电(表2 和图1(e)和(f)),接界处库仑斥力仍较大,平均吸附能降低。

图1 12种催化剂中Si—Cu键的电子密度及电荷分布Fig.1 Electron density and charge distribution of Si—Cu bond in catalysts

表1 催化剂在Si(111)面上的吸附能Tab.1 Adsorption energy of catalysts on Si(111)surface
与Cu4,OU-Cu4和OD-Cu4模 型 类 似,含10 个Cu 原子的3 种催化剂团簇与硅表面结合的模型Cu10,OU-Cu10和OD-Cu10分别如图1(g)~(i)。由表1知,这3 种催化剂的吸附能Eads依次为334,334,338 eV,其n 依次为6,6,7,平均吸附能Emean依次为56,56,48 eV,3种催化剂的吸附能很接近。原因是铜团簇尺寸增大,即使O 原子具大电负性,也较难在长程范围内影响催化剂与硅表面接界处原子的电荷(表2和图1(g)~(i))。对于OD-Cu10模型,因O原子键接于催化剂与硅表面的接界处,致使此处的Cu和Si原子带正电荷(图1(h)),接界处的库仑斥力增加,故其平均吸附能Emean较前两者小。
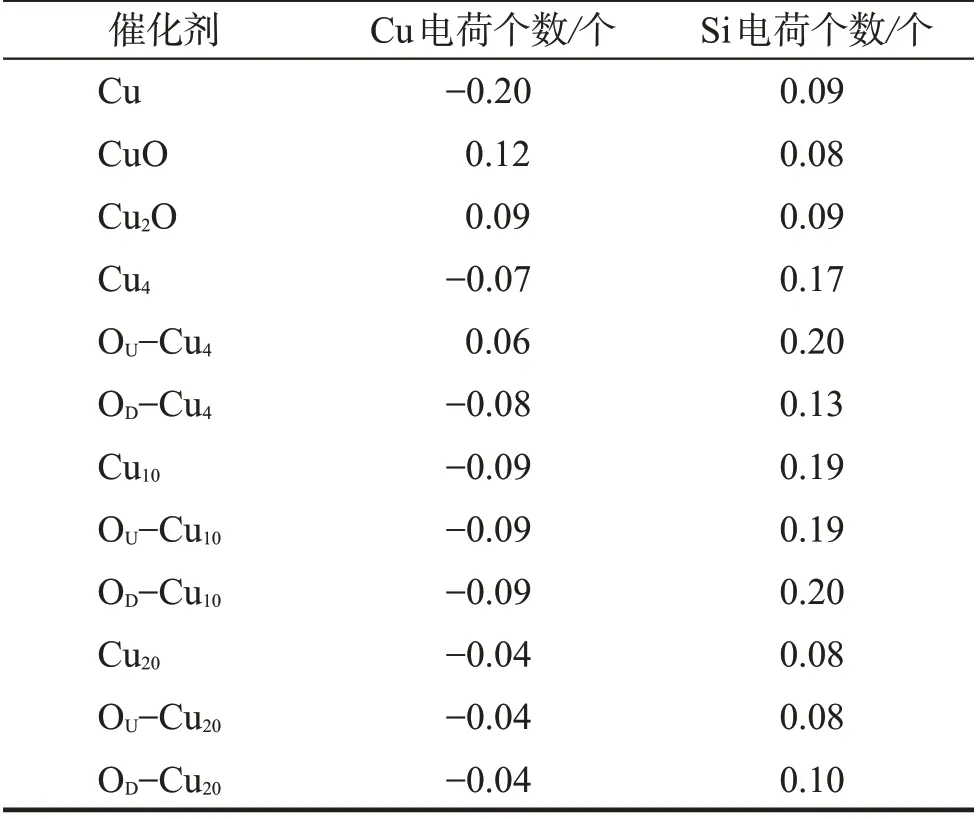
表2 Si—Cu 键的电荷分布Tab.2 Charge distribution of Si—Cu bond
含20 个Cu 原子的3 种催化剂团簇与硅表面结合的模型Cu20,OU-Cu20和OD-Cu20分别如图1(j)~(l)。由表1知,这3种催化剂的吸附能Eads依次为345,345,349 eV,n依次为10,10,11,对应的平均吸附能Emean依次为34,34,12 eV。其吸附能及平均吸附能的变化原因与含10 个Cu 原子团簇的相同,即O 原子很难影响大铜团簇的电子性质。含4 个Cu 原子以下的铜催化剂团簇尺寸较小,O 原子可显著影响其吸附性能;含4 个Cu 原子以上的铜催化剂团簇(如10 个和20 个Cu 原子的催化剂团簇)尺寸较大,O 原子很难影响其吸附性能。
2.2 C—Cl键在电偶极上断裂的热力学

表3 C—Cl在3种键上断裂反应的吉布斯自由能变负值Tab.3 Negative values of Gibbs free energy of cleavage reaction of C—Cl on three bonds


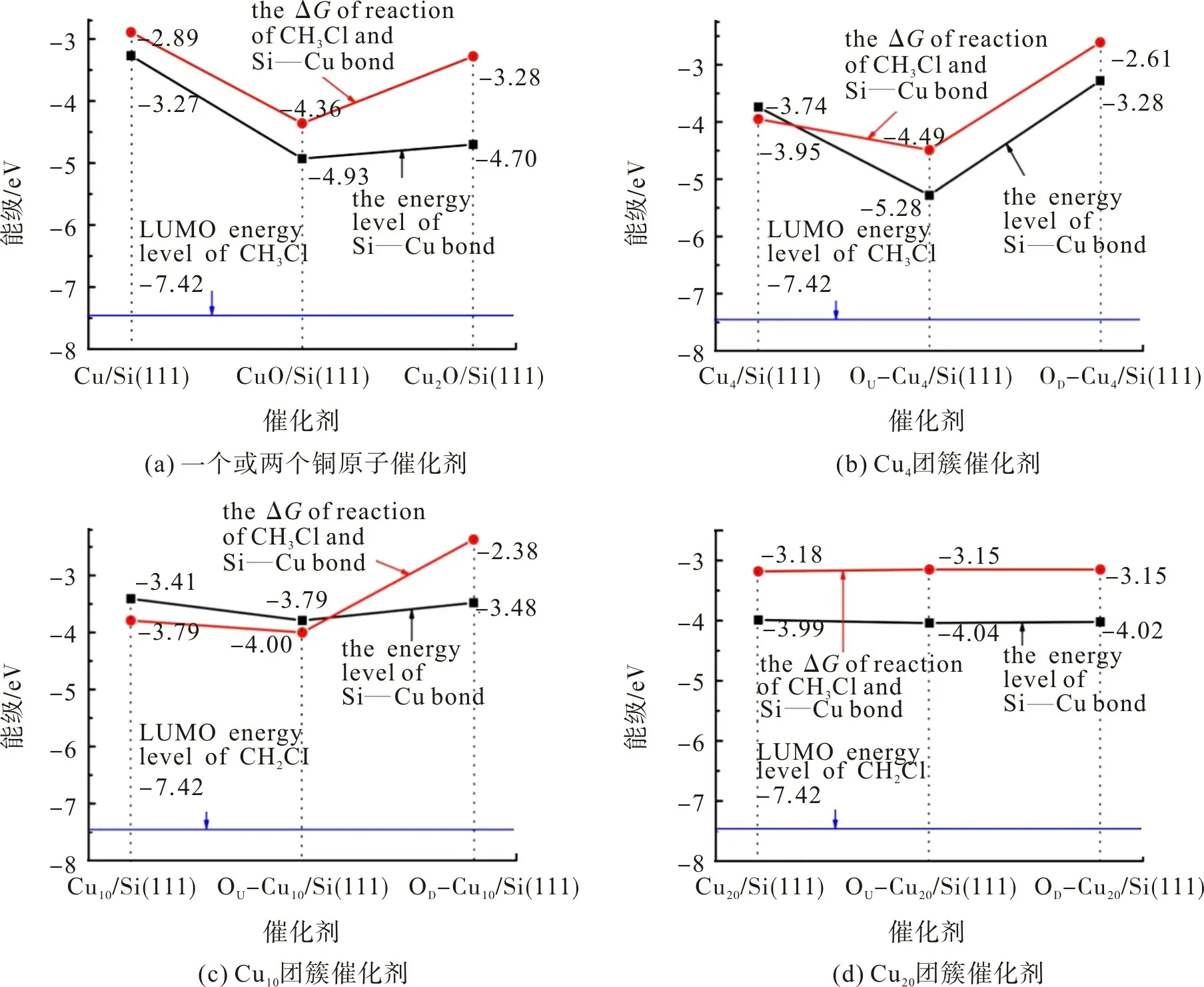
图2 反应的自由能变ΔG与能级差ΔE的对应关系Fig.2 Correlation of ΔG and energy difference ΔE
2.3 催化中心的电子性质

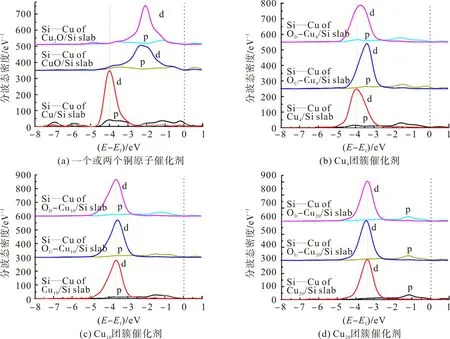
图3 Si—Cu键的d和p电子轨道分波态密度Fig.3 PDOS of d and p orbits of Si—Cu bond
3 结 论
1)将助催化剂O加入至Rochow反应的催化剂铜中,可同时与Si和Cu键合,有利于提高CuO和Cu2O物种在硅表面的结合能,但O元素具较高的电负性,可同时导致接界处Si和Cu原子带正电,库仑斥力增大,平均吸附能降低。Cu4团簇尺寸较小,O原子可影响其与硅接触面处的接界原子,导致接界处库仑斥力增大,团簇的吸附能降低。Cu10和Cu20团簇的尺寸较大,O原子在团簇上键接很难影响团簇与硅界面处的接界原子,因此O键接前后这两种团簇的吸附能基本不变。

