新型医用镁合金微弧氧化膜层制备及性能评价
2020-12-26肖鹏冯坤孙瑞罗亚鸽谢文成彦郭智萍
肖鹏,冯坤,孙瑞,罗亚鸽,谢文,成彦,郭智萍
新型医用镁合金微弧氧化膜层制备及性能评价
肖鹏,冯坤,孙瑞,罗亚鸽,谢文,成彦,郭智萍
(河南省正骨研究院,河南 洛阳 471002)
采用一种新型Mg-Zn-Y-Nd-Zr镁合金为材料,以双脉冲,正电压285 V,反电压﹣60 V,总频率700 Hz,总占空比15%,40 min,30 ℃的微弧氧化工艺条件制备膜层,通过XRD进行成分分析,用电镜及能谱分析膜层表面特征。通过膜层表面粗糙度、粘结强度、附着力、显微硬度等检测评价膜层机械性能,通过点滴试验和析氢试验检测膜层耐腐蚀性并进行评价。结果表明,该工艺制备的微弧氧化膜层主要成分是MgO,其增大了镁合金基体的粗糙度,提升了表明硬度和耐腐蚀性能,并且其粘结强度也满足骨科材料国内标准要求,为进一步优化膜层制备提供了研究基础。
镁合金;微弧氧化;膜层表面;机械性能
1 引言
镁合金作为骨科医用可降解材料,具有弹性模量近似于骨、毒副作用小、加工性能良好等优点,但降解过快、降解产氢等问题是限制医用镁合金的应用的主要原因[1]。解决这些问题的方法主要有两个,一个是改良合金成分,另一个是处理合金表面[2]。在合金成分改良方面,含稀土元素的WE系列镁合金在生物降解性能方面表现出了较好的耐降解性能[3-4]。其中,WE43的改良型MgYREZr合金已经被Syntellix公司作为镁合金骨螺钉应用于治疗踇外翻的临床试验,并且获得了与同类钛骨钉等同的治疗效果[5]。根据谭丽丽等[6]的研究结果,MgYREZr镁合金骨钉临床用有局限性,控制其螺钉的降解速率是拓展临床应用范围的主要问题。因此,结合表面处理工艺进一步优化提升医用镁合金性能,拓展其临床应用范围的研究具有重大意义。
微弧氧化(micro-arc oxidation,MAO)是镁合金表面处理的重要工艺方法[2],其处理后的镁合金表面具有硬度高、耐磨性好、耐腐蚀性强等优点[7]。本研究前期工作已制备出一种改良型Mg-Zn-Y-Nd-Zr镁合金,其有良好的生物相容性和力学性能[8],但该镁合金降解性能仍然不能满足骨科医用的需求。因此,本文以Mg-Zn-Y-Nd-Zr镁合金作为基体,优化出一种磷酸盐体系的微弧氧化表面处理工艺,并对得到的镁合金微弧氧化膜层进行性能检测,为Mg-Zn-Y-Nd-Zr镁合金应用于骨科临床提供研究基础。
2 实验
2.1 膜层制备
试样采用挤压态ZR镁合金(Mg-Zn-Y-Nd-Zr专利号CN201310418031.4),基体车加工成φ9.6 mm×10 mm的柱形,再用砂纸干磨至1 000目,依次放入丙酮和无水乙醇中各超声10 min,置于滤纸上室温晾干后用于制备微弧氧化膜层。膜层制备采用上海翼昇电子科技有限公司生产的YS9000DB型微弧氧化电源,搅拌、温控、电解槽和电极等装置根据生产线自主设计。阴极采用不锈钢材料,电解液为磷酸盐电解液体系。主要成分为54 g/L的磷酸三钠,添加剂为2 g/L的氢氧化钠和0.8%的甘油。微弧氧化工艺条件采用双脉冲,285 V,700 Hz,占空比15%,40 min,30 ℃。微弧氧化结束后用蒸馏水冲洗试样,冷风吹干用于后续试验。
2.2 膜层形貌分析与成分检测
采用日本电子公司的场发射电子显微镜对膜层试样表面进行观察并拍照。用Image J软件对电镜图片进行分析,获得膜层孔隙率和孔径。取带膜层试样3个,用1 000目砂纸将圆柱侧面磨去约2 mm,再用2 000目砂纸打磨缺口面,置于200倍光学显微镜下观察并测量膜层厚度。观察和测量时采用莱卡公司的DM2700P型金相显微镜。采用Bruker D8 ADVANCE X射线衍射仪对膜层进行相组成分析。
2.3 膜层机械性能检测
膜层粘结强度试验按照YY/T 0988.11—2016中要求进行。试样夹具根据试样尺寸参照GB 23101.4—2008设计制作。试验设备采用岛津公司的10 kN型万能材料试验机,粘结剂采用3M公司的SCOTCH-WELD 2214-NMF结构胶。取4个带膜层试样用于粘接强度试验。参照GB/T 10610—2009检测微弧氧化工艺前后试样粗糙度,检测设备采用北京赛博瑞鑫科技有限公司生产的TRX180型粗糙度仪。取试样固定与工作台上,φ9.6 mm圆形面为检测面。仪器设置取样长度为0.8 mm,取样次数为5,根据国标记录Ra、Rz、Rmax、Rsm值。用兰州中科凯华科技开发有限公司的WS-2005型膜层附着力划痕仪检测膜层结合力。用上海泰明光学仪器有限公司的HXD-1000型显微硬度计检测膜层表面硬度,记录HV值。
2.4 膜层耐腐蚀性能评价
通过析氢试验观测试样在模拟体液[9]中的析氢量。无膜层和带膜层试样各取3个,用硅胶管和硅胶包埋试样,留出φ9.6 mm圆面,放入37 ℃模拟体液中,安装析氢装置收集氢气,每天记录产氢量,并计算产氢速率。通过点滴腐蚀试验检测膜层耐蚀性。取无膜层和带膜层试样各3个,用硅胶管包埋,留出φ9.6 mm圆面,滴加60 μL点滴试剂(高锰酸钾0.05 g/L,硝酸5%),记录反应时间。
3 结果与讨论
从XRD的图谱(如图1所示)可以看到微弧氧化膜层的主要成分是MgO,同时也可见基体Mg的衍射峰。EDS分析结果显示(如图2所示)膜层元素主要是Mg、O元素。从微弧氧化膜层在500倍扫描电镜下的表面形貌,可以看到不均匀的孔和膜层裂纹。观察1 000倍下膜层横截面可以看到厚度不均匀并且中间空隙较大。微弧氧化层表面500倍电镜图像和截面100倍电镜图像如图3所示。

图1 微弧氧化层表面XRD图谱

图2 微弧氧化层表面EDS分析结果

图3 微弧氧化层表面500倍电镜图像和截面100倍电镜图像
本实验采用磷酸三钠为主要电解液成分,XRD检测结果显示所得微弧氧化层的主要成分为MgO。根据文献报 道[10-11],磷酸体系微弧氧化Mg-Zn-Zr合金和Mg-Zn-Ca合金,所得膜层成分为Mg3(PO3)2和MgO。本文XRD结果未检测到Mg3(PO3)2,这是否与试验所用镁合金材料和工艺不用有关,需要进一步研究。
通过Image J软件分析微弧氧化膜层的500倍电镜扫描图像,计算出膜层的孔隙率为10.39%,孔径为1.689 μm。通过金相显微镜200倍下观测膜层界面,并测量膜层厚度为15.52 μm。微弧氧化层的孔隙率、孔径、厚度等主要反映了膜层与基体间的结合程度和致密性[12],其受到电压、频率和占空比等工艺条件的影响[13-16]。本文采用的镁合金材料和微弧氧化工艺条件未见有相同研究报道,因此这些结果在此不做讨论。
粘结强度检测结果如图4所示,该工艺产生的微弧氧化膜层的粘结强度大约在25~40 MPa之间,检测结果均值为36.36 MPa。按照国标中要求的医用植入物表面涂层粘结强度应不小于15 MPa。作为医用材料,本文中工艺制备的镁合金微弧氧化膜层完全满足国家标准要求。

图4 相同工艺试样粘结强度检测结果
粘结强度检测试验前和试验后样品表面图像如图5 所示。由图5可以明显看出试验前后微弧氧化膜层大面积剥落,但并没有露出镁基体,说明膜层并没有完全被剥落,在镁合金基体上依然存在一层微弧氧化膜。

图5 粘结强度检测试验前和试验后样品表面图像
划痕测试可以有效评价镁合金微弧氧化材料作为骨螺钉植入时膜层的抗剥脱性能。采用划痕电导法检测微弧氧化膜层的附着力结果,如图6所示,整个膜层附着力在2.8~5.85 N之间,平均值为3.91 N。检测后膜层表面拍照观察可以明显看出划痕力最大位点对应的划痕明显比其他划痕短,说明该工艺条件下检测面膜层附着力不均一。划痕仪检测后膜层表面划痕图像如图7所示。
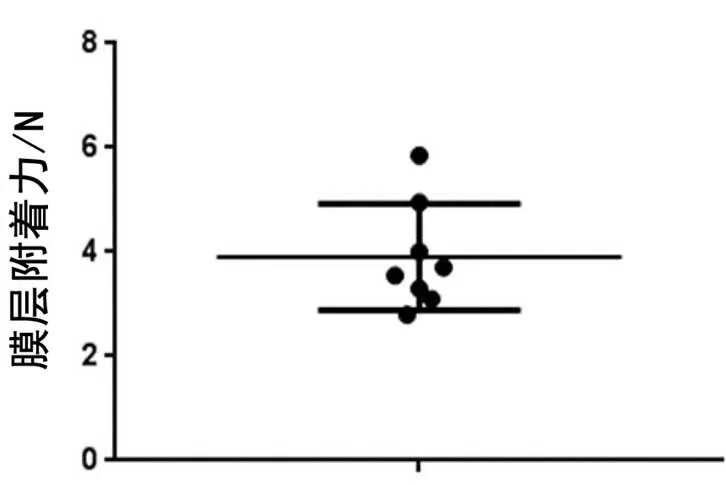
图6 微弧氧化膜层附着力的检测结果

图7 划痕仪检测后膜层表面划痕图像
微弧氧化工艺前后样品粗糙度结果如表1所示,通过粗糙度Ra、Rz、Rmax、Rsm值可以看出,微弧氧化后样品表面粗糙度增大了3~5倍。微弧氧化后镁合金基体表形成了特有的孔状结构,其粗糙度必然增大。国家及行业标准中未对表面特殊处理的骨植入材料表面粗糙度做具体要求。但从生物学角度考虑,多孔的微弧氧化膜层虽然增大了粗糙度,但其对细胞粘附及生长可能是有利的。
表1 镁合基体及微弧氧化膜层表面粗糙度检测结果
Ra/μmRz/μmRmax/μmRsm/mm 镁合金基体0.4963.8785.0920.024 微弧氧化膜1.83016.08623.0110.066
镁合金基体与微弧氧化后表面显微硬度HV值如图8所示。显微硬度检测结果显示,镁合金基体的表面硬度HV平均值为89.8。标准YY 0018—2016中规定了不锈钢骨钉材料硬度HV值不小于210,钛合金不小于260。镁合金经过微弧氧化处理后的表面硬度在214.1~871.3之间,这使镁合金表面硬度性能满足了不锈钢和钛合金的标准要求。但该工艺产生的微弧氧化膜层硬度不均,差异较大。

图8 镁合金基体与微弧氧化后表面显微硬度HV值
微弧氧化膜层的耐腐蚀性能通过点滴试验和析氢试验的结果评价。点滴反应试验结果如图9所示。从镁合金基体和微弧氧化膜层镁合金的点滴反应时间,可以看出微弧氧化处理后使镁合金的点滴反应时间增加了27倍。这一结果与LIU等[17]研究结果一致,其用99.95%的纯镁做微弧氧化处理并进行了点滴试验,随着微弧氧化时间的增加,点滴时间最高增大了40倍。点滴试验可评价膜层的耐化学腐蚀性能,因此该工艺制备的微弧氧化膜层有效提升了镁合金基体的抗化学腐蚀性能。
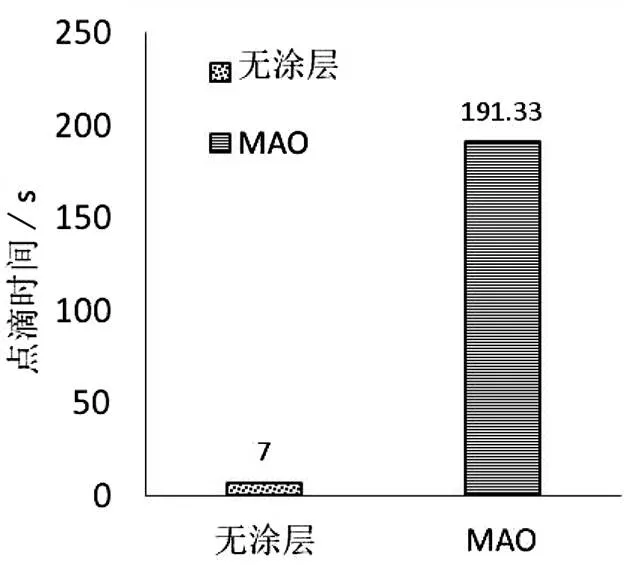
图9 点滴反应试验结果
从无膜层和带膜层的镁合金试样在SBF中浸泡8 d的产氢速率可以看出,微弧氧化处理后的析氢速率减小了79%。从8 d的产氢量可以看出微弧氧化处理后的镁合金的每天产氢量比镁合金基体更少,产氢量维持在较低水平。这与LIU等[17]用纯镁做微弧氧化处理后的析氢试验结果一致。浸泡降解试验模拟了试样在生物体内的降解情况,结果说明该工艺制备的微弧氧化膜层能有效降低材料的降解速率。无膜层镁合金和微弧氧化膜层镁合金在SBF中浸泡8 d的平均析氢率如图10所示。
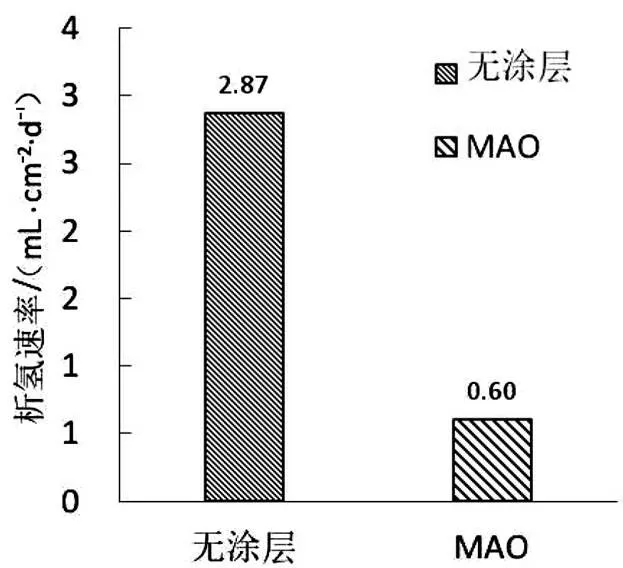
图10 无膜层镁合金和微弧氧化膜层镁合金在SBF中浸泡8 d的
平均析氢率
无膜层镁合金和微弧氧化膜层镁合金在SBF中浸泡8 d的产氢量如图11所示。图11分析了试样每天的产氢量,由此可以看出微弧氧化膜层降低了镁合金降解速率,其析氢量也相对镁基体较平稳,延长了材料的降解周期,满足骨科植入物的要求。
4 结论
以Mg-Zn-Y-Nd-Zr镁合金作为基体材料,通过双脉冲,285 V,700 Hz,占空比15%,40 min,30 ℃的微弧氧化工艺条件制备膜层。经检测膜层有效提升了镁合金基体机械性能和耐腐蚀性能。可在此工艺基础上结合生物学评价进一步优化膜层质量,使其更加适用临床需求。

图11 无膜层镁合金和微弧氧化膜层镁合金在SBF中浸泡8 d的产氢量
[1]DOU J,CHEN Y,YU H,et al.Research status of magnesium alloys by micro-arc oxidation: a review[J].Surface Engineering,2017,33(10):731-738.
[2]郭兴伍,郭嘉成,章志铖,等.镁合金材料表面处理技术研究新动态[J].表面技术,2017,46(3):53-65.
[3]JIN W,WU G,FENG H,et al.Improvement of corrosion resistance and biocompatibility of rare-earth WE43 magnesium alloy by neodymium self-ion implantation[J].Corrosion Science,2015(94):142-155.
[4]LIN Z,ZHAO Y,WONG H M,et al.Improvement of corrosion resistance and biocompatibility of WE43 magnesium alloy treated by titanium and oxygen dual plasma implantation[C]//Symposium on Biodegradable Metals,2016.
[5]WINDHAGEN H,RADTKE K,WEIZBAUER A,et al.Biodegradable magnesium-based screw clinically equivalent to titanium screw in hallux valgus surgery: short term results of the first prospective, randomized, controlled clinical pilot study[J].Biomed Eng Online,2013(12):62.
[6]谭丽丽,陈军修,于晓明,等.生物可降解MgYREZr合金的研究进展[J].金属学报,2017,53(10):1207-1214.
[7]TAO H,HO S K,LI E,et al.Modification of mg alloy surfaces based on micro-arc oxidation methods[C]//Advanced Materials Research. Trans Tech Publications,2014(905):146-150.
[8]SONG X,CHANG L,WANG J,et al.Investigation on the in vitro cytocompatibility of Mg-Zn-Y-Nd-Zr alloys as degradable orthopaedic implant materials[J].Journal of Materials Science:Materials in Medicine,2018,29(4):44.
[9]KOKUBO T,TAKADMA H.How useful is SBF in predicting in vivo bone bioactivity?[J]. Biomaterials,2006,27(15):2907-2915.
[10]PAN Y K,CHEN C Z,WANG D G,et al.Effects of phosphates on microstructure and bioactivity of micro-arc oxidized calcium phosphate coatings on Mg–Zn–Zr magnesium alloy[J].Colloids and Surfaces B:Biointerfaces,2013(109):1-9.
[11]CHEN S,GUAN S,LI W,et al.In vivo degradation and bone response of a composite coating on Mg–Zn–Ca alloy prepared by microarc oxidation and electrochemical deposition[J].Journal of Biomedical Materials Research Part B:Applied Biomaterials,2012,100(2):533-543.
[12]WEN Q,CAO F H,SHI Y Y,et al.The effect of phosphate on MAO of AZ91D magnesium using AC power source[J].Materials and Corrosion,2008,59(10):819-824.
[13]宾远红,刘英,李培芬.频率和占空比对镁合金微弧氧化的影响[J].科学技术与工程,2011,11(31):7640-7643.
[14]TANG Y,ZHAO X,JIANG K,et al.The influences of duty cycle on the bonding strength of AZ31B magnesium alloy by microarc oxidation treatment[J].Surface and Coatings Technology,2010,205(6):1789-1792.
[15]BIN Z O U,LÜ G,ZHANG G,et al.Effect of current frequency on properties of coating formed by microarc oxidation on AZ91D magnesium alloy[J].Transactions of Nonferrous Metals Society of China,2015,25(5):1500-1505.
[16]LIN X,TAN L,ZHANG Q,et al.The in vitro degradation process and biocompatibility of a ZK60 magnesium alloy with a forsterite-containing micro-arc oxidation coating[J].Acta Biomaterialia,2013,9(10):8631-8642.
[17]LIU G Y,HU J,DING Z K,et al.Bioactive calcium phosphate coating formed on micro-arc oxidized magnesium by chemical deposition[J].Applied Surface Science,2011,257(6):2051-2057.
2095-6835(2020)24-0001-04
TG174.4
A
10.15913/j.cnki.kjycx.2020.24.001
肖鹏(1986—),男,硕士研究生,研究中心职员,助理研究员,研究方向为生物材料与生物力学。
〔编辑:严丽琴〕
