1-烷基-3-甲基咪唑氯化物焓变的热重分析
2020-12-25刘璐徐玉萍陈霞洪梅佟静
刘璐,徐玉萍,陈霞,洪梅,佟静
辽宁大学化学院,沈阳 110036
1 引言
离子液体是由体积较大的有机阳离子和无机或有机阴离子组成的离子型化合物。其中阴阳离子的体积极其不对称导致该离子型化合物晶格能较低,因而离子液体具有较低的熔点,在室温下呈现液态。离子液体作为绿色溶剂的替代品,其在分离、均相催化、蒸馏过程或作为溶剂的工业化应用中引起了广泛关注。离子液体极低的蒸气压和热稳定性同样是重要的性能1-6。例如,在纤维染色中,染料从固相转变为气相。在这个过程中,高挥发性染料更有利于纤维的着色,但反过来,容易粘附在纤维上的染料可能会在产品使用寿命期间再次蒸发,从而导致染料质量发生损失7。因此,有必要知道与蒸发和热分解有关的最大允许操作温度。然而,对于高沸点液体最大允许操作温度难以测量,并且还必须考虑它们是否同时经历蒸发和热分解。测量蒸气压的方法有多种,例如,直接使用压力计测量8,运用光谱法9检测挥发性物质的气相浓度,Knudsen的真空渗出法10或蒸腾作用法11,12以及在可控压力下的沸点测定法13,14。Gückel等人15-18应用恒温热重法测定农药在常压下的蒸发速率。由于升华和蒸发是零级过程,样品在恒温状况下,确保自由表面积不变那么由于蒸发造成的质量损失率应该是常数。由此建立一定温度范围内标准物质的蒸气压和单位面积的质量损失率之间的关系并用该经验方法估算其它物质蒸气压。Elder19运用热重方法测量制药类化合物的蒸气压,该方法还被用来研究香水成分、药物的蒸发特性以及它们之间的相互作用20-23。前期工作24-27研究了氨基酸咪唑系列[Cnmim]Thr (n= 2-6)和羧酸咪唑系列[Cnmim]Pro(n= 2-6)离子液体的热力学性质,这两类离子液体的共同点是卤素咪唑系列[Cnmim]X (n= 2-6, X =Cl, Br)中间体通过阴离子交换树脂转化为氢氧型咪唑系列[Cnmim]OH (n= 2-6)中间体,然后加入相应的酸(苏氨酸或丙酸)生成的。由于卤素咪唑系列中间体同样具有较高的热稳定性,因此本文运用热重分析法研究含氯咪唑系列[Cnmim]Cl (n=2, 4, 6)中间体在恒温条件下的热蒸发行为,进一步研究烷基咪唑类离子液体体系的热力学性质,探讨结构差异所带来的影响。在热分析领域,热重法已被认为是一种快速、有效、可靠的技术,可以用于检测物质的蒸发过程,尤其是用于确定蒸气压曲线和挥发性化合物的蒸发焓28。蒸发是物质在不改变其化学成分的情况下从液体变为气体。该过程受许多因素的影响,包括蒸气压、分子量、温度和裸露表面的大小。该过程的焓是可以计算的,它是建立在分子在液体表面拥有足够大的动能来克服分子间的相互吸引力并且随着温度的升高逸入气相的。其中为抵消逸出分子带来的冷却效应而提供的能量就是过程的焓29。
热重分析(TGA)仪器的天平是高度灵敏的,但是它也可能受到系统误差的影响,这些误差是由于热漂移或气体流速的波动而引起的。因此,优化测量条件以尽量减少干扰至关重要。影响TGA准确测量蒸发焓的重要参数包括:(1)质量损失:质量损失的下限由特定TGA仪器的长期稳定性决定。质量损失的上限受坩埚内部表面积上的质量变化以及汽化表面与气流之间的距离的影响。在每个等温段,质量损失范围为0.2 mg至0.8 mg,并且可以在1 J·mol-1的范围内重现固定的蒸发焓。当质量损失大于1 mg时,蒸发焓较高;(2)恒温段的持续时间:影响准确测量质量损失的另一个重要因素是开始时的温度稳定时间。此因素对于每个TGA仪器的影响都是不同的。对于高温恒温温度段尤其重要,由于蒸发速率较高,通常会将实验时间缩短到最短(通常10 min即可蒸发0.2-0.8 mg样品)。因此,每次实验时间必须考虑到温度稳定时间;(3)温度范围:TGA研究的温度范围越大,实验结果越好。最佳温度范围至少为60 K,温度极限取决于所研究样品的挥发性和稳定性;(4)净化气体流速:如果流速过低,样品上方气相的饱和度可能会加剧质量转移。如果流速过高,液体样品的表面会暴露在气流中,难以维持样品的恒定温度状态。因此,实验过程采用Verevkin等人30提出的最优热重实验条件。
本文通过核磁共振氢谱(1H NMR)和核磁共振碳谱(13C NMR)表征1-烷基-3-甲基咪唑氯化物离子液体(1-乙基-3-甲基咪唑氯化物离子液体,1-丁基-3-甲基咪唑氯化物离子液体和1-己基-3-甲基咪唑氯化物离子液体)的结构。运用热重分析仪器对该系列物质进行动态热重实验和恒温热重实验。然后根据实验数据,计算了这三种物质在平均温度下的蒸发焓。为了便于同其他文献值进行比较,进行了进一步的转化,以获得环境温度下的蒸发焓。最后通过一系列计算,预测得到1-辛基-3-甲基咪唑氯化物离子液体的蒸发焓值,并且与文献值进行对比,发现在同一数量级。结合前期工作的实验结果得出,保持离子液体阳离子不变时,阴离子的变换会对蒸发焓产生一定的影响,这可能与分子间氢键有关。
2 实验部分
2.1 化学试剂
实验所需实验材料[Cnmim]Cl (n= 2, 4, 6) (纯度:99%)是从兰州化学物理研究所购买的。样品的纯化方法是溶剂洗脱。为了便于观察,表1中给出了关于样品材料纯度和来源的详细信息。
2.2 表征
为了提高实验数据的可靠性,避免微量水对实验结果的影响,在进行NMR和热重实验前,将样品在60 °C真空条件下干燥72 h,并用上海市安亭电子仪器厂生产的ZSD-2型卡尔费休水分滴定仪测定三种实验样品的水含量分别为0.00536 ±0.0001、0.00540 ± 0.0001、0.00527 ± 0.0001。三种实验样品分别通过美国瓦里安公司生产的瓦里安xl-300核磁谱仪进行1H NMR和13C NMR表征。谱图见Supporting Information图S1-S6。为了描述方便,对化合物中不同的氢和碳作出标记。使用瑞士制造的梅特勒-托利多TGA/SDTA851e仪器对三种实验样品分别进行动态热重实验和恒温热重实验。首先,根据Stewart的方法31使用铟,锡,铋和铅对TGA仪器的温度进行校准,将温度测量的精度调整为±0.2 K,并用标准毫克质量检查平衡响应的大小和线性。动态热重实验条件如下:氩气作为吹扫气体,加热速率10 K·min-1,气体流速50 mL·min-1,实验的温度范围298.15-673.15 K。实验样品的质量约10 mg,使用的参比坩埚和样品坩埚均为铂金圆柱形坩埚。坩埚的直径为6 mm,坩埚的深度为4 mm。在Supporting Information图S7-S9中给出了三种样品的动态热重分析曲线。恒温热重实验条件不同于动态热重实验条件:氩气作为吹扫气体,加热速率10 K·min-1,气体流速100 mL·min-1,实验温度范围298.15-503.15 K,其中T= 393.15 K时恒温30 min,除去样品中的微量水,样品质量50 mg左右,实验中使用的坩埚为同一坩埚。随后收集三个样品蒸发后的残留物,并再次对其进行1H NMR表征和动态热重实验,结果显示出与原始样品相似的质子化学位移和质量损失行为。因此,观察到的质量损失不是由于分解而是由于蒸发造成的。获得的结果已经展示在Supporting Information的图S1b-S3b和图S7b-S9b中。
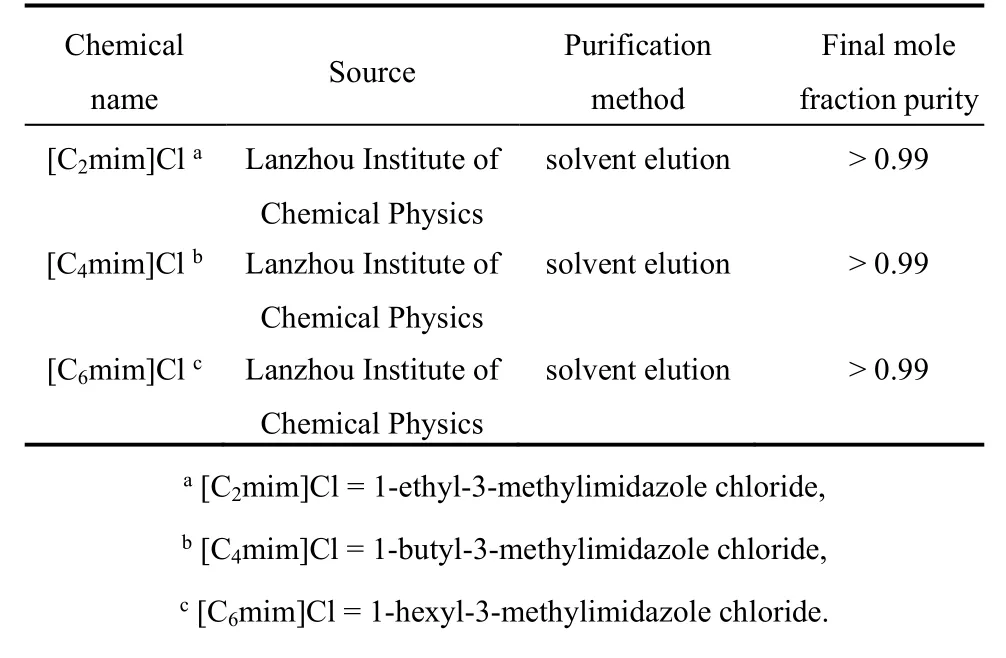
表1 实验材料的纯度和来源Table 1 Purity and source of the sample materials.
2.3 理论依据
众所周知,Antoine方程可用于描述蒸气压曲线32:
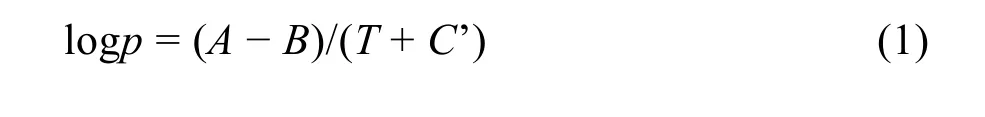
其中,p为蒸汽压,T为绝对温度,A、B和C’为研究温度范围内的Antoine常数。然而,由Antoine方程获得的数据不仅受限于可用的化合物数量,而且受限于所研究的温度范围。本文采用的热重分析法实验原理基于Langmuir方程33:
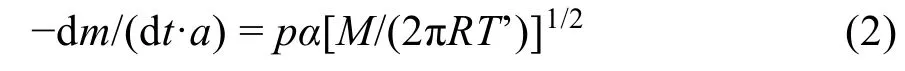
其中,-dm/(dt·a)是单位面积的质量损失率(kg·s-1·m-2),p是蒸汽压力(Pa),M是挥发性化合物蒸气的相对分子质量(kg·mol-1),T是绝对温度(K),α是蒸发系数。通过重新排列 Langmuir方程,得到以下公式:

其中,k= (2πR)1/2/α,υ= (1/a)(-dm/dt)(T/M)1/2。k值与仪器相关与样品无关34,υ值与仪器无关与样品有关。因此,为了获得Antoine常数未知的材料的蒸汽压,有效的方法是找到合适的校准材料,即在所需温度范围内能够保持热稳定性,由此可知其Antoine常数。式(3)中的k值可以通过已知标准化合物的蒸汽压和恒温热重实验时获得的质量损失率dm/dt来确定。然而,鉴于离子液体的蒸发量非常小,我们假设恒温热重实验中使用坩埚的蒸发界面保持不变,此时有:

结合Clausius-Clapeyron方程:

联合(4)和(5),得出如下方程:
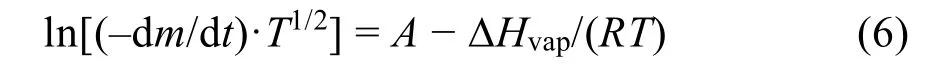
由式(6)可知,ln[(-dm/dt)·T1/2]对T-1作图可以得到一条直线,斜率为-ΔHvap/R,进而可以通过计算得到焓变值ΔHvap。
3 结果与讨论
3.1 表征分析
核磁共振(NMR)谱图表征是确定样品结构的有效方法。Supporting Information图S1a-S3a给出了这三种物质的1H NMR谱图。
图S1a给出[C2mim]Cl的1H NMR谱图,峰值分布如下:8.62处的峰值归属于H(2);7.39和7.32处的峰值分别对应于H(3)和H(4);4.1处的峰值对应于H(5);3.79处的峰值对应于H(1);1.39左右的主要信号属于H(6)。这些峰的积分面积比为0.82 :0.82 : 0.83 : 1.85 : 2.79 : 3.00,与化合物[C2mim]Cl中每个基团的化学计量比大体一致。甲基(―CH3)和亚甲基(―CH2―)的多个分裂峰是由于它们之间氢氢耦合的影响35。图S2a给出[C4mim]Cl的1H NMR谱图,峰值分配如下:9.54、7.896、7.816、4.205、3.882、1.764、1.252和0.886处的峰值分别对应于H(2)、H(3)、H(4)、H(5)、H(1)、H(6)、H(7)和H(8)。这些峰的积分面积比为0.93 : 0.91 : 0.93 :2.11 : 3.00 : 2.04 : 1.98 : 2.82,与化合物[C4mim]Cl中每个基团的化学计量比大体一致。图S3a给出[C6mim]Cl的1H NMR谱图,峰值分配如下:10.812、8.200、8.122、4.492、4.142、1.955、1.295和0.866处的峰值分别归属于H(2)、H(3)、H(4)、H(5)、H(1)、H(6)、H(7, 8, 9)和H(10)。这些峰的积分面积比为0.96 : 0.94 : 0.91 : 2.09 : 3.00 : 2.09 :6.08 : 2.88,与化合物[C6mim]Cl中每个基团的化学计量比大体一致。Supporting Information的图S4-S6给出了三种物质的13C NMR谱图。图S4给出[C2mim]Cl的13C NMR谱图,峰值分布如下:136.233处的峰值归属于C(2);123.488和121.929处的峰值分别对应于C(3)和C(4);44.049处的峰值对应于C(5);35.686处的峰值对应于C(1);15.138的信号属于C(6)。图S5给出[C4mim]Cl的13C NMR谱图,峰值分配如下:136.717、123.549、122.249、48.347、35.678、31.373、18.742和13.275处的峰值分别对应于C(2)、C(3)、C(4)、C(5)、C(1)、C(6)、C(7)和C(8)。 图S6给 出[C6mim]Cl的13C NMR谱图,206.169、124.380、123.191、49.830、36.327、31.812、30.901、26.390、23.026和14.186处的峰值分别归属于C(2)、C(3)、C(4)、C(5)、C(1)、C(6)、C(7)、C(8)、C(9)和C(10)。
3.2 热性能分析
图S7a给出1-乙基-3-甲基咪唑氯化物离子液体在298.15-673.15 K温度范围内的动态热重实验结果,即传统热重(TG)曲线图。实验中使用的样品质量为9.4802 mg。由图S7a可得,传统TG曲线在240 °C (即513.15 K)时开始显著下降。动态热重实验的目的是确定物质的初始分解温度,然后得到该物质恒温热重实验的温度范围。本文用于确定初始分解温度的方法是切线延伸交点法,即在曲线转折点的两端绘制切线,然后延伸切线以使其在某个点相交。最后,通过这个点做水平轴的垂直线,此时将形成另一个点,其对应的温度是物质的初始分解温度。运用上述方法得知1-乙基-3-甲基咪唑氯化物离子液体的初始分解温度约为275 °C,即548.15 K。
图S8a给出1-丁基-3-甲基咪唑氯化物离子液体在298.15-773.15 K温度范围内的传统热重曲线图。实验中使用的样品质量为8.7777 mg。由图S8a可得,样品的传统TG曲线在523.15 K (250 °C)时开始明显下降,运用切线延伸交点法得到该物质的初始分解温度约为553.15 K (280 °C)。
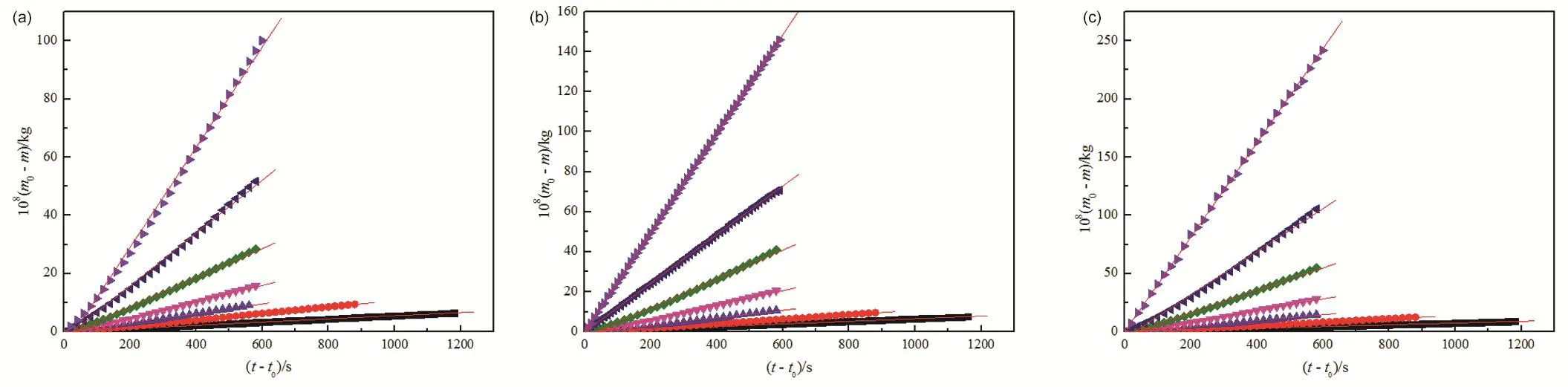
图1 [Cnmim]Cl (n = 2, 4, 6)的108(m0 - m)对(t - t0)作图Fig. 1 Plot of 108(m0 - m) versus (t - t0) for [Cnmim]Cl (n = 2, 4, 6).From the bottom to top: 443.15 K, 453.15 K, 463.15 K, 473.15 K, 483.15 K, 493.15 K, 503.15 K, respectively.(a) [C2mim]Cl: ■ 443.15 K: y = 1.46 × 10-2 + 5.49 × 10-3x, r2 = 0.9999, sd = 2.27 × 10-2; ● 453.15 K: y = -3.61 × 10-1 + 1.11 × 10-2x,r2 = 0.9990, sd = 9.44 × 10-2; ▲ 463.15 K: y = -3.34 × 10-1 + 1.65 × 10-2x, r2 = 0.9978, sd = 1.33 × 10-1; ▼ 473.15 K: y = -8.90 × 10-1 +2.80 × 10-2x, r2 = 0.9959, sd = 3.21 × 10-1; ◆ 483.15 K: y = -1.57 × 10-1 + 5.03 × 10-2x, r2 = 0.9958, sd = 5.84 × 10-1;◄ 493.15 K: y = -2.52 × 100 + 9.10 × 10-2x, r2 = 0.9959, sd = 1.05 × 100; ►503.15K: y = -5.45 × 100 + 1.72 × 10-1x, r2 = 0.9959,sd = 2.01 × 100. (b) [C4mim]Cl: ■ 443.15 K: y = -5.54 × 10-3 + 6.50 × 10-3x, r2 = 0.9999, sd = 2.04 × 10-2; ● 453.15 K: y = -4.20 × 10-1 +1.12 × 10-2x, r2 = 0.9984, sd = 1.18 × 10-1; ▲ 463.15 K: y = -6.19 × 10-1 + 1.89 × 10-2x, r2 = 0.9949, sd = 2.40 × 10-1;▼ 473.15 K: y = -1.23 × 100 + 3.63 × 10-2x, r2 = 0.9944, sd = 4.81 × 10-1; ◆ 483.15 K: y = -2.46 × 100 + 7.21 × 10-2x, r2 = 0.9935,sd = 1.03 × 100; ◄ 493.15 K: y = -1.23 × 10-1 + 1.22 × 10-1x, r2 = 0.9999, sd = 2.56 × 10-1; ► 503.15K: y = -1.38 × 10-1 + 2.48 × 10-1x,r2 = 0.9999, sd = 2.49 × 10-1. (c) [C6mim]Cl: ■ 443.15 K: y = -1.99 × 10-2 + 7.52 × 10-3x, r2 = 0.9999, sd = 2.58 × 10-2;● 453.15 K: y = -6.22 × 10-1 + 1.46 × 10-2x, r2 = 0.9976, sd = 1.91 × 10-1; ▲ 463.15 K: y = -7.70 × 10-1 + 2.57 × 10-2x, r2 = 0.9958,sd = 2.97 × 10-1; ▼ 473.15 K: y = -1.65 × 100 + 4.97 × 10-2x, r2 = 0.9947, sd = 6.50 × 10-1; ◆ 483.15 K: y = -3.12 × 100 + 9.65 × 10-2x,r2 = 0.9946, sd = 1.27 × 100; ◄ 493.15 K: y = -5.60 × 100 + 1.86 × 10-1x, r2 = 0.9954, sd = 2.26 × 100; ► 503.15K: y = 0.441 × 10-2 +4.05 × 10-1x, r2 = 0.9996, sd = 1.43 × 100.
图S9a是298.15-673.15 K温度范围内1-己基-3-甲基咪唑氯化物离子液体的传统热重曲线图。实验中使用的样品质量为10.8781 mg。由图可知,该物质的质量在约508.15 K (235 °C)时开始显著减少,初始分解温度约为533.15 K (260 °C)。
根据式(3),为了获得υ值,必须知道恒温过程中质量损失率dm/dt的值。因此,绘制了瞬时质量损失相对于时间变化的关系图(如图1所示),拟合线的斜率是质量损失率dm/dt的值,已经列于表2。
压强p与温度T的倒数的关系可以用图2表示。表3已经列出在443.15-503.15 K温度范围内构建图2所需的相应数据。
根据υ-T数据,绘制三种物质ln[(-dm/dt)·T1/2]对T-1的图,得到三条直线,如图2所示。根据式(6),这些直线的斜率是-ΔHvap/R。表4已经列出图2中[Cnmim]Cl (n= 2, 4, 6)的ln[(-dm/dt)·T1/2]对T-1的拟合线(y=a+bx)参数。因此,这三种物质的ΔHvap(Tav)可以通过计算得到并且已经列于Supporting Information表S1。
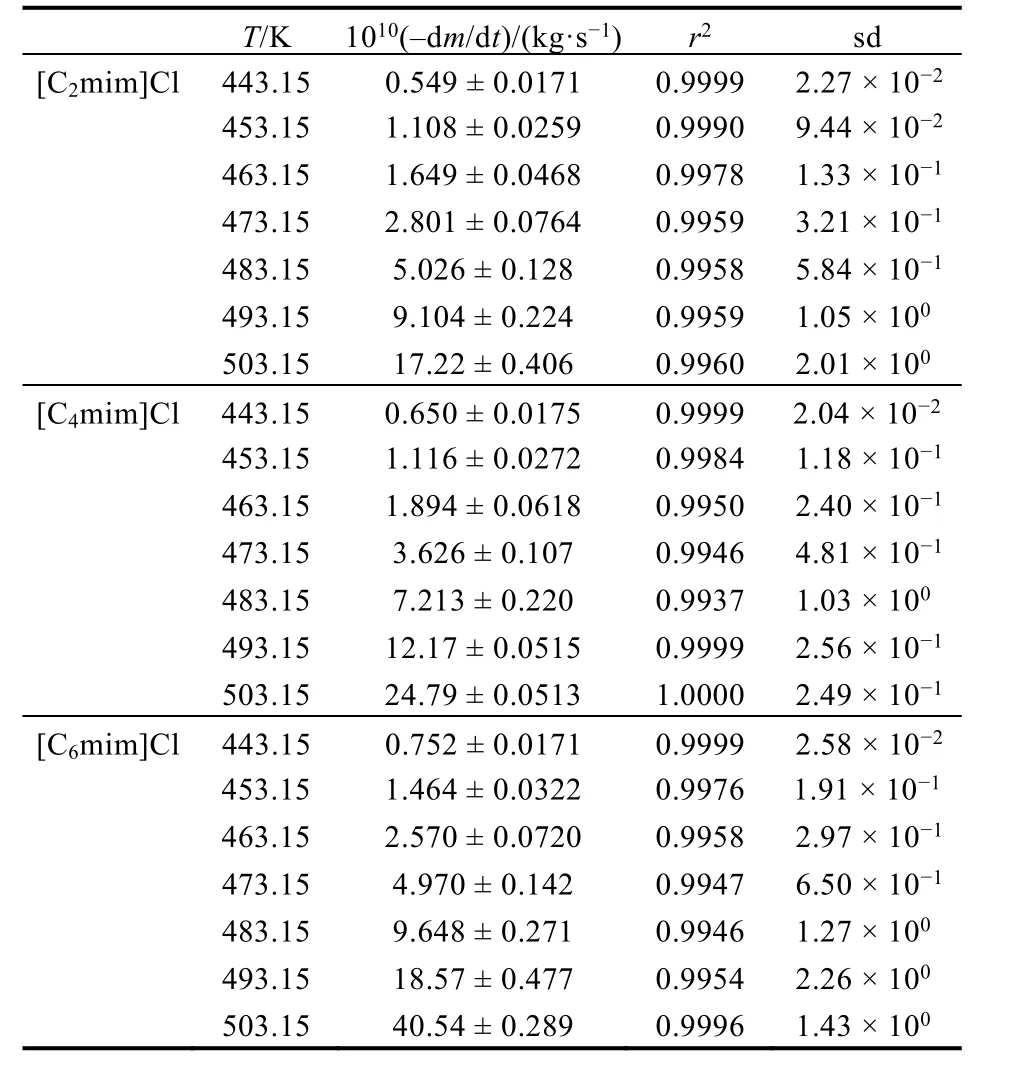
表2 443.15-503.15 K,[Cnmim]Cl (n = 2, 4, 6)的-dm/dt值Table 2 Values of -dm/dt for [Cnmim]Cl (n = 2, 4, 6) from 443.15 to 503.15 K.
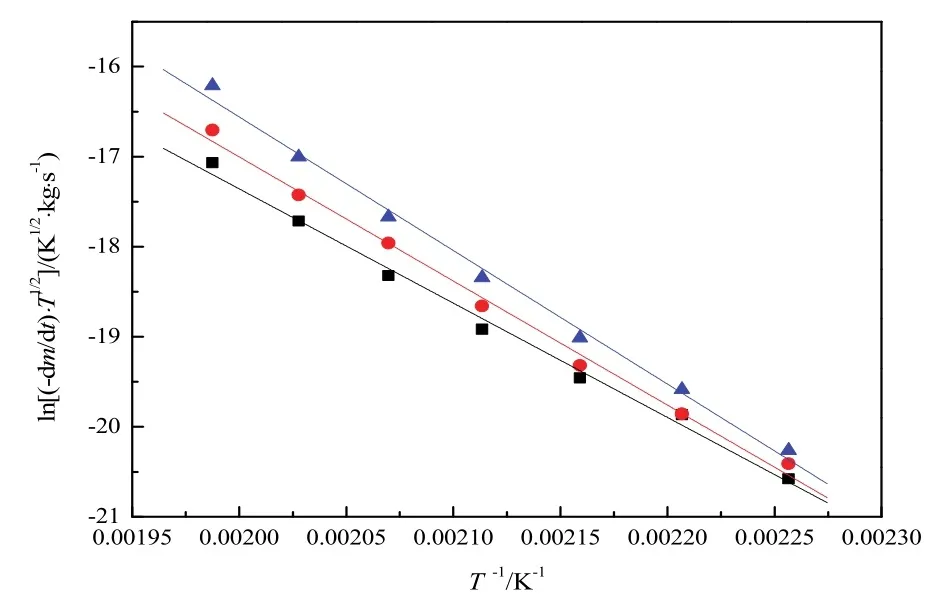
图2 [Cnmim]Cl (n = 2, 4, 6)的 ln[(-dm/dt)·T1/2]对T-1作图Fig. 2 Plot of ln[(-dm/dt)·T1/2] versus T-1for[Cnmim]Cl (n = 2, 4, 6)■[C2mim]Cl: y = 8.026 - 1.269 × 104x, r2 = 0.9924, sd = 1.08 × 10-1.●[C4mim]Cl: y = 10.56 - 1.378 × 104x, r2 = 0.9936, sd = 1.07 × 10-1.▲[C6mim]Cl : y = 13.11 - 1.484 × 104x, r2 = 0.9939, sd = 1.12 × 10-1.
3.3 同系列物质蒸发焓的预测
为了丰富该系列物质的热性能数据,本课题组对1-辛基-3-甲基咪唑氯化物离子液体的蒸发焓进行预测。预测蒸发焓需要借助摩尔表面自由能36和以前工作24中提到的新的蒸发过程模型。
1886年,Baron Roland von EötvÖs37提出摩尔表面能的概念,其定义如下:

表4 [Cnmim]Cl (n = 2, 4, 6)的 ln[(-dm/dt)·T1/2]对 T-1的拟合线(y = a + bx)参数Table 4 Parameters of the fitting line (y = a + bx) for[Cnmim]Cl (n = 2, 4, 6) in the plot of ln[(-dm/dt)·T1/2]against T -1.

其中,γ是表面张力,Vm是摩尔体积。假设一个分子在表面的面积和在液体中的面积相等,若要计算一个分子在液体中的面积,那么首先假设一立方液体中包含一摩尔物质。令n为立方体任意一边的分子数,单位为cm (如图3所示)。因此n3=NA,一个面上的分子数等于NA2/3。因此,每个分子的面积是:

其中,A/nA的单位为cm2·molecule-1。
因此,每摩尔分子的面积是:
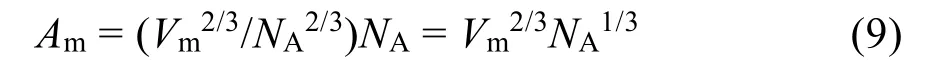
其中,Am的单位为cm2·mol-1。
然后,式(9)左右两侧同时乘以表面张力γ(mJ·m-2),得到每摩尔分子的能量,即摩尔表面自由能36:
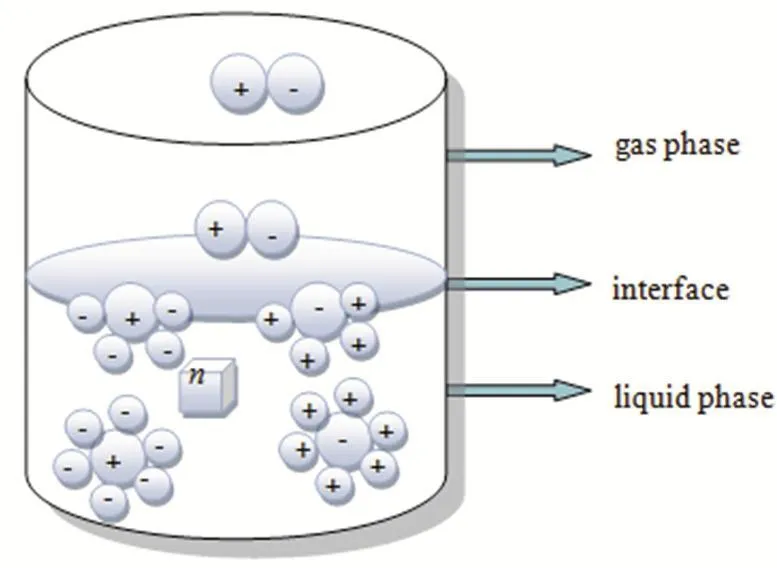
图3 蒸发过程新模型的示意图Fig. 3 Schematic diagram of the new model of vaporization process
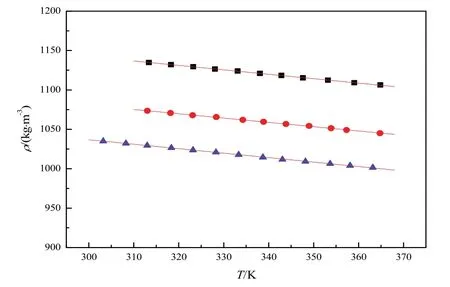
图4 文献39中[Cnmim]Cl (n = 2, 4, 6)的ρ对T作图Fig. 4 Plot of ρ versus T of [Cnmim]Cl (n = 2, 4, 6) in Ref. 39■[C2mim]Cl: y = 1310.61 - 0.561x, r2 = 0.9995, sd = 2.029 × 10-1.●[C4mim]Cl: y = 1244.70 - 0.547x, r2 = 0.9994, sd = 2.205 × 10-1.▲[C6mim]Cl : y = 1206.78 - 0.567x, r2 = 0.9992, sd = 3.046 × 10-1.

同时,Myers36还提出,液体蒸发的详细过程分为两个步骤:第一步是液相的分子移动到表面,第二步是分子从表面逃逸到气相。为了便于理解,给出图3示意图。
根据摩尔表面自由能的概念和蒸发过程模型24,25,将摩尔表面自由能与蒸发焓联系起来,其表达式如下:

式(11)是一个经验方程。其中,A= (1 -x)[NΔε(kin) -RT]和B= (1 -x)25均为经验参数。理论上,将任意温度下的蒸发焓代入式(11)均可求得经验参数。然而,为了扩大预测数据的适用性,便于与其他文献值进行比较,本文将平均温度下测得的蒸发焓ΔHvap(Tav)转换为环境温度下的蒸发焓ΔHvap(298)。该转换过程用到Verevkin38提出的恒压条件下液相和气相之间的热容差转换公式如下:
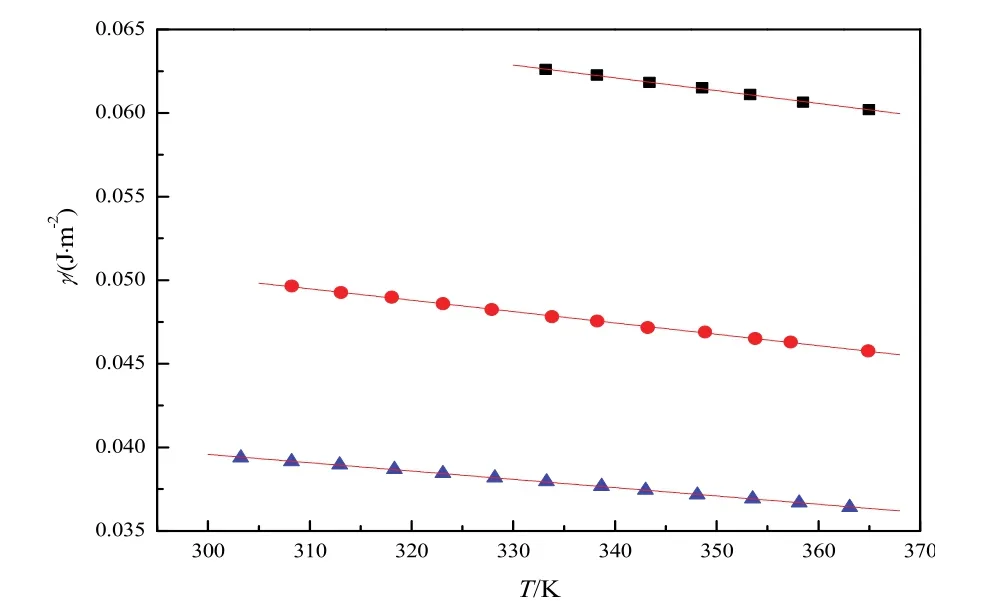
图5 文献39中[Cnmim]Cl (n = 2, 4, 6)的γ对T作图Fig. 5 Plot of γ versus T of [Cnmim]Cl (n = 2, 4, 6)in Ref. 39■[C2mim]Cl: y = 0.0881 - 7.655 × 10-5x, r2 = 0.9978, sd = 4.027 × 10-5.●[C4mim]Cl: y = 0.0706 - 6.797 × 10-5x, r2 = 0.9994, sd = 3.817 × 10-5.▲[C6mim]Cl : y = 0.0545 - 4.969 × 10-5x, r2 = 0.9995, sd = 2.245 × 10-5.
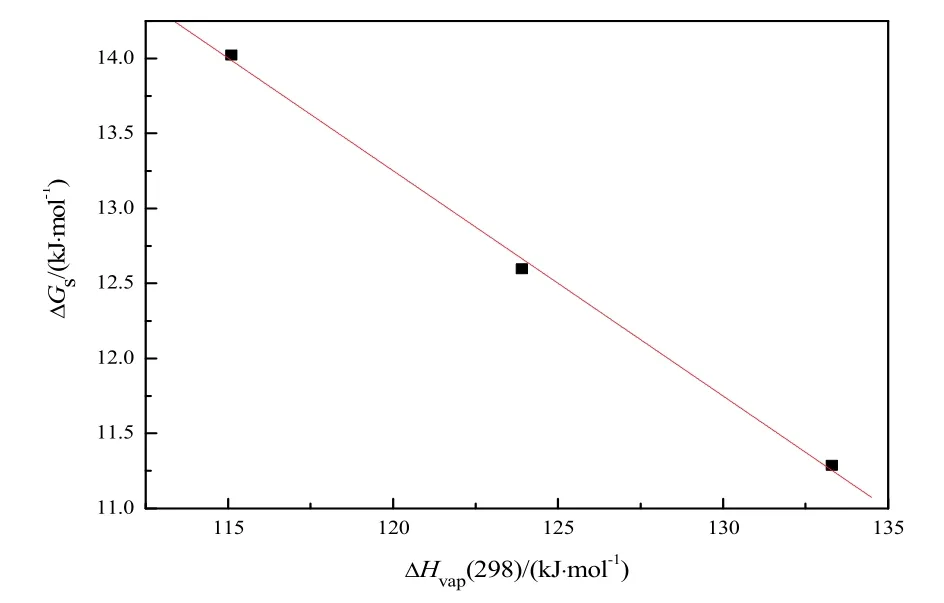
图6 [Cnmim]Cl (n = 2, 4, 6)的ΔGs对ΔHvap(298)作图Fig. 6 Plot of ΔGs versus ΔHvap(298) for[Cnmim]Cl (n = 2, 4, 6)ΔGs = 31.28 - 0.1502ΔHvap(298), r2 = 0.9961, sd = 8.5 × 10-2.
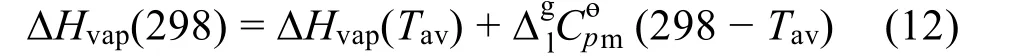
根据Monika Součková39等人,[Cnmim]Cl (n=2, 4, 6)的密度ρ和表面张力γ对温度T的关系如图4和图5所示。运用外推法得到T= 298.15 K时[Cnmim]Cl (n= 2, 4, 6)的密度和表面张力值。然后通过计算得到T= 298.15 K时的摩尔体积Vm和摩尔表面自由能ΔGs,并且将这些值列于表S1中。摩尔表面自由能ΔGs与蒸发焓ΔHvap(298)的关系如图6所示。
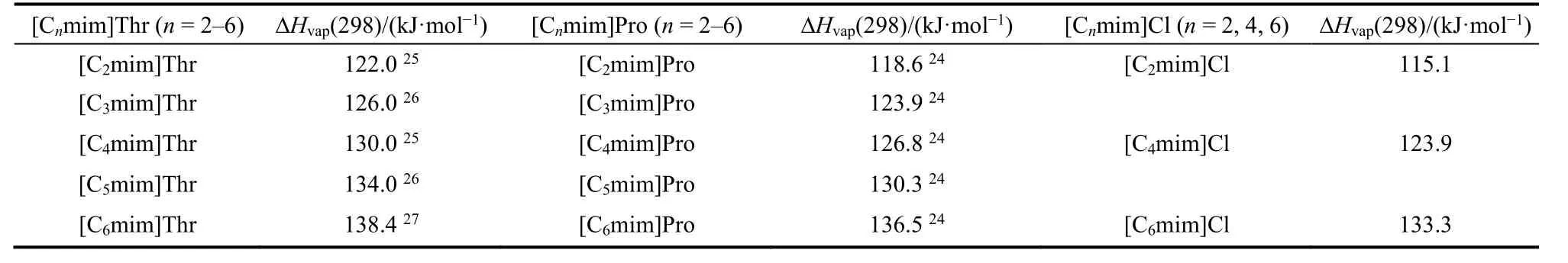
表5 T = 298.15 K [Cnmim]Thr (n = 2-6),[Cnmim]Pro (n = 2-6)和[Cnmim]Cl (n = 2, 4, 6)的ΔHvap(298)值Table 5 The values of ΔHvap(298) for [Cnmim]Thr (n = 2-6), [Cnmim]Pro (n = 2-6) and[Cnmim]Cl (n = 2, 4, 6) at T = 298.15 K.
对 比 式(11), 得 到A= 31.28 kJ·mol-1和B=-0.1502,该值可用来预测[C8mim]Cl的蒸发焓。[C8mim]Cl在T= 298.15 K时的表面张力和摩尔体积数据引自Dzmitry H. Zaitsau40。预测[C8mim]Cl的蒸发焓ΔHvap(298) = 136.7 kJ·mol-1与文献40中估计的蒸发焓ΔHvap(298) = 122.7 kJ·mol-1处于同一数量级。
在前期工作24-27中,我们研究了羧酸咪唑类[Cnmim]Pro (n= 2-6)和氨基酸咪唑类[Cnmim]Thr(n= 2-6)离子液体的蒸发焓,将这两类离子液体以及本文所研究的卤素咪唑类[Cnmim]Cl (n= 2, 4,6)离子液体的蒸发焓值列于表5。
比较表5中三类离子液体的蒸发焓值,可知:当阳离子相同时,变换阴离子会对蒸发焓值产生影响,大小顺序为氨基酸咪唑类 > 羧酸咪唑类 >卤素咪唑类。结合三类离子液体的分子结构差异可知:苏氨酸根(CH3CH(OH)CH(NH2)COO-)比丙酸根(CH3CH2COO-)多了一个羟基(―OH)和一个氨基(―NH2),并且二者都具有羧酸根(COO-),而氯离子(Cl-)既不含羟基(―OH)和氨基(―NH2)又不含羧酸根(COO-)。在[Cnmim]Thr (n= 2-6)中除了存在大量的阴、阳离子之间的相互作用力外,还存在着大量的氢键41,从而导致[Cnmim]Thr (n=2-6)在相同温度下自由离子含量较低,由液态变为气态时需要外界输入的能量较高,因此蒸发焓值较高。
4 结论
运用恒温热重法得到离子液体[Cnmim]Cl (n=2, 4, 6)的蒸发焓ΔHvap(Tav)。根据Verevkin提出的方法,在恒定压力下[Cnmim]Cl (n= 2, 4, 6)的气液态热容差是不同的。因此,借助获得[Cnmim]Cl (n= 2, 4, 6) 在T= 298.15 K时的蒸发焓ΔHvap(298)。此外,根据课题组提出的新模型预测了[C8mim]Cl的蒸发焓,并证明预测值和文献值在同一数量级。最后与前期工作中研究的羧酸咪唑类[Cnmim]Pro (n= 2-6)和氨基酸咪唑类[Cnmim]Thr (n= 2-6)离子液体的蒸发焓进行比较,得出结论:保持阳离子不变只变换阴离子会影响离子液体的蒸发焓,变化顺序为氨基酸咪唑类 > 羧酸咪唑类 > 卤素咪唑类。对比三类离子液体的分子结构差异,初步判断可能与分子间存在的氢键有关。本文所研究的[Cnmim]Cl (n= 2, 4, 6)离子液体分子间不存在氢键,因此在三类离子液体中蒸发焓值最低。
Supporting Information:available free of chargeviathe internet at http://www.whxb.pku.edu.cn.
