东北黑土区不同土地利用方式下农田土壤微生物多样性
2020-12-25贾鹏丽冯海艳
贾鹏丽,冯海艳,李 淼
东北黑土区不同土地利用方式下农田土壤微生物多样性
贾鹏丽,冯海艳※,李 淼
(中国地质大学(北京)地球科学与资源学院,北京 100083)
为探究黑龙江省黑土区不同土地利用方式下土壤微生物多样性,该研究主要采用Biolog Eco微平板法,以荒地为对照,研究了黑龙江省中部和西南部黑土区玉米、水稻、大豆及土豆4种不同土地利用方式下土壤微生物多样性的变化。结果表明:1)可培养细菌的数量从大到小依次为土豆、水稻、大豆、玉米、荒地,但群落Shannon-Wiener多样性指数从高到低依次为:荒地(2.18)、玉米(2.11)、土豆(2.00)、水稻(1.73)、大豆(1.49);2)不同利用方式下黑土区微生物碳源利用程度大致随培养时间的延长而升高,并且氨基酸、糖类以及聚合物类是黑土微生物代谢的最主要碳源;玉米地土壤微生物的Shannon-Wiener指数(3.18)、McIntosh指数(5.96)、丰富度指数(24.89)、及Simpson指数(0.95)比其他土地利用方式土壤微生物的多样性指数高,而水稻田土壤微生物的多样性指数最低,土豆、大豆与荒地土壤微生物的多样性指数间无显著差别;3)不同土地利用方式显著影响了土壤微生物群落碳源代谢多样性,并且对土壤微生物群落代谢特征起分异作用的主要碳源类型为糖类、氨基酸类和羧酸类,其中糖类尤为突出。该研究将有助于了解黑土区土壤微生物多样性与土地利用方式之间的关系,为黑土区农业的可持续发展提供一定的科学依据。
土地利用;土壤;微生物;黑土区;功能多样性;Biolog-Eco
0 引 言
土壤微生物参与土壤生态系统的能量流动和养分循环[1],影响生物的地球化学循环过程,其多样性和群落组成在决定土壤生态系统的功能和可持续性中起着重要作用[2]。近年来对土壤微生物群落和功能多样性的研究已经成为生态学领域的热点。碳源代谢多样性作为功能微生物群落变化的一个重要指标[3],对了解微生物代谢功能多样性提供可靠的依据,其中Biolog Eco微平板法可以根据不同的微生物群落对不同单一碳源的利用能力,反映出微生物代谢功能多样性[4],这种方法具有灵敏度高、分辨力强的优点,可以最大限度地保留微生物群落原有的代谢特征[5],对揭露土壤微生物结构和功能多样性的变化起着重要的作用。
土地利用方式的改变会影响土壤养分的循环与供应,直接造成土壤质地和地下微生物群落结构的变化[6],进而引起土壤微生物多样性的改变。近些年国内外利用Biolog Eco微平板研究了微生物多样性,如沉积物[7]、活性污泥[8]等,这种方法能快速表征生态环境样品的状态;国内许多学者把这种技术也应用到众多领域,邓娇娇等[9]采用Biolog-Eco技术研究不同土地利用方式对辽东山区土壤微生物群落的多样性的影响,结果表明林地土壤微生物多样性高于耕地。朱珂等[10]对白浆土的研究也发现耕地的土壤微生物代谢活性最低,而草地的土壤微生物代谢活性最强,微生物生物量碳也最高,其次为林地,并且这3种土地利用方式土壤微生物对6类碳源的相对利用率以糖类、氨基酸类和羧酸类最高。秦红等[11]研究指出林地可固持、滞留和保有更多的土壤养分,有较高的细菌多样性和真菌多样性。目前关于土壤微生物多样性研究的重点集中在林地、草地等自然土壤中,且土地利用方式的改变会明显影响土壤微生物活性、功能类群。而农田土壤中,尤其是不同土地利用方式下农田土壤微生物功能多样性的研究尚有待深入。
黑土是中国重要的粮食生产基地[12],土壤肥力高,对中国粮食安全重要作用。为探明黑土区农业生产中科学合理的土地利用方式,本文通过研究不同土地利用方式下黑土农田土壤微生物的活性,即微生物利用单一碳源的能力,区分不同土地利用方式下土壤微生物群落的主要碳源类型,明确黑土微生物的代谢功能类群[13],进而选择合适的土地利用类型。土壤微生物中细菌约占土壤总体微生物的90%,因此细菌在很大程度上可以代表土壤微生物群落特征[14]。本文以黑龙江省中部及西南部黑土为研究对象,在细菌纯培养的基础上,采用Biolog Eco法研究不同土地利用方式下土壤微生物群落多样性的变化,以期为黑土区土壤科学持续利用提供依据。
1 研究区概况与研究方法
1.1 研究区概况
采样区涵盖绥化市与双城市。绥化市位于黑龙江省中部(45°10′-48°06′N,124°53′-128°35′E),全市总面积3.5万km2,地势东北高、西南低,整体由低丘陵、高平原过渡为河谷平原,东部与伊春市交界,西部与大庆市毗邻,南部与哈尔滨相连,北部与齐齐哈尔、黑河接壤;气候属于温带大陆性季风气候,年平均气温2.4 ℃,年平均降雨量约504 mm;土壤类型主要包括草甸土、黑土、黑钙土以及暗棕壤[15]。
双城市位于黑龙江省西南部(45°08′-45°43′N,125°41′-126°42′E),处在松嫩平原典型黑土带中南部,松花江上游南岸,西南部与吉林交界,东北部与哈尔滨市区接壤,全境为冲积平原和阶地,地势平坦,呈东高西低的马鞍状;属于中温带大陆性季风气候,年平均气温2.0~5.3 ℃,年降雨量400~500 mm;主要土壤类型为黑土[16]。
1.2 材料与方法
1.2.1 样品采集、培养与扩增
在黑龙江省绥化市与双城市分别按照4种土地利用方式(玉米、水稻、土豆、大豆)以及荒地进行采样。每块样地设置重复样方,每块样方采用“五点取样法”进行取样,将0~20 cm土壤表面的植被及凋落物剥离,每块样方采集的土壤样品混合成一个样品,分装于无菌50 mL离心管中,及时盖好盖子,样品采集之后用蓝冰4 ℃保存,并及时运送回实验室用以后续研究。
本文使用牛肉膏蛋白胨琼脂培养基[17](NM)、胰蛋白大豆蛋白胨琼脂培养基[18](TSA)、以及R2A琼脂培养基[19-20](R2A)3种培养基对黑龙江省不同土地利用方式下的黑土进行细菌的分离与计数。用直接挑取菌落于50L无菌双蒸水水浴(95 ℃)处理后制成的裂解液作为模板,采用细菌通用引物Bac27F 和U1492R 扩增细菌16S rRNA 基因,扩增片断长度为1.5 kb,用于测定可培养细菌Shannon-Wiener()多样性指数。
1.2.2 土壤理化指标测定
土壤基本理化指标的测定依据《土壤农化分析》进行测定[21],其中全氮用半微量开氏法;全磷用碱熔-钼锑抗比色法;土壤pH值用精密酸度计测定;有机碳的测定使用热重铬酸钾-容量法;土壤微生物生物量碳的测定使用氯仿熏蒸-K2SO4浸提法[22]。农田采样点土壤基本理化性质如表1所示。
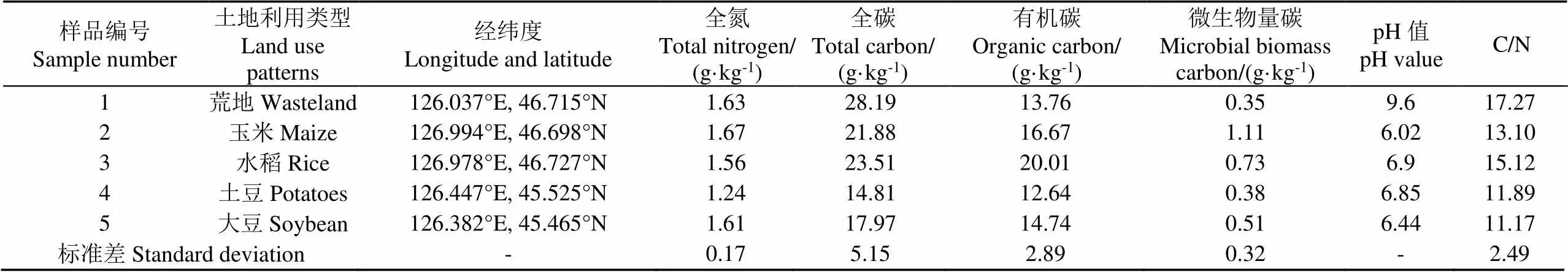
表1 农田区土壤样品基本理化性质
1.2.3 土壤微生物碳源利用多样性测定
微生物群落功能多样性采用Biolog Eco板法,其目的是测定各个生态板孔的吸光值随着培养时间的变化。称取3 g土壤样品加入27 mL、浓度为0.145 mol/L的已灭菌氯化钠溶液中[23],振荡30 min,静置2~3 min,制成稀释倍数为10-1的土壤稀释溶液;取上述溶液的上清液3 mL,加入到27 mL NaCl溶液中,混匀,制成稀释倍数为10-2的土壤稀释溶液;再取以上混合液3 mL,加入到27 mL NaCl溶液中,混匀,最终制成稀释倍数为10-3的土壤稀释溶液。提前将Biolog Eco板预热至室温,将已制备好的上述10-3稀释倍数的土壤稀释溶液倒入无菌加样槽中,使用八通道移液器将其接种于微孔板的96 个微孔中,每孔加入150L。将Biolog Eco微孔板放入25 ℃恒温培养,每24 h使用Biolog Microsoft全自动微生物鉴定分型系统测定一次,读取波长=590 nm的吸光值,连续测定读数2周。
生物代谢强度采用平均颜色变化率(Average Well Color Development,AWCD)来描述,采用丰富度指数、Simpson多样性指数、Shannon多样性指数以及McIntosh多样性来表征土壤微生物功能多样性。丰富度指数是指被利用的碳源的总数目,为每孔中(-)的值大于0.25的孔数。
平均颜色变化率:
AWCD=∑(C−)/31 (1)
Shannon多样性指数:
H=−∑Pln(P) (2)
Simpson多样性指数:
=1−∑(P)2(3)
McIntosh多样性指数:
=SQRT(∑N2) (4)
式中C为各反应孔在590 nm下的光密度值;为Eco板对照孔的光密度值;C−<0的孔均在计算中记为零,即C−≥0;P为第孔的相对吸光值与平板所有反应孔相对吸光值总和的比率,即P=(C−)/Σ(C−);N为第孔的相对吸光值[24]。
使用Excel 2007整理数据并作图,用SPSS 25.0对数据进行统计分析。
2 结果与分析
2.1 不同土地利用方式可培养土壤细菌数量及多样性
不同土地利用方式下可培养细菌总数存在着一定差异,从大到小依次为土豆、水稻、大豆、玉米、荒地(表2)。采用Shannon-Wiener多样性指数计算可培养细菌多样性[25]。不同土地利用方式下黑土细菌多样性从大到小依次为荒地、玉米、土豆、水稻、大豆。在5种黑土样品中,其多样性指数的变化趋势与土壤微生物菌落数目的变化趋势并不完全一致。
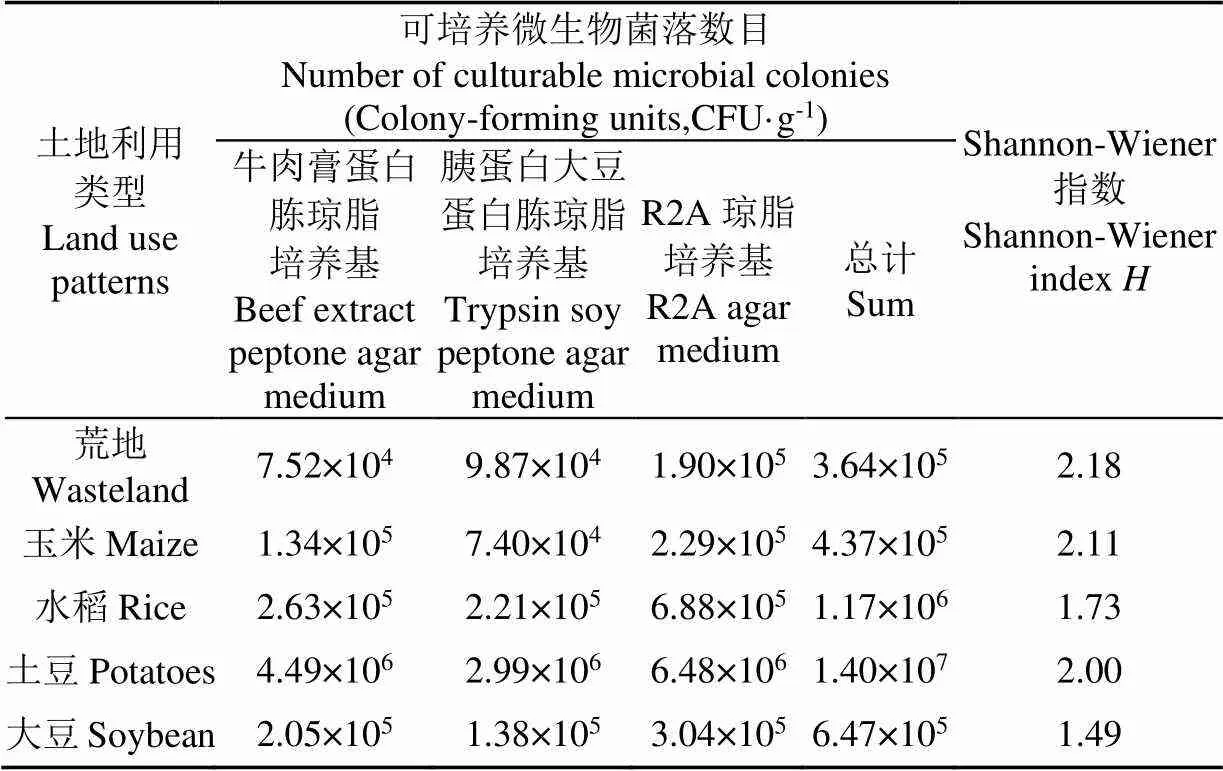
表2 不同土地利用类型黑土可培养细菌菌落数目及多样性
2.2 不同土地利用方式土壤微生物对碳源的利用
平均颜色变化率(AWCD)是通过土壤稀释液对碳源利用的吸光值变化来表示土壤微生物活性,其变化能很好地反映整体微生物功能多样性[26]。AWCD值越高表明土壤微生物密度越高、活性越大,反之亦然[27-28]。根据不同土地利用类型下的平均颜色变化率(AWCD)随时间的变化(图1)可以看出,土壤微生物一般需要24~48 h来实现代谢的增长。从48 h到培养结束,无论何种土壤微生物,其碳源代谢利用能力一直在增强,但是不同土壤利用类型下的代谢速率不同,总体上种植玉米的黑土中微生物对于碳源的代谢活性较强,而水稻土壤微生物的代谢活性最弱,荒地、土豆和大豆介于玉米和水稻之间,且三者无明显差异。
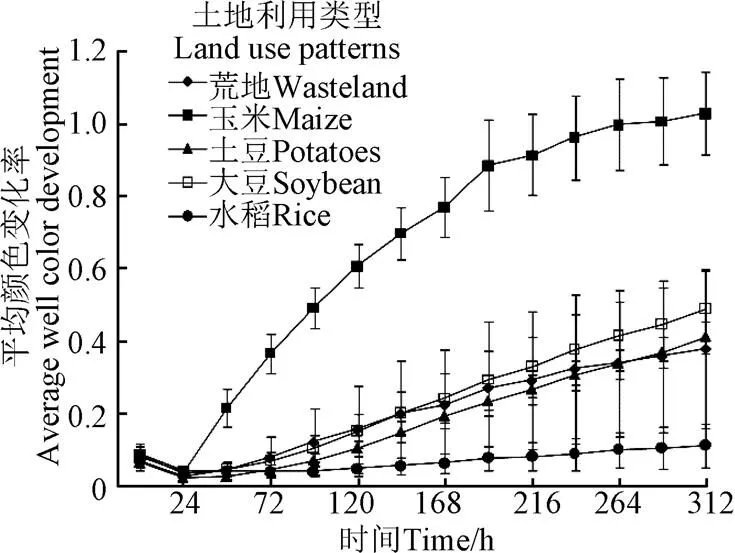
图1 不同土地利用类型下碳源利用平均颜色变化率
微生物对不同碳源的利用强度可以反映微生物的代谢功能类群[29],根据化学基团的性质将Biolog Eco板上的31种碳源分成6类,进一步分析每类碳源的平均颜色变化率。图2为每类碳源利用的平均颜色变化率。
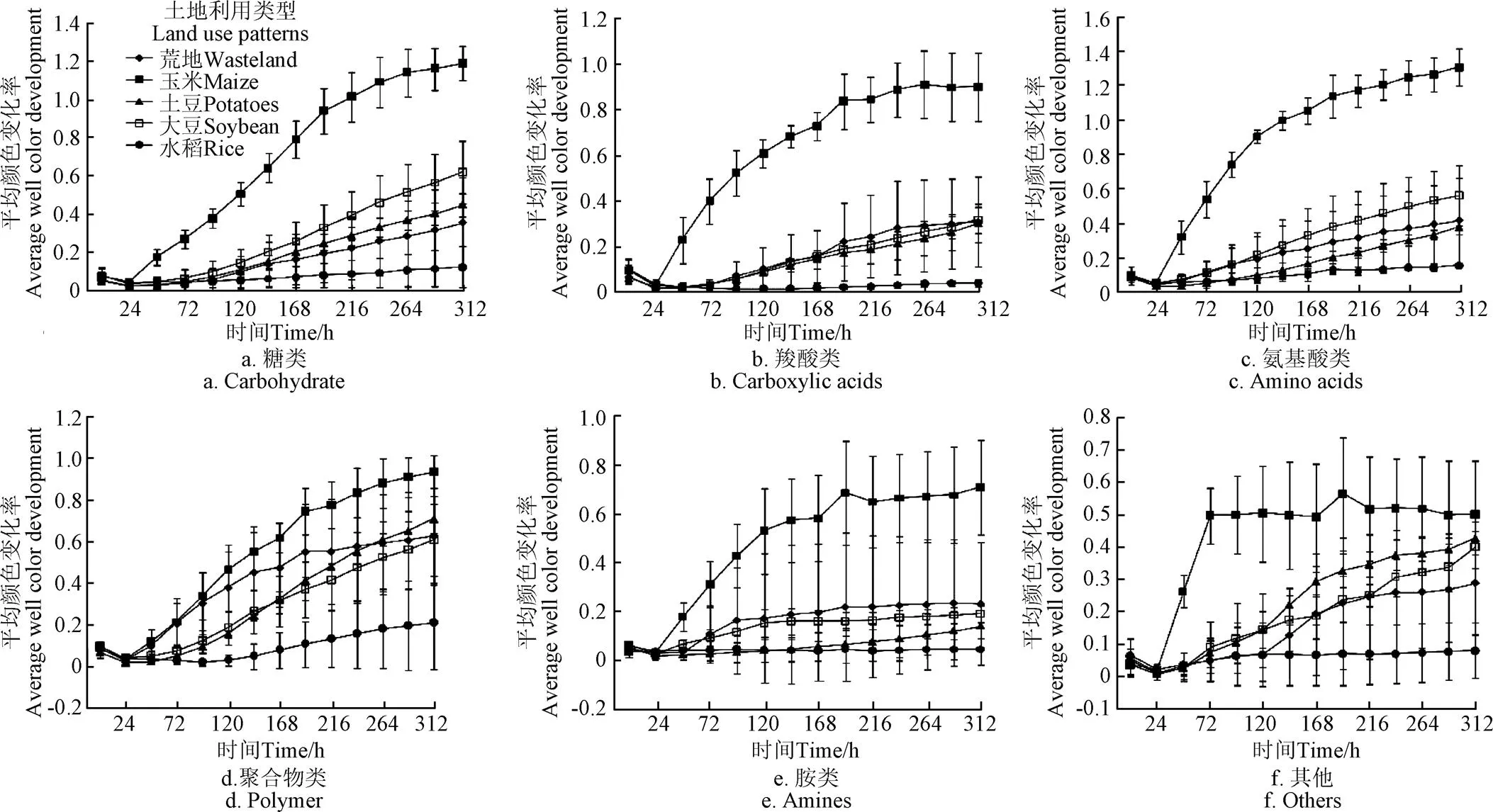
图2 每类碳源利用的平均颜色变化率
不同土地利用类型下土壤微生物对不同类型碳源的利用强度明显不同:玉米地土壤微生物对于氨基酸类和糖类的利用率最大;水稻田土壤微生物对其他类和氨基酸类的利用率最大;荒地土壤微生物对聚合物类和氨基酸类的利用率最大;土豆土壤微生物对聚合物类和糖类利用率最大;大豆土壤微生物对糖类和聚合物类利用率最大。由此可见,氨基酸、糖类以及聚合类是黑土微生物代谢的最主要碳源。
2.3 土壤微生物群落功能多样性指数分析
Shannon多样性指数、丰富度指数和优势度指数等代谢多样性指数能够反映土壤微生物群落的功能多样性。不同土地利用方式的微生物多样性指数存在着显著的差异(表3),种植玉米的土壤微生物的各项多样性指数均显著高于其他土地利用方式(<0.05),而水稻田的土壤微生物的各项多样性指数均低于其他土地利用方式(<0.05),土豆和大豆土壤微生物的多样性指数没有显著差异(<0.05)。
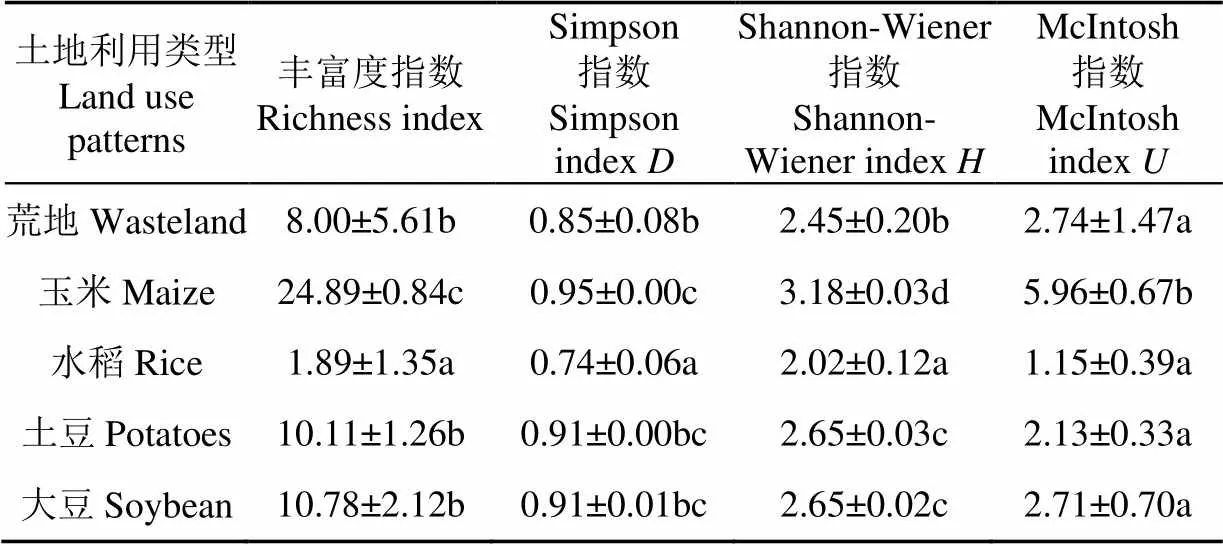
表3 黑土微生物碳源利用丰富度及多样性指数
注:同列不同小写字母表示显著差异(<0.05)。
Note: Different lowercase letters in the same column indicate significant difference (<0.05).
2.4 不同土地利用方式土壤微生物群落代谢多样性
为了进一步探讨不同土地利用类型下黑土微生物群落的碳源代谢变化情况,对培养192 h后测定的AWCD数据进行主成分分析(Principal Component Analysis, PCA),其中前2个主成分方差贡献率为:54.43%和7.95%,累积方差贡献率为62.38%。PC1得分系数差异显著(=39.436,<0.01)。在PC1方向,玉米与其他4种土地利用方式有明显的差异,玉米位于PC1的正端,而其他4种土地利用方式则位于负端,并且这4种土地利用方式之间的差异不显著。主成分2得分系数差异不显著(=2.050,>0.01),水稻位于PC2的负端,玉米、荒地、土豆和大豆在正端和负端均有分布(图3)。
初始载荷因子反映主成分与碳源利用的相关系数,载荷因子越高表示碳源对主成分的影响越大。与主成分1具有较高相关系数的碳源(表4),可以看出,对PC1起分异作用的主要碳源有糖类8种、羧酸类7种、氨基酸类5种、胺类2种以及其他类化合物2种,是PC1主要的贡献碳源,因而不同土地利用方式下的黑土土壤微生物功能群落主要受到以上这些碳源因子的制约。另外,聚合物类对于主成分1的分异作用不显著。以上结果表明,对土壤微生物群落代谢特征起分异作用的主要碳源类型是糖类、羧酸类和氨基酸类,即不同土地利用方式微生物碳源代谢多样性的差异主要体现在糖类、氨基酸类和羧酸类,其中糖类尤为突出。
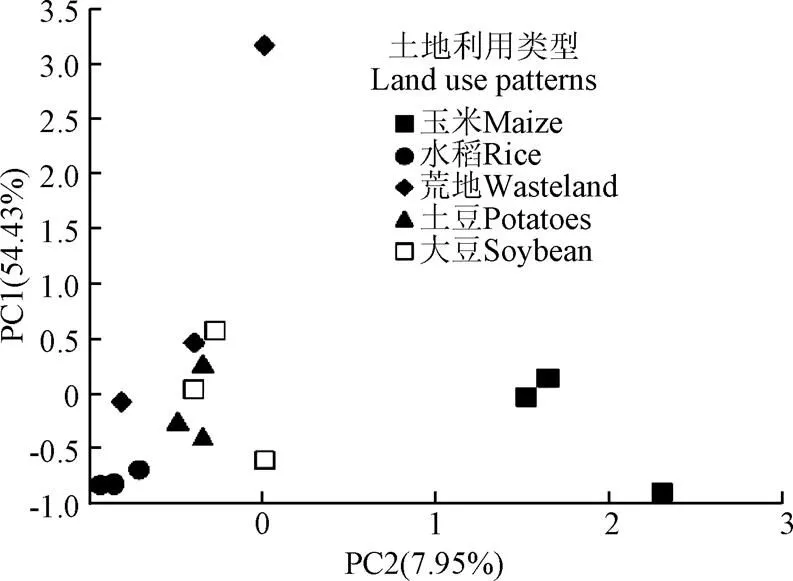
图3 不同土地利用类型下黑土微生物碳源利用的主成分变量
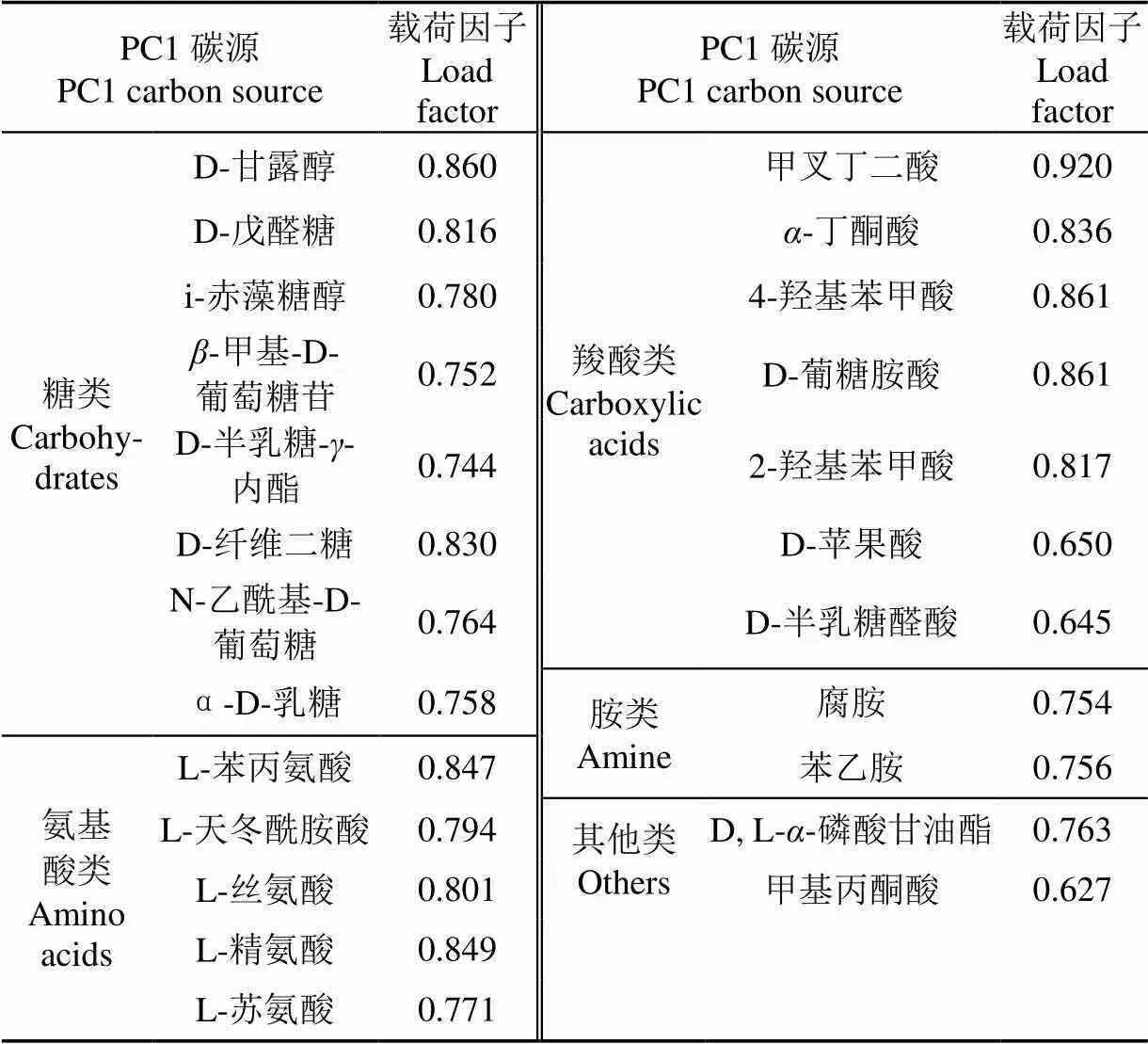
表4 黑土中与PC1显著相关的碳源种类
3 讨 论
在微生物多样性的研究中,纯培养方法是一种重要的技术手段,可用于直接获得菌种资源、微生物的基因序列、形态、生理特性、代谢功能等信息[30],利用纯培养能够更加全面地了解微生物的多样性进而更好地利用这些自然资源[31-32]。不同培养条件下不同土地利用方式可培养细菌数量具有一定差异,总的来说土豆的土壤可培养细菌数目最多,其次是水稻、大豆、玉米的,荒地最少,但是荒地可培养细菌的Shannon-Wiener指数()显著高于其他土地利用方式。研究表明种植土豆可以使得土壤磷酸酶活性显著增大,使土壤全磷和速效磷显著增加[33];与此同时,土壤过氧化氢酶活性也显著增大,在细菌新陈代谢过程中加速其对于过氧化氢等有毒物质的分解,在一定程度上促进细菌的生长。荒地中形成的细菌菌落数目最少,可能受到土壤样品中各养分含量的影响较大[34],并且有研究统计表明土壤pH值在弱碱性范围内,细菌数量会与之呈现较好的相关性[14],且细菌最适生长pH值变化范围属于微碱性[35],因此荒地中较高的pH值成为限制细菌数量的又一可能因素。但是荒地的可培养细菌多样性指数最高,这可能是由于荒地上受到的人为活动干扰较少,尽可能保留了自身的自然环境,形成了较和谐、平衡的微域生态环境。其他土地利用方式下的黑土中植物种类较为单一,而荒地的植物凋落物来源丰富,因此微生物可利用的营养物质来源多样化,土壤各方面的养分含量较均衡,各类细菌均能够在其中很好地生长,因而细菌多样性指数较高[34,36]。
由于培养基种类的有限性使得关于自然界中大量的不可培养或者生长缓慢的细菌的研究难度较大。本文采用Biolog Eco微孔板法对微生物多样性进行进一步的研究,可以看出不同土地利用方式下会对土壤微生物群落代谢活性产生显著影响[28]。平均颜色变化率(AWCD)表征微生物群落碳源利用率,是土壤微生物群落利用单一碳源能力的一个重要指标,反映了土壤微生物活性、微生物群落生理功能多样性[36];土壤微生物多样性是土壤生态系统中物质和能量转化、循环和利用的基础, 是土壤生态系统稳定性和可持续性的保障,反映了土壤微生物群落的功能多样性[38]。不同土地利用方式的土壤,种植玉米的土壤微生物AWCD和各项多样性指数均显著高于其他利用方式,而水稻的AWCD和各项多样性指数显著低于其他土地利用方式,因此种植玉米可有效提高黑土中微生物对于碳源的代谢活性。研究表明,不同植物的根系分泌物种类和数量存在一定的差异,根系发达的植物根际土壤中根系分泌物和脱落物的种类和数量更多[39],根系分泌物能改变植株周围的土壤微环境,并对土壤微生物产生不同的生态效应,从而影响了微生物的数量和区系组成[40-41],进而影响微生物群落功能多样性。土豆、大豆土壤微生物AWCD和各项多样性指数与荒地差异不显著,有可能是因为长期连作改变了土壤微生物群落结构,有助于促使抑病土的产生[42],使得其土壤微生物功能多样性达到荒地的稳定水平。因此不同土地利用方式对不同碳源的利用能力具有显著差异。
微生物对不同类型碳源的相对利用程度可以反映微生物的代谢功能类群[43]。不同的土地利用方式下土壤微生物所利用的碳源种类各不相同,但氨基酸、糖类以及聚合类是黑土微生物代谢的最主要碳源。土壤微生物的多样性与土壤环境密切相关,不同地区不同耕作方式等各种方面的差异都会影响土壤微生物的组成,进而导致微生物代谢功能多样的差异[44];朱珂等[8]对比研究了林地、耕地、草地的代谢特征发现耕地对糖类和氨基酸类相对利用率较高,农田土壤微生物更偏好易于代谢的高能量底物,这与本研究略有差异,可能由于不同地区土壤微生物种群类型具有一定差异。通过主成分分析可知,张海芳等[45]对贝加尔针茅草原自由放牧、刈割和围封三种土地利用方式进行土壤微生物研究,发现影响PC1的主要为糖类、氨基酸类和代谢中间产物及次生代谢物,而本文不同土地利用方式下微生物碳源利用的差异主要体现在碳水化合物、羧酸和氨基酸这3类碳源的利用上,可见人为的耕作会影响土壤性质及土壤微生物的结构[46],使得不同土壤对碳源的利用情况有所不同;此外,植物在生长过程中会持续向根部土壤释放糖类、氨基酸等有机物[47],并且碳水化合物和酚酸类能够分解土壤表层植物凋落物[48],这使得根际土壤的物理和化学环境不断改变,对根际微生物的种类和数量产生显著影响[49],这些影响可能是造成糖类对不同土地利用下土壤微生物群落代谢特征具有突出分异作用的主要原因。
4 结 论
1)黑龙江省黑土区不同的土地利用方式下土壤微生物群落数量及代谢功能存在差异:种植土豆的黑土可培养细菌数量(1.40×107CFU/g)最高,其次为水稻(1.17×106CFU/g)、大豆(6.47×105CFU/g)、玉米(4.37×105CFU/g),荒地的细菌数量(3.64×105CFU/g)最小但其可培养细菌多样性指数(2.18)最高,可见人为活动会对土壤微生物产生一定影响。
2)种植玉米的黑土中微生物对于各类碳源的代谢活性均较强,并且玉米土壤微生物的Shannon-Wiener指数(3.18)、McIntosh指数(5.96)、丰富度指数(24.89)、及Simpson指数()(0.95)比其他土地利用方式土壤微生物的多样性指数大,而种植水稻的黑土微生物对于各类碳源代谢活性均较低,多样性指数也较低,可见与水稻相比玉米较适宜黑龙江省黑土区土壤环境,所以在选择作物类型种植时可以优先考虑玉米。
3)4种土地利用方式中,黑土区土壤微生物碳源利用率最高的是氨基酸类,其次是糖类以及聚合类。糖类和氨基酸类是对土壤微生物群落代谢特征起分异作用的主要碳源类型,表明不同土地利用方式可以通过影响土壤有机物的输入,进而影响土壤微生物功能多样性。
[1] Huang Q, Wang J L, Wang C, et al. The 19-years inorganic fertilization increased bacterial diversity and altered bacterial community composition and potential functions in a paddy soil[J]. Applied Soil Ecology, 2019, 144: 60-67.
[2] Chen J H, Wu Q F, Li S H, et al. Diversity and function of soil bacterial communities in response to long-term intensive management in a subtropical bamboo forest[J]. Geoderma, 2019, 354.
[3] 范瑞英,杨小燕,王恩姮,等. 未干扰黑土土壤微生物群落垂直分布特征[J]. 土壤通报,2014,45(2):389-393.
Fan Ruiying, Yang Xiaoyan, Wang Enheng, et al. Vertical distribution characteristics of soil microbial communities in undisturbed black soil[J]. Chinese Journal of Soil Science, 2014, 45(2): 389-393. (in Chinese with English abstract)
[4] 田雅楠,王红旗. Biolog法在环境微生物功能多样性研究中的应用[J]. 环境科学与技术,2011,34(3):50-57.
Tian Ya’nan, Wang Hongqi. Application of biolog to study of environmental microbial function diversity[J]. Environmental Science & Technology, 2011, 34(3): 50-57. (in Chinese with English abstract)
[5] 席劲瑛,胡洪营,钱易. Biolog方法在环境微生物群落研究中的应用[J]. 微生物学报,2003(1):138-141.
Xi Jinying, Hu Hongying, Qian Yi. Application of biolog system in the study of microbial community[J]. Acta Microbiologica Sinica, 2003(1): 138-141. (in Chinese with English abstract)
[6] 及利,杨雨春,王君,等. 不同土地利用方式下酚酸物质与土壤微生物群落的关系[J]. 生态学报,2019,39(18):6710-6720.
Ji Li, Yang Yuchun, Wang Jun, et al. Relationship between soil phenolic acids and the soil microbial community under different land uses[J]. Acta Ecologica Sinica, 2019, 39(18): 6710-6720. (in Chinese with English abstract)
[7] Lopes J, Peixoto V, Coutinho A, et al. Determination of the community-level physiological profiles (CLPP) using Biolog TM ECO-plates in the river Lima estuary sediments (Northern Portugal), [C]//Proceedings of the International Meeting on Marine Research, Peniche. 2016.
[8] Paixão S M, Sàágua M C, Tenreiro R, et al. Assessing microbial communities for a metabolic profile similar to activated sludge[J]. Water Environ. Res, 2007, 79: 536–546.
[9] 邓娇娇,朱文旭,周永斌,等. 不同土地利用模式对辽东山区土壤微生物群落多样性的影响[J]. 应用生态学报,2018,29(7):2269-2276.
Deng Jiaojiao, Zhu Wenxu, Zhou Yongbin, et al. Effects of different land use patterns on the soil microbial community diversity in montane region of eastern Liaoning Province, China[J]. Chinese Journal of Applied Ecology, 2018, 29(7): 2269-2276. (in Chinese with English abstract)
[10] 朱珂,王蕊,李刚,等. 土地利用方式变化对白浆土微生物生物量碳及代谢特征的影响[J]. 农业环境科学学报,2018,37(10):2194-2201.
Zhu Ke, Wang Rui, Li Gang, et al. The response of microbial biomass carbon and metabolic characteristics of albic soil to land use change[J]. Journal of Agro-Environment Science, 2018, 37(10): 2194-2201. (in Chinese with English abstract)
[11] 秦红,李昌晓,任庆水. 不同土地利用方式对三峡库区消落带土壤细菌和真菌多样性的影响[J].生态学报,2017,37(10):3494-3504.
Qin Hong, Li Changxiao, Ren Qingshui, et al. Effects of different land use patterns on soil bacterial and fungal biodiversity in the hydro-fluctuation zone of the Three Gorges Reservoir region[J]. Acta Ecologica Sinica, 2017, 37(10): 3494-3504. (in Chinese with English abstract)
[12] 崔海山,张柏,于磊,等. 中国黑土资源分布格局与动态分析[J]. 资源科学,2003,25(3):64-68.
Cui Haishan, Zhang Bai, Yu Lei, et al. Pattern and change of black soil resources in China[J]. Resources Science, 2003, 25(3): 64-68. (in Chinese with English abstract)
[13] 赵文,尹亚丽,李世雄,等. 植被重建对黑土滩草地植被及微生物群落特征的影响[J]. 生态环境学报,2020,29(1):71-80.
Zhao Wen, Yin Yali, Li Shixiong, et al. Effects of vegetation reconstruction on vegetation and microbial community characteristics of black soil beach grassland[J]. Ecology and Environment, 2020, 29(1): 71-80. (in Chinese with English abstract)
[14] 唐杰,徐青锐,王立明,等. 若尔盖高原湿地不同退化阶段的土壤细菌群落多样性[J]. 微生物学通报,2011,38(5):677-686.
Tang Jie, Xu Qingrui, Wang Liming, et al. Soil bacterial community diversity under different stages of degradation in zoige wetland[J]. Microbiology China, 2011, 38(5): 677-686. (in Chinese with English abstract)
[15] 张淑花,周利军,张雪萍. 基于RUSLE 和GIS 的绥化市土壤侵蚀评估[J]. 土壤通报,2011,42(4):958-961.
Zhang Shuhua, Zhou Lijun, Zhang Xueping. Evaluation on soil erosion in Suihua based on RUSLE and GIS[J]. Chinese Journal of Soil Science, 2011, 42(4): 958-961. (in Chinese with English abstract)
[16] 李勇,赵军,王毅博,等. WebGIS支持下的黑土农田施肥决策支持系统:以黑龙江省双城市为例[J]. 水土保持通报,2009,29(6):193-197.
Li Yong, Zhao Jun, Wang Yibo, et al. Developing a WebGIS fertilizer decision support system in black soil zone of northeast China: A case study of Shuangcheng county in Heilongjiang province[J]. Bulletin of Soil and Water Conservation, 2009, 29(6): 193-197. (in Chinese with English abstract)
[17] 蔡信之,黄君红. 微生物学[M]. 北京:高等教育出版社,2006.
[18] 兰晓君,肖婷,邝海菊,等. 金川镍矿可培养细菌的多样性及耐镍菌株筛选[J]. 生物技术,2009,19(4):22-26.
Lan Xiaojun, Xiao Ting, Kuang Haiju, et al. Culturable bacterial diversity in Jinchuan nickel mine and screen of the ni-tolerance strains[J]. Biotechnology, 2009, 19(4): 22-26. (in Chinese with English abstract)
[19] Kawai M, Matsutera E, Kanda H, et al. 16S ribosomal DNA-based analysis of bacterial diversity in purified water used in pharmaceutical manufacturing processes by PCR and denaturing gradient gel electrophoresis[J]. Applied and Environmental Microbiology, 2002, 68(2): 699-704.
[20] 胡元森,李翠香,孙富林,等. 不同培养基组合提高土壤细菌可培养性的研究[J]. 微生物学报,2007,47(5):882-887.
Hu Yuansen, Li Cuixiang, Sun Fulin, et al. Improved culturability of soil bacteria using proper combination with various culturing medium[J]. Acta Microbiologica Sinica, 2007, 47(5): 882-887. (in Chinese with English abstract)
[21] 鲍士旦. 土壤农化分析[M]. 北京:中国农业出版社,2000.
[22] 鲁如坤. 土壤农业化学分析方法[M]. 北京:中国农业科技出版社,1999.
[23] Schutter D J, Van H J, d'Alfonso A A, et al. Effects of slow rTMS at the right dorsolateral prefrontal cortex on EEG asymmetry and mood[J]. Neuroreport, 2001, 12(3): 445-447.
[24] Deng J J, Zhou Y B, Bai X J, et al. Soil microbial functional diversity responses to different revegetation types in Baishilazi Nature Reserve[J]. Polish Journal of Enviromental Studies, 2019, 28(5): 3675-3686.
[25] 陈梦. 对生态系统及生物多样性等理论问题的探讨[J]. 南京林业大学学报:自然科学版,2003,27(5):30-34.
Chen Meng. Discussion on the theory of ecosystem and biodiversity[J]. Journal of Nanjing Forestry University: Natural Science Edition, 2003, 27(5): 30-34. (in Chinese with English abstract)
[26] Michiel R, Marja W, Sytske M D, et al. Monitoring soil bacteria with community-level physiological profiles using Biolog™ ECO-plates in the Netherlands and Europe[J]. Applied Soil Ecology, 2016, 97.
[27] 张雪艳,田永强,高艳明,等. 温室黄瓜不同栽培制度对土壤微生物群落功能结构的影响[J]. 园艺学报,2011,38(7):1317-1324.
Zhang Xueyan, Tian Yongqiang, Gao Yanming, et al. The effect of different cultivation systems in greenhouse cucumber on soil microbial function structure[J]. Acta Horticulturae Sinica, 2011, 38(7): 1317-1324. (in Chinese with English abstract)
[28] Haack S K, Garchow H, Klug M J, et al. Analysis of factors affecting the accuracy, reproducibility, and interpretation of microbial community carbon source utilization patterns[J]. Applied and Environmental Microbiology, 1995, 61(4): 1458-1468.
[29] 张海涵,唐明,陈辉. 黄土高原典型林木根际土壤微生物群落结构与功能特征及其环境指示意义[J]. 环境科学,2009,30(8):2432-2437.
Zhang Haihan, Tang Ming, Chen Hui. Characterization of soil microbial community function and structure in rhizosphere of typical tree species and the meaning for environmental indication in the Loess Plateau[J]. Environmental Science, 2009, 30(8): 2432-2437. (in Chinese with English abstract)
[30] 刘君,王宁,崔岱宗,等. 大小兴安岭可培养细菌的资源多样性[J]. 生物多样性,2019,27(8):903-910.
Liu Jun, Wang Ning, Cui Daizong, et al. Diversity of bacterial resources in the Greater and Lesser Khinggan Mountains[J]. Biodiversity Science, 2019, 27(8): 903-910. (in Chinese with English abstract)
[31] 叶姜瑜,罗固源. 微生物可培养性低的生态学释因与对策[J]. 微生物学报,2005,45(3):478-482.
Ye Jiangyu, Luo Guyuan. Ecological interpretation and related strategies for low culturability of microorganisms[J]. Acta Microbiologica Sinica, 2005, 45(3): 478-482. (in Chinese with English abstract)
[32] 陈义光,李汇明,李沁元,等. 一平浪盐矿古老岩盐沉积中可培养细菌的系统发育多样性研究[J]. 微生物学报,2007,47(4):571-577.
Chen Yiguang, Li Huiming, Li Qinyuan, et al. Phylogenetic diversity of culturable bacteria in the ancient salt depositsof the Yipinglang Salt Mine, P.R.China[J]. Acta Microbiologica Sinica, 2007, 47(4): 571-577. (in Chinese with English abstract)
[33] 孙权,陈茹,宋乃平,等. 宁南黄土丘陵区马铃薯连作土壤养分、酶活性和微生物区系的演变[J]. 水土保持学报,2010,24(6):208-212.
Sun Quan, Chen Ru, Song Naiping, et al. Change trends of soil nutrients, enzyme activities, and microbial composition in continuous potato cropping system in semi-arid and cool hilly area of Ningxia[J]. Journal of Soil and Water Conservation, 2010, 24(6): 208-212. (in Chinese with English abstract)
[34] 章家恩,刘文高,胡刚. 不同土地利用方式下土壤微生物数量与土壤肥力的关系[J]. 土壤与环境,2002,11(2):140-143.
Zhang Jiaen, Liu Wengao, Hu Gang. The relationship between quantity index of soil microorganisms and soil fertility of different land use systems[J]. Soil and Environmental Sciences, 2002, 11(2): 140-143. (in Chinese with English abstract)
[35] 沈萍,陈向东. 微生物学[M]. 北京:高等教育出版社, 2006.
[36] 孟庆杰,许艳丽,李春杰,等. 不同植被覆盖对黑土微生物功能多样性的影响[J]. 生态学杂志,2008,27(7):1134-1140.
Meng Qingjie, Xu Yanli, Li Chunjie, et al. Effects of different vegetation coverage on microbial functional diversity in black soil[J]. Chinese Journal of Ecology, 2008, 27(7): 1134-1140. (in Chinese with English abstract)
[37] 曹宏杰,王立民,徐明怡,等. 五大连池新期火山熔岩台地不同植被类型土壤微生物群落功能多样性[J]. 生态学报,2019,39(21):7927-7937.
Cao Hongjie, Wang Limin, Xu Mingyi, et al. Effect of vegetation type on the diversity of soil microbial communities at the new stage Volcanic Lava Platform, Wudalianchi area, Northeast China[J]. Acta Ecologica Sinica, 2019, 39(21): 7927-7937. (in Chinese with English abstract)
[38] 宋贤冲,王会利,秦文弟,等. 退化人工林不同恢复类型对土壤微生物群落功能多样性的影响[J]. 应用生态学报,2019,30(3):841-848.
Song Xianchong, Wang Huili, Qin Wendi, et al. Effects of stand type of artificial forests on soil microbial functional diversity[J]. Chinese Journal of Applied Ecology, 2019, 30(3): 841-848. (in Chinese with English abstract)
[39] 陈悦,吕光辉,李岩. 独山子区优势草本植物根际与非根际土壤微生物功能多样性[J]. 生态学报,2018,38(9):3110-3117.
Chen Yue, Lü Guanghui, Li Yan. Soil microbial functional diversity of rhizosphere and non-rhizosphere of three dominant herbaceous plants in the Dushanzi District[J]. Acta Ecologica Sinica, 2018, 38(9): 3110-3117. (in Chinese with English abstract)
[40] 谭红妍,陈宝瑞,闫瑞瑞,等. 草地土壤微生物特性及其对人为干扰响应的研究进展[J]. 草地学报,2014,22(6):1163-1170.
Tan Hongyan, Chen Baorui, Yan Ruirui, et al. Advances on soil microbiological characteristics of grassland ecosystems and its response to human disturbances[J]. Acta Agrectir Sinica, 2014, 22(6): 1163-1170. (in Chinese with English abstract)
[41] 赵吉,廖仰南,张桂枝,等. 草原生态系统的土壤微生物生态[J]. 中国草地,1999(3):58-68.
Zhao Ji, Liao Yangnan, Zhang Guizhi, et al. Soil microbial ecology on the grassland ecosystem[J]. Grassland of China, 1999(3): 58-68. (in Chinese with English abstract)
[42] 刘株秀,刘俊杰,徐艳霞,等. 不同大豆连作年限对黑土细菌群落结构的影响[J]. 生态学报,2019,39(12):4337-4346.
Liu Zhuxiu, Liu Junjie, Xu Yanxia, et al. Effects of continuous cropping years of soybean on the bacterial community structure in black soil[J]. Acta Ecologica Sinica, 2019, 39(12): 4337-4346. (in Chinese with English abstract)
[43] 张红,吕家珑,曹莹菲,等. 不同植物秸秆腐解特性与土壤微生物功能多样性研究[J]. 土壤学报,2014,51(4):743-752.
Zhang Hong, Lü Jialong, Cao Yingfei, et al. Decomposition characteristics of different plant straws and soil microbial functional diversity[J]. Acta Pedologica Sinica, 2014, 51(4): 743-752. (in Chinese with English abstract)
[44] 罗鑫,张海燕,刘明元,等. 稻田土壤微生物群落多样性研究进展[J]. 安徽农业科学,2018,46(21):42-43,47.
Luo Xin, Zhang Haiyan, Liu Mingyuan, et al. Study review on microbial community diversity in paddy soils[J]. Journal of Anhui Agricultural Sciences, 2018, 46(21): 42-43, 47. (in Chinese with English abstract)
[45] 张海芳,李刚,宋晓龙,等. 内蒙古贝加尔针茅草原不同利用方式土壤微生物功能多样性[J]. 生态学杂志,2012,31(5):1143-1149.
Zhang Haifang, Li Gang, Song Xiaolong, et al. Functional diversity of soil microbial communities in Stipa baicalensis steppe in Inner Mongolia as affected by different land use patterns[J]. Chinese Journal of Ecology, 2012, 31(5): 1143-1149. (in Chinese with English abstract)
[46] 潘莹,胡正华,吴杨周,等. 保护性耕作对后茬冬小麦土壤CO2和N2O排放的影响[J]. 环境科学,2014,35(7):2771-2776.
Pan Ying, Hu Zhenghua, Wu Yangzhou, et al. Effects of conservation tillage on soil CO2and N2O emission during the following winter-wheat season[J]. Environmental Science, 2014, 35(7): 2771-2776. (in Chinese with English abstract)
[47] 李骁,王迎春. 土壤微生物多样性与植物多样性[J]. 内蒙古大学学报:自然科学版,2006,37(6):708-713.
Li Xiao, Wang Yingchun. The biodiversity of soil microbes and plants[J]. Journal of Inner Mongolia University: Natural Science Edition, 2006, 37(6): 708-713. (in Chinese with English abstract)
[48] Lorenz K, Preston C M, Krumrei S, et al. Decomposition of needle/leaf litter from Scots pine,black cherry,common oak and European beech at a conurbation forest site[J]. European Journal of Forest Research, 2004, 123(3): 177-188.
[49] Kowalchuk G A, Buma D S, de Boer W, et al. Effects of above-ground plant species composition and diversity on the diversity of soil-borne microorganisms[J]. Antonie van Leeuwenhoek, 2002, 81(1/4): 509- 520.
Soil microbial diversity of black soil under different land use patterns in northeast China
Jia Pengli, Feng Haiyan※, Li Miao
(,,100083,)
Soil microorganisms participate in the energy flow and nutrient cycle of soil ecosystem, affecting the geochemical cycle process of organisms. Their diversity and community compositions play an important role in determining the function and sustainability of soil ecosystem. The functional diversity of soil microbial community is one of the important indexes to express the soil microbial community and ecological function. Soil microbial diversities of black farmland under different land use types are of great significance to the rational utilization and protection of soil resources. This paper explored the diversity of black soil microorganisms under different land use patterns of farmland, including maize, rice, soybean and potato, and taking the wasteland as the control. The Biolog Eco microplate method and pure culture of bacteria were used to study the changes of soil microbial diversity under four different land use patterns in the black soil area of central and southwest Heilongjiang province. The results showed that: 1) The number of culturable bacteria from more to less were potato, rice, soybean, maize, wasteland, but the variation of Shannon-Wiener diversity index from high to lowwas: wasteland (2.18), maize (2.11), potato (2.00), rice (1.73), soybean (1.49). 2) The utilization degree of carbon source of microorganisms in black soil under different utilization patterns increased with the extension of culture time. We found that amino acids, carbohydrates and polymers were main carbon sources for the metabolism of microorganisms in black soil. The Shannon-wiener index (3.18), McIntosh index (5.96), richness index (24.89) and Simpson index (0.95) of maize soil microorganisms were higher than those of other land use patterns, among which the diversity index of rice soil microorganisms was the smallest. There was no significant difference between the diversity index of potato, soybean and wasteland. Maize was better suited to the soil environment of farmland in the black soil area of Heilongjiang Province. 3) Principal component analysis identified two principal component factors that were related to carbon sources and explained 54.43% and 7.95% of the variance, respectively. Principal component analysis showed that different land use patterns significantly affects the metabolic diversity of carbon sources in the soil microbial community, and the main types of carbon sources that differentiated the metabolic characteristics of the soil microbial community were carbohydrates, amino acids and carboxylic acids, among which carbohydrates were particularly prominent. It showed that different land use patterns can affect the functional diversity of soil microorganisms. The results of this study is helpful to understand the relationship between soil microbial diversity and land use patterns of farmland in black soil area and provides certain scientific basis for agricultural development and scientific and rational utilization of black soil resources.
land use;soils; microorganisms; black soil area; functional diversity; Biolog-Eco
贾鹏丽,冯海艳,李淼. 东北黑土区不同土地利用方式下农田土壤微生物多样性[J]. 农业工程学报,2020,36(20):171-178.doi:10.11975/j.issn.1002-6819.2020.20.020 http://www.tcsae.org
Jia Pengli, Li Miao, Feng Haiyan, et al. Soil microbial diversity of black soil under different land use patterns in northeast China[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(20): 171-178. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.20.020 http://www.tcsae.org
2020-06-17
2020-08-26
国家自然科学基金资助项目(41401286);国土资源部公益性行业科研专项(200911020-01);中央高校基本科研业务费专项(2010ZY15)
贾鹏丽,主要从事应用地球化学研究。Email:1390843008@qq.com
冯海艳,副教授,主要从事应用地球化学研究。Email:haiyan@cugb.edu.cn
10.11975/j.issn.1002-6819.2020.20.020
P593
A
1002-6819(2020)-20-0171-08
