基于荧光的纳米药物共聚焦内窥成像系统设计
2020-12-24王飞龙李韪韬童云坤李怡燃
王飞龙,陶 玲,李韪韬,童云坤,李怡燃
(南京航空航天大学自动化学院,南京210016)
0 引言
纳米药物因其特有的优势成为当今药物研究的热点,但其临床转化效率较低,最终能投入临床使用的纳米药物极少。在临床研究淘汰的药物中,约40%的候选药物不能进入临床是因为药代动力学行为不符合治疗的需求[1-3]。纳米药物在体内的转运、分布、释放等与其疗效密切相关,是评价其临床转化可能性的关键,特别是实现靶细胞内的转运及释放特性的高分辨显微成像,对纳米药物的临床前基础研究具有重要意义。
光学显微技术具有高分辨力细胞内药物转运的监测功能,已成为纳米药物转运特性研究的重要手段,但不能实现活体动物深层次组织内细胞的药代动力学特性研究。激光共聚焦内窥镜具有亚微米级分辨力,是目前唯一一种能够进行细胞成像的内窥镜仪器[4]。Goetz 等[5]使用共聚焦内窥镜检查活体结肠癌表皮生长因子受体的不同表达量,结果表明共聚焦内窥镜可以在活体内进行肿瘤标记分子成像预测性判断,有助于预测病变风险并揭示纳米药物靶向性效果。由于激光共聚焦内窥镜产品突破了传统荧光显微镜需要制作离体样本、活体成像深度不足的限制,近年来国内越来越多的研究小组对共聚焦内窥镜进行了研究。如Du 等[6]研制的共聚焦内窥成像系统使用望远式显微内窥光学系统,实现长距离的图像中继传输、远心f-theta 光学扫描和显微内窥镜成像功能,分辨力约为2.2 μm;张红明[7]研发的基于光纤束的共聚焦内窥成像系统通过振镜实现X 和Y 轴的快速扫描,其分辨力约为4 μm。目前,常用的共聚焦内窥成像系统通常只有一个激发波长,这就限制了荧光染料的选择范围,发展具有多个激发波长的共聚焦系统用于更宽的荧光染料光谱具有重要意义[8-9]。
为研究纳米药物在靶细胞内的转运及释放特性,需要对纳米壳、包裹药物、靶细胞膜分别进行标记,因此需要多色激发光多通道采集荧光。本文设计了一套基于荧光的双色激光共聚焦内窥成像系统,通过对3 个通道荧光采集成像能力以及视场和分辨力进行测试,表明本系统可以满足对纳米药物靶细胞内转运及释放特性监测的要求。
1 系统设计与实现
1.1 整体设计方案
系统整体设计方案如图1 所示,包括激光光源模块、光纤荧光显微成像模块和软件及控制系统模块3 个部分。
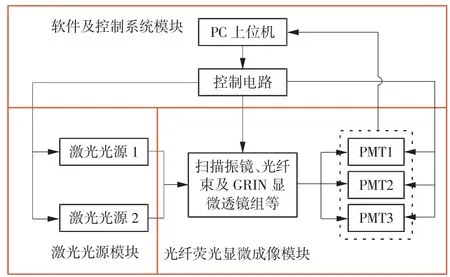
图1 基于荧光的纳米药物共聚焦内窥成像系统总体结构图
激光光源模块包括2 个波长为488 和650 nm的激光器,为标记纳米壳、包裹药物和靶细胞膜的荧光染料提供激发光。光纤荧光显微成像模块由扫描振镜、光纤束、梯度折射率(gradient refractive index,GRIN)显微透镜组、光电倍增管(photomultiplier tube,PMT)等核心部件组成,采用激光扫描共聚焦方式对特定靶组织进行显微荧光成像,以反映纳米药物在细胞内的分布和释放状况,分析纳米药物在细胞内的转运特性,揭示其作用机制。软件及控制系统模块包括PC 上位机软件和控制电路。上位机软件的开发基于LabWindows 平台,利用MATLAB 提供的ActiveX 服务控件实现LabWindows 与MATLAB 的混合编程,通过对MATLAB 的控制进而控制Scan-Image 开源软件采集细胞图像数据[10-12]。该模块的主要功能为控制仪器按时序工作和采集数据,并通过软件包含的成像算法进行图像的存储、处理和显示。
1.2 光路设计
本系统光路结构如图2 所示,包含2 条激发光路和3 条探测光路。

图2 基于荧光的纳米药物共聚焦内窥成像系统光路结构示意图
双波长激光由488 和650 nm 的半导体连续激光器发射,分别对应图2 中蓝色的Laser1 和红色的Laser2。波长为488 nm 的激发光用于激发标记纳米壳的荧光染料FITC 和标记细胞膜的荧光染料DiA;波长为650 nm 的激发光用于激发标记包裹药物的荧光染料R3。488 nm 激发光经过反光镜M1 到达双向色镜DM1 被反射,650 nm 激发光透过DM1,2 路激光进入双向色镜DM2,DM2 反射488 和650 nm 2种波长的激发光,且透过3 种荧光染料产生的520、620 和730 nm 波长的荧光。物镜OBJ1、50 μm 的小孔MP 和物镜OBJ2 组合,阻挡成像焦平面以外的杂散光,增强图像的对比度,提高图像分辨力。接着2路激光到达扫描振镜GM 进行光束扫描,进入透镜L1 和L2 组成的4f 系统对扫描光束进行调整后进入物镜OBJ3,物镜OBJ3 将扫描的激光光束耦合到传像光纤束FB(≥30 000 根)中,通过光纤束后的激光再经过微透镜L3 耦合到GRIN Lens 中进一步压缩光斑,通过GRIN Lens 实现对组织样品中的荧光染料的扫描激发。
荧光信号通过GRIN Lens 收集沿原光路返回,进入靶细胞成像光路的探测部分。靶细胞成像3 条探测光路分别为:标记纳米壳的荧光染料FITC 产生的荧光被双向色镜DM3 反射到探测光路,经过滤光片F1 滤掉非信号光后,进入光电倍增管PMT1 进行光电转换,最后根据激光扫描及荧光信号采集相对应的时间,实现焦平面上各扫描点荧光信号的提取,并通过图像重建获得纳米壳荧光显微图像;标记细胞膜的荧光染料DiA 产生的荧光信号被双向色镜DM4 反射到探测光路,经过滤光片F2 后,被PMT2转换为光电信号由系统软件实现细胞膜高分辨力荧光图像的生成;标记包裹药物的荧光染料R3 产生的荧光通过双向色镜DM2 进入到探测光路,滤光片F3 滤除非荧光干扰信号,然后经过光电倍增管PMT3 转换为电信号导入上位机系统获取包裹药物高分辨显微图像。
2 路激发光产生的3 种荧光实时成像,就可以同时看到包裹药物的分布荧光图、纳米壳的分布荧光图和细胞膜的分布图,而且通过实时监测这3 种图像的变化,可以有效研究纳米药物的跨膜过程、纳米药物的泄漏及控制释放过程,以系统地研究纳米药物的细胞药代动力学特性。
2 实验及结果
2.1 视场大小及分辨力测定
由于光纤探头中GRIN Lens 的工作距离仅为80 μm,且只能对荧光成像,因此没有合适的标准样品能够直接测量系统的分辨力。本文基于荧光小球移动对比成像实验,对本系统的视场大小和成像分辨力进行测定。
本实验使用直径为500 nm 的荧光小球,激发峰值约为488 nm,可被488 nm 激光激发,发射峰值约为515 nm,激发荧光可被FITC 成像光路接收,荧光图像如图3(a)所示;通过移动荧光小球,获取荧光小球移动前后像素点坐标差和移动实际距离,便可求出一个像素点代表的实际长度。本次实验在三轴位移台X、Y 轴方向上分别移动3 次,重复试验取平均值,实验数据见表1。
表1 中一个像素点代表的实际长度为0.147 μm,图像尺寸为1 024 像素×1 024 像素,则本系统成像视场大小约为150.5 μm。忽略图像中光纤丝间间隔的影响,以图3(b)中荧光小球的半高全宽(full width at half maxima,FWHM)作为系统的横向分辨力,得到其高斯拟合曲线如图3(c)所示,可知本系统横向分辨力约为0.523 μm。

图3 荧光小球成像结果

表1 像素点代表实际长度实验数据
2.2 细胞成像
为了验证本系统对细胞成像的能力,使用U87脑胶质瘤细胞制作细胞爬片,对FITC、DiA、R3 3 种荧光染料标记的细胞爬片进行成像,如图4 所示。FITC 和R3 将细胞质染色,DiA 为膜染色剂,仅将细胞膜染色。从FITC 和R3 染色的荧光图像可观察到:细胞形态清晰,大小基本一致,在细胞爬片上分布均匀且无重叠。从DiA 染色的细胞图像可观察到:DiA 染色不均,右侧3 个细胞膜染色较好,荧光强度较高,左侧细胞的细胞膜荧光强度虽然低,但依旧可以分辨出细胞形态。将FITC、DiA 和R3 3 种荧光染料的荧光图像融合后,可发现图像中FITC 和R3 染色的细胞质被DiA 染色的细胞膜包裹,边界清晰。实验结果表明,染料FITC、DiA 和R3 对应的荧光激发和采集通道工作正常,成像结果清晰无误,本系统能同时对细胞中被FITC 和R3 标记的纳米药物、被DiA 标记的细胞膜进行高分辨显微成像,进而观察纳米药物跨膜转运特性。

图4 FITC、DiA 和R3 及其混合染色细胞成像图
3 结语
本文基于LabWindows 和MATLAB 开发平台,结合ScanImage 开源软件,研制了一套基于光纤束、双色激发光、三通道荧光采集、具有高分辨力的纳米共聚焦内窥成像系统。本系统的视场大小以及分辨力通过荧光小球成像对比实验进行了测试,对纳米药物靶细胞内转运及释放特性的高分辨显微成像能力在U87 脑胶质瘤细胞成像实验上得到了证实,为纳米药物临床前基础研究提供了一定手段。目前,本文的实验还处于离体阶段,未来需进一步开展在体实验等相关工作,发现系统存在的问题并进行改进。另外,系统所使用的传像光纤束因其光纤丝蜂窝状排列带来了固有噪声,降低了图像分辨力和对比度,后期可以使用滤波平滑或插值重建等图像处理算法对荧光图像进行处理,以解决图像像素化的问题。
