缺血性脑卒中伴胃肠功能障碍患者胃肠激素和肠屏障功能改变
2020-12-24张艳凯高翔王金玉段宝民开封市中心医院全科医学科河南开封475000
张艳凯 高翔 王金玉 段宝民 (开封市中心医院全科医学科,河南 开封 475000)
脑卒中是一种由脑血管破裂出血或脑血管阻塞引发的脑实质损伤的一组临床综合征,临床上最为常见的是缺血性脑卒中〔1,2〕。脑卒中的发生基础和机制并未得到完全阐明,目前认为与家族遗传、脑血管动脉粥样硬化、高脂饮食和高龄等因子密切相关〔3〕。缺血性脑卒中是一种高致死性疾病,《全国第三次死因回顾抽样调查报告》显示,2004~2005年脑卒中已然超过恶性肿瘤成为中国居民首位死亡原因〔4,5〕。部分患者在脑卒中的急性期即可因严重脑功能受损而死亡,而更多的患者有幸度过急性期后却因并发症而死亡〔6〕。胃肠功能障碍是缺血性脑卒中患者最为常见的并发症之一,虽然胃肠功能异常所产生的临床症状并不激烈和突出,但会对患者的内环境造成持久不利作用,并可能影响总体预后。胃肠功能障碍不仅会影响患者的营养物质摄入,还会引发肠屏障功能障碍,并进而引发细菌移位等系统性改变。
鉴于老年缺血性脑卒中发病率的不断增加及胃肠功能障碍对病程的负面作用,本文分析并发胃肠功能障碍的老年缺血性脑卒中患者胃肠激素、肠屏障功能和系统性炎症反应的改变。
1 资料与方法
1.1研究对象 纳入2016年1月至2019年9月开封市中心医院接受诊疗的老年脑卒中患者89例。纳入标准:依据影像学检查明确诊断为缺血性脑卒中,且为首次发病;患者年龄≥60岁。排除标准:合并颅内其他器质性病变;合并恶性肿瘤等终末期疾病;合并严重肝肾功能障碍;发病前合并严重胃肠功能障碍;合并活动性感染;临床资料缺失不全。依据发病2 w后是否出现胃肠功能障碍分为观察组(出现)和对照组(未出现)。两组性别、年龄、体重指数(BMI)、合并糖尿病、合并高血压均未见显著差异。见表1。
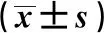
表1 两组一般临床资料比较
1.2标准和检测 缺血性脑卒中诊断依据头颅CT/磁共振成像(MRI),诊断标准参考中华医学会神经病学分会制定的《中国各类主要脑血管病诊断要点》〔7〕。胃肠功能障碍的诊断参考欧洲重症监护医学会制定的急性胃肠道损伤分级,达到Ⅱ级或以上标准,即:胃肠功能受损而无法耐受饮食或肠内营养,出现腹痛、腹泻、腹胀等症状需要干预治疗〔8〕。
两组均于住院后接受同一组医师施行的治疗,并于治疗2 w后采集静脉血5 ml,离心后取血清冻存(-80℃)。采用酶联免疫吸附试验检测如下指标:1)胃肠激素水平:胃泌素(GAS)、胃动素(MTL)和血管活性肠肽(VIP);2)肠屏障功能:二胺氧化酶(DAO)、内毒素和D-乳酸(D-Lac);3)炎症指标:白细胞介素(IL)-6、肿瘤坏死因子(TNF)-α和IL-1β。
1.3统计学方法 采用SPSS17.0软件进行t检验、χ2检验。
2 结 果
2.1两组胃肠激素水平比较 观察组GAS和MTL水平均显著低于对照组、外周血VIP水平显著高于对照组(均P<0.01)。见表2。

表2 两组胃肠激素水平比较
2.2两组肠屏障功能指标比较 观察组外周血DAO、内毒素和D-Lac水平均显著高于对照组(P<0.01)。见表3。
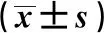
表3 两组肠屏障功能指标比较
2.3两组外周血炎症指标比较 观察组外周血IL-6、TNF-α和IL-1β水平均显著高于对照组(P<0.01),见表4。

表4 两组外周血炎症指标比较
3 讨 论
缺血性脑卒中患者度过危险期后其预后主要取决于受损脑组织的范围和程度及良好的术后功能训练〔9~11〕。而这些后续治疗都是基于患者有一个稳定的内环境,能够支持长期的康复治疗〔11〕。老年患者本身处于各种生理功能退化时期,自稳调节能力有限,容易产生各种脑卒中后并发症。胃肠功能障碍是缺血性脑卒中后常见并发症,主要表现为腹胀、便秘、腹泻、食物或营养不耐受。此时患者不仅仅面临营养供给困难问题,还可在此基础上继发胃肠激素水平紊乱、肠道细菌/毒素移位及系统性应激/炎症反应。
GAS是一种主要由分布在人体胃、肠中的G细胞所分泌的胃肠激素,其作用范围较广,几乎作用于全胃肠道,发挥促进胃肠道蠕动、促进胃肠激素分泌及参与胃肠道黏膜上皮修复的作用。MTL是一种主要由小肠分泌的消化道激素,参与对水、电解质等物质的吸收过程,并调控肠道节律性收缩运动。MTL紊乱可能导致腹痛、腹泻或腹胀等胃肠功能障碍表现。VIP也称为舒血管肠肽,可由肠神经元细胞分泌,并作为一种神经递质广泛参与肠神经系统的调控;其在消化道主要功能是舒张肠道平滑肌,表达过高可导致肠道运输功能障碍,并引发腹胀、便秘症状。本研究结果显示合并胃肠功能障碍的缺血性脑卒中患者存在胃肠激素紊乱,这可能是导致患者产生一系列消化系统症状的原因。
DAO是一种主要分布于人体小肠黏膜上皮绒毛中的细胞内酶,其在胺类代谢中发挥关键作用,本身具有较高的细胞毒性〔12〕。正常情况下DAO的合成有限,在肠上皮细胞受损过程中,DAO可伴随肠上皮细胞核损伤和修复而表达升高〔13〕。因此,DAO是一种反映肠上皮细胞屏障的良好指标〔14〕。内毒素是多种革兰阴性菌细胞壁的主要构成物质之一,由于其磷脂多糖-蛋白质复合物的化学性质,使内毒素具有抗原性〔15〕。在肠屏障功能正常情况下,内毒素无法通过肠道进入血液,但在肠屏障功能受损情况下内毒素可通过肠道进入血液,并通过其类脂质A毒性成分引发凝血障碍、发热等症状。因而内毒素也是一种反映肠屏障功能的常用临床指标〔13,15〕。D-Lac是多种肠道细菌的共同代谢产物,正常情况下其不能够通过肠道进入血液,当肠屏障功能受损时D-Lac可通过肠道发生移位。因而,D-Lac是一种可反映肠上皮细胞屏障功能的指标〔16〕。外周血DAO、内毒素和D-Lac在老年脑卒中患者外周血中水平升高,提示伴有胃肠功能障碍的患者出现了明显的肠屏障功能障碍。事实上,肠屏障功能是人体重要的屏障系统,其发挥重要的隔绝肠道内有害毒素、微生物的重要功能,其功能受损将引发严重的内环境紊乱。研究显示脑卒中患者同时伴有肠道菌群紊乱,致病性大肠埃希菌比例升高,提示原发病与肠道微生态的相互作用共同影响肠屏障功能〔17,18〕。
IL-6是一种经典的促炎介质,其参与多种急慢性炎症,并在急性炎症的级联放大和慢性炎症的维持过程中发挥关键媒介作用〔19〕。而TNF-α和IL-1β主要由巨噬细胞、T淋巴细胞表达,在促进巨噬细胞M1方向极化和T淋巴细胞Th1方向极化上发挥关键作用〔20〕。巨噬细胞和Th1淋巴细胞的过度活化可导致系统性炎症反应,对于受损脑组织局部的修复产生不利影响〔19〕。分析认为,外周血炎症介质水平升高可能源于肠屏障功能的破坏,受损肠屏障导致细菌和内毒素进入外周血可引发炎症反应;同时肠道局部炎症介质水平升高可以直接破坏肠上皮细胞〔21〕。此外,肠屏障功能紊乱本身导致的营养障碍、内环境紊乱也可加剧系统性炎症反应。虽然具体机制仍然需要进一步研究以明确,但过高水平的炎症介质水平对患者的预后将产生不利影响。
关于缺血性脑卒中患者并发胃肠功能障碍的原因尚不十分明确,但可能的原因包括:消化系统的吸收、运动和组织修复等生理功能均接受高级神经的调控,缺血性脑卒中导致的神经功能缺损可能是引发胃肠功能障碍的原因之一;缺血性脑卒中患者伴有严重的系统性应激和进食困难,这可能导致患者经口进食困难,而胃肠道上皮细胞的部分关键营养物质直接来源于肠道内食物,这可能引发肠道功能障碍;此外,缺血性脑卒中患者存在胃肠道激素水平紊乱,这也可能导致胃肠功能紊乱。
