Fe2O3@Cu-MOF非均相光-Fenton催化剂的制备及性能
2020-12-23薛晓晓翁育靖杨世诚王晓龙孟士航张玉龙
薛晓晓 ,翁育靖 ,杨世诚 ,王晓龙 ,孟士航 ,张玉龙
(1.河南理工大学化学化工学院,河南焦作454000;2.河南省煤炭绿色转化重点实验室,河南焦作454000)
工业废水具有毒性大、成分复杂、色度深及难降解等特点〔1〕。传统治理方法有化学氧化法、离子交换法和吸附法〔2〕,但对于废水中有机污染物的处理仍未达到人们的期待。因此,迫切需要寻找更加可靠、有效、简便的废水处理方案。
金属有机骨架化合物(MOFs)是在沸石和金属磷化物的基础上制备而成,主要由2部分组成,分别为有机配体(一般含有O、N、S等配位原子)和无机金属中心,通过自组装形成晶态多孔材料〔3〕。这种材料具有微孔或中孔结构〔4〕,结构多样、比表面积高、孔道规则,可应用在药物传运、气体储存、催化、吸附和传感等方面。Fenton技术在食品添加剂、印染和造纸等有机污染治理中取得较好效果〔5〕,但仍存在一些缺陷,如反应条件呈酸性、自身铁泥难除、存在二次污染等〔6〕。非均相Fenton技术不仅可保证降解效果,还克服了原有的许多缺点,近年来得到众多关注。非均相Fenton技术的关键在于载体选择,目前已有以树脂〔7〕和沸石〔8〕为载体制备非均相 Fenton 复合型催化剂的报道,在废水处理中具有很好的应用前景。
笔者以MOF材料为载体,通过一步晶化法制备出Fe2O3@Cu-MOF新型非均相光-Fenton复合催化剂,在可见光条件下对罗丹明B(RhB)溶液进行降解,取得良好效果。
1 实验部分
1.1 实验材料及仪器
试剂:罗丹明B、N,N-二甲基甲酰胺、过氧化氢(分析纯),天津市科密欧化学试剂开发中心。1,3,5-苯三甲酸(质量分数98%)、纳米三氧化二铁(质量分数99.5%),上海麦克林生化科技有限公司。硝酸铜(分析纯),天津市风船化学试剂科技有限公司。无水乙醇(体积分数99%),天津市科密欧化学试剂有限公司。
仪器:FA2004电子天平,上海津平科学仪器有限公司;MICROSOLAR300氙灯光源,北京泊菲莱科技有限公司;HN101-0电热鼓风干燥箱,南通泸南科学仪器有限公司;GKDL-20低温冷却液循环泵,巩义市英峪高科仪器厂;KQ-300DE数控超声波清洗器,昆山市超声仪器有限公司;DT5-2低速台式离心机,北京时代北利离心机有限公司。
1.2 Fe2O3/Cu-MOF的制备
参 照 文 献 〔9〕, 取 2.077 g Cu(NO3)2·3H2O 和15 mL去离子水置于烧杯中,在室温下剧烈搅拌30 min 使 Cu(NO3)2·3H2O 完全溶解,记为溶液 A;取N,N-二甲基甲酰胺、乙醇各 15 mL,与一定量1,3,5-苯三甲酸(H3TBC)依次加入烧杯中,搅拌30 min使H3TBC完全溶解,记为溶液B;将溶液A加入溶液B中混合搅拌,记为溶液C。称取相应质量的Fe2O3加入到溶液C中继续磁力搅拌1 h,随后将混合溶液转移到100 mL聚四氟乙烯衬不锈钢高压釜中,120℃水热反应12 h,离心洗涤,在90℃下烘干,得到Fe2O3@Cu-MOF纳米复合材料样品。
1.3 降解实验
将150 mL一定浓度的RhB溶液置于反应器中,加入Fe2O3@Cu-MOF纳米复合材料,用H2SO4和NaOH溶液调节pH。将混合好的溶液用磁力搅拌器搅拌,在无光条件下吸附30 min,待溶液达到物理吸附平衡后再加入过氧化氢。溶液在可见光照射下,用低温冷却液循环泵通入循环水以控制温度,开启电源后,参考电流和参考光强稳定后的时刻记为起点,分别在 15、30、60、120、150、180、240 min 时取样,取上清液并用紫外-可见分光光度计在554 nm处测定各样品的吸光度,计算脱色率。
2 结果与分析
2.1 N2吸附(BET)分析
Fe2O3@Cu-MOF纳米复合材料和Cu-MOF材料的N2吸附-脱附等温线如图1所示。

图1 Fe2O3@Cu-MOF、Cu-MOF的N2吸附-脱附等温曲线
由图1可见,根据IUPAC吸附等温线的分类方法,Fe2O3@Cu-MOF、Cu-MOF属于典型的Ⅳ型等温线,说明这2种材料中有大量中孔存在。实验测得Cu-MOF的比表面积为430 m2/g,Fe2O3@Cu-MOF的比表面积为711.45 m2/g,负载Fe2O3后不但有新的空隙生成且中孔率也有所增长。更大的比表面积和较多的中孔结构可使催化剂表面吸附性能增加,同时产生更多的活性位点,更有利于降解反应的发生。
2.2 XRD分析
Cu-MOF和Fe2O3@Cu-MOF样品的XRD图谱如图2所示。
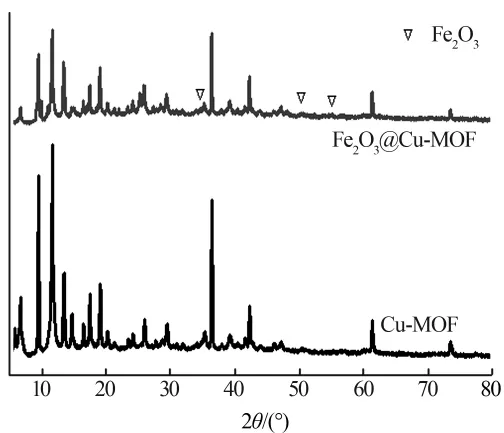
图2 Cu-MOF和Fe2O3@Cu-MOF的XRD图谱
由图2 可见,2 个样品在 10°、15°、37°处出现衍射峰,为 Cu-MOF 的特征衍射峰〔9〕。 Fe2O3@Cu-MOF在 33.18°、49.58°、54.12°处出现新的衍射峰,分别对应(104)、(024)及(116),为 α-Fe2O3晶面(标准卡JCPDS78-1996),表明 Cu-MOF已成功负载以 α-Fe2O3形态存在的Fe3+。此外,Fe2O3@Cu-MOF峰形中Cu-MOF的衍射峰清晰可见,表明Cu-MOF负载Fe2O3后并没有造成MOF骨架的变化。
2.3 SEM和EDS分析
Cu-MOF和Fe2O3@Cu-MOF的SEM照片如图3所示,Fe2O3@Cu-MOF的EDS能谱分析如表1所示。

图3 Cu-MOF(a)和Fe2O3@Cu-MOF(b)的 SEM 照片

表1 Fe2O3@Cu-MOF的EDS能谱分析
由图3可见,Cu-MOF呈表面光滑的八面体,而负载Fe2O3后八面体表面粗糙,这可能是Fe2O3在Cu-MOF表面结晶造成的。从表1可以看出,负载Fe2O3后 Cu-MOF中的主要元素为 Cu、Fe和 O,合成的催化剂有Fe元素存在,与XRD结果一致。
2.4 红外光谱分析
由Cu-MOF红外谱图可知,Cu-MOF在1 637、1 444、1 373 cm-1处出现—COOH 非对称伸缩峰〔10〕,728 cm-1处为C—H键弯曲振动峰,938 cm-1处为C—H 键弯曲振动峰〔11〕。而 Cu-MOF 负载 Fe2O3后未出现Fe—O伸缩振动峰,原因可能在于:(1)负载在Cu-MOF表面的Fe2O3较少,可能造成Fe3+浓度较低;(2)根据XRD表征结果,Fe2O3只是负载在Cu-MOF表面,未影响MOF结构,也没有形成化学键。
3 RhB溶液的脱色效果
3.1 不同体系的脱色效果
在室温、pH为初始溶液值、RhB溶液质量浓度为20 mg/L、催化剂投加量为0.3 g/L、H2O2投加量为3.5 mmol/L条件下,考察不同实验体系中RhB的降解情况,实验结果如图 4(a)所示。

图4 催化剂对脱色效果的影响
由图4(a)可见,加入H2O2在无光照条件下搅拌120 min,RhB溶液颜色基本没有变化,这是因为H2O2的氧化能力比·OH 的弱〔12〕;光照下加入 H2O2后脱色率达到26.10%;加入Cu-MOF、H2O2并给予一定光照的条件下,脱色率为33.21%,脱色效果明显;单独加入催化剂时脱色率为19.30%,说明该催化剂具有一定吸附性能;光照并加入催化剂时,脱色率为20.81%;无光条件下加入催化剂和H2O2,脱色率为23.30%,可能是催化剂的吸附能力与H2O2氧化能力同时作用于RhB造成的;在光照条件下添加催化剂和H2O2搅拌120 min,RhB溶液的脱色率高达95.23%,速率常数为0.011 min-1。说明光照情况下,Fe2O3@Cu-MOF与H2O2发生光-Fenton反应,对RhB 的降解效果最佳〔13〕。
3.2 溶液pH对脱色效果的影响
在室温、RhB溶液质量浓度为20 mg/L、催化剂投加量为 0.3 g/L、H2O2投加量为 3.5 mmol/L条件下,考察了不同pH下RhB的降解效果,并进行一级动力方程拟合,如图4(b)所示。可以看出RhB溶液在酸性条件下的脱色效果不是很好,pH在5~9时脱色效果显著,pH继续增加RhB溶液脱色率有所下降。pH在5~9时RhB溶液有很好的脱色率,因原始溶液pH在此范围内,所以最终选用原始溶液pH为实验pH。
3.3 H2O2投加量对脱色效果的影响
在室温、RhB溶液质量浓度为20 mg/L、pH为原始溶液pH、催化剂投加量为0.3 g/L条件下,考察H2O2投加量对RhB脱色效果的影响,结果如图4(c)所示。当H2O2投加量从1 mmol/L增加到9 mmol/L时,120 min时RhB脱色率从92.89%升至97.12%;H2O2投加量增加到13mmol/L时,RhB脱色率反而降至96.75%。H2O2投加量会影响溶液中·OH的浓度,随着·OH数量的增多,与溶液中的有机物发生反应,但H2O2过量投加时会生成·OOH,反而使得·OH减少〔14〕,而氧化还原电位较低的·OOH不能有效破坏RhB的显色基团〔15〕。综合考虑,最终选用H2O2最佳投加量为3.5mmol/L。
3.4 RhB初始质量浓度对脱色效果的影响
RhB初始质量浓度越大,降解越困难。在室温、pH为原始溶液pH、催化剂投加量为0.3 g/L、H2O2投加量为3.5 mmol/L条件下,设置RhB溶液初始质量浓度分别为20、35、50、65 mg/L,研究其对脱色效果的影响,如图4(d)所示。当RhB初始质量浓度从20 mg/L增加到65 mg/L时,降解120 min后脱色率从95.23%降至73.02%,有明显下降趋势。随着RhB初始质量浓度的增加,溶液中显色基团浓度随之增大,对·OH的需求量增加,而·OH总量不变,从而影响脱色效果〔16〕。此外,RhB初始质量浓度增大会造成光透射率降低,光源利用率降低。
3.5 催化剂投加量对脱色效果的影响
室温下,当RhB溶液质量浓度为20 mg/L、pH为原始溶液pH、H2O2投加量为3.5 mmol/L时,催化剂投加量分别为 0.1、0.2、0.3、0.4 g/L,反应 120 min 后RhB 脱色率分别为70.98%、78.93、95.23%、96.44%,脱色率随催化剂投加量的增加而增大。随着催化剂的增加,溶液中的·OH 随之增多〔17〕,但催化剂投加量过多时也易造成透光率降低,从而使光源利用率降低。综合考虑,最终选用催化剂投加量为0.3 g/L。
3.6 循环稳定性能
催化剂的循环稳定性是考察非均相Fenton催化剂性能的重要指标之一。对使用过的Fe2O3@Cu-MOF催化剂进行离心分离并干燥,循环使用4次后,降解120 min时脱色率仍达85%以上,如图4(f)所示。对催化剂使用前后的红外谱图进行对比,发现其红外光谱没有很大变化,说明Fe2O3@Cu-MOF有很好的循环稳定性,也表明其对RhB溶液的降解非物理吸附。
3.7 光催化降解RhB机理分析
结合前人研究结果及本实验数据,提出光催化降解RhB可能的机理:(1)Cu-MOF材料有较好的比表面积和孔结构,自身具有良好的吸附性能,可吸附一定量的RhB。并且材料的高比表面积特性对可见光利用率较高,更易产生电子跃迁,有利于有机物降解。(2)反应初期,Fe2O3@Cu-MOF表面处的Fe3+被还原为Fe2+,Fe2+再与H2O2反应生成·OH和少量·OOH,Fe2+又可被氧化成Fe3+,在反应体系中形成Fe2+和 Fe3+的循环反应〔18〕;此外,MOFs 的特殊形貌也使得Fe2O3负载得更加均匀,MOF表面的Fe3+在光照的条件下,也可能与H2O2反应生成·OOH和Fe2+。(3)反应体系产生的·OH作用于催化剂表面处的RhB分子,生成反应中间体,中间体被降解为H2O和 CO2,使催化剂恢复原始状态〔19〕。
4 结论
(1)采用一步晶化法制备了非均相光-Fenton纳米复合催化剂Fe2O3@Cu-MOF,在室温下反应120 min后对RhB溶液的脱色率达到95.23%。
(2)Fe2O3@Cu-MOF制备过程简单、材料廉价、绿色环保,循环使用4次后对RhB的脱色率仍可达到85%以上,且结构未发生太大变化,具有良好的稳定性。
