磁性TiO2/GO对二元体系中U(Ⅵ)的去除效能及机理
2020-12-23唐振平肖莎莎谢严兴毕玉玺刘迎九
唐振平 ,肖莎莎 ,谢严兴 ,毕玉玺 ,刘迎九 ,周 帅
(1.南华大学污染控制与资源化湖南省重点实验室,湖南衡阳421001;2.南华大学核燃料循环地质理论与技术衡阳市重点实验室,湖南衡阳421001)
含铀废水具有化学毒性和低放射性,会对人体和生态环境构成潜在威胁。吸附法因具有高效率、低污染和方便回收等优点被研究者广泛应用于含铀废水的处理〔1〕。 氧化石墨烯(GO)比表面积大、机械性能好,且含有对重金属有强络合能力的官能团(羧基和羟基),被视作含铀废水治理研究的热门材料。然而GO在水中容易发生团聚,限制了其效能,需要通过复合其他材料改善性能。二氧化钛(TiO2)能光催化还原重金属,但对可见光的吸收范围较窄,对重金属的去除效果不佳。有研究表明,GO与TiO2复合后(TiO2/GO)不仅能发挥两者的去除效果,还能克服GO在水中易团聚〔2〕、TiO2对可见光吸收范围窄等缺点〔3〕。 此外,在 TiO2/GO 引入磁性四氧化三铁(Fe3O4)可成功解决GO在水溶液中难分离的问题〔4〕。因此,磁性二氧化钛/氧化石墨烯(磁性TiO2/GO)在含铀废水处理中具有一定应用前景。
实际铀矿废水中离子种类多、成分非常复杂,严重制约了铀〔尤其是U(Ⅵ)〕的高效去除与回收〔5〕。其中,重金属离子是影响U(Ⅵ)去除效果的主要因素之一〔5〕。目前已有少量研究考察了重金属离子对氧化石墨烯基复合材料去除U(Ⅵ)的影响。Wencheng Song等〔6〕通过等离子体接枝法制备了聚丙烯酰胺/氧化石墨烯(PAM/GO),并用其去除 U(Ⅵ)、Eu(Ⅲ)和Co(Ⅱ)。结果表明,与处理单组分U(Ⅵ)相比,3种放射性元素共存条件下PAM/GO对U(Ⅵ)的去除率下降了约 20%,原因在于 U(Ⅵ)、Eu(Ⅲ)、Co(Ⅱ)与PAM/GO的结合位点存在竞争吸附关系。此外,氧化石墨烯基材料可引入对铀有强吸附性的功能官能团,进而增强其在共存金属离子溶液中对铀的选择性。 Feihong Wang等〔7〕探究了氧化石墨烯/偕胺肟水凝胶(AGH)对含铀废水及模拟海水中U(Ⅵ)的吸附性能。结果显示,AGH对U(Ⅵ)的最大处理容量为 398.4 mg/g,在高浓度竞争离子(如 Mg2+、Ca2+、Ba2+和Sr2+)存在情况下,其对U(Ⅵ)具有较强的选择性。然而,目前尚无研究报道共存金属离子对磁性TiO2/GO去除U(Ⅵ)的影响。
笔者制备并表征了磁性TiO2/GO复合材料,考察pH、磁性TiO2/GO投加量和反应时间对共存二元体系中U(Ⅵ)、Cd(Ⅱ)去除的影响,并探讨磁性TiO2/GO 对 U(Ⅵ)、Cd(Ⅱ)的去除机理,为后续实际含铀废水污染治理提供一定科学支持。
1 实验部分
1.1 试剂与仪器
天然鳞片石墨(30μm,青岛金日来石墨有限公司,工业级);钛酸四丁酯(TBOT,天津市科密欧化学试剂有限公司)、3-氨丙基三甲氧基硅烷(APTMS)、四氧化三铁(Fe3O4)、氯化镉、八氧化三铀,均为分析纯。除特殊标注外,试剂均购自国药集团化学试剂有限公司。标准U(Ⅵ)溶液采用文献〔8〕制备;标准Cd(Ⅱ)溶液采用文献〔9〕制备。
D8 Advance型X射线衍射仪(XRD),德国布鲁克公司;JSM-7500F型扫描电镜(SEM),日本电子株式会社;Avatar-360型傅里叶变换红外光谱仪(FTIR),美国尼高力仪器公司;BETA201A型比表面积及孔隙率分析仪(BET),北京冠测精电仪器设备有限公司;UV-2550型紫外-可见漫反射光谱仪(UV-Vis), 日本岛津公司;ESCALAB 250Xi型 X 射线光电子能谱仪(XPS),赛默飞世尔科技公司;AA-6300型原子吸收分光光度计,日本岛津公司;2000型可见分光光度计,美国尤尼柯;IS-RDD3型台式恒温振荡器,美国精骐有限公司;3K15型高速台式冷冻离心机,德国希格玛。
1.2 实验方法
1.2.1 磁性TiO2/GO的制备
采用 Hummers法制备 GO〔10〕;用化学沉积法将Fe3O4与 TiO2合成为磁性 TiO2;以 APTMS为偶联剂,通过水热法将GO与磁性TiO2合成为磁性TiO2/GO〔9〕。
1.2.2 磁性 TiO2/GO 对 U(Ⅵ)、Cd(Ⅱ)的去除
(1)U(Ⅵ)、Cd(Ⅱ)单组分去除实验:取适量U(Ⅵ)或Cd(Ⅱ)标准溶液于150 mL锥形瓶中,定容成一定浓度的单组分U(Ⅵ)或Cd(Ⅱ)溶液。调节pH后,加入适量磁性TiO2/GO,30℃下恒温震荡反应一定时间,离心取上清液。分别用紫外分光光度计和原子吸收分光光度计测定吸光度,计算残余的U(Ⅵ)、Cd(Ⅱ)浓度。
(2)U(Ⅵ)、Cd(Ⅱ)二元组分去除实验:将 U(Ⅵ)、Cd(Ⅱ)标准溶液均匀混合并定容成一定浓度的U(Ⅵ)-Cd(Ⅱ)二元体系混合溶液,其他实验步骤与(1)相同。
(3)紫外光对U(Ⅵ)的去除影响实验:增加紫外光条件(功率300 W),其他实验步骤与(1)相同。
(4)数据处理。计算磁性TiO2/GO对U(Ⅵ)或Cd(Ⅱ)的去除量 q(mg/g)和去除率 η(%)。
1.2.3 磁性TiO2/GO的结构表征
(1)用XRD测定复合物的晶型结构,以Cu Kα为激发源,电压40 kV,电流40 mA,波长0.154 18 nm,步宽 0.05°,扫描角度 5.0°~90.0°。
(2)FTIR 采用 KBr压片法,分辨率 1 cm-1,光谱范围 400~4 000 cm-1。
(3)用SEM观察磁性TiO2/GO的表面形貌:钨灯丝为光源,加速电压0.1~30.0 kV,放大倍数0.2~10万。测试前样品喷金10 min。
(4)用BET分析样品空隙结构:借助氮气吸附原理,采用静态真空容量法,孔径分析范围为0.35~500 nm,孔的最小检测量为0.000 1 cc/g。
(5)用UV-Vis记录样品光谱吸收:以纯BaSO4作基线,扫描范围200~800nm,谱带宽度0.1~5.0 nm。
(6)采用XPSPEAK41分析软件对样品进行分峰及数据拟合处理。
2 结果与讨论
2.1 磁性TiO2/GO的表征结果
红外谱图表明,与GO、磁性TiO2相比,磁性TiO2/GO在1 054 cm-1处的吸收峰(GO的环氧基官能团)消失,但出现了1 083 cm-1吸收峰(APTMS的氨基官能团)。说明偶联剂APTMS的氨基与GO环氧基团发生加成反应〔11〕。由磁性TiO2/GO的XRD光谱(见图 1)可知,磁性 TiO2/GO在 10.29°处的 GO特征衍射峰消失。 此外,可观察到 25.37°、37.43°、62.70°(对应锐钛型TiO2特征衍射峰)和 30.16°、35.52°、62.96°(对应尖晶石Fe3O4特征衍射峰)的峰显著减弱,表明磁性TiO2与GO已形成纳米插层复合材料〔12〕。由此认为,磁性TiO2已成功负载到GO表面。
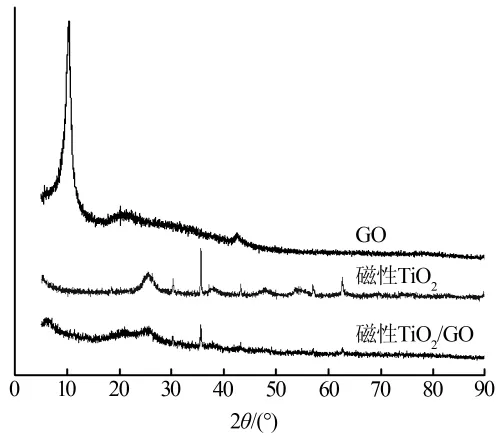
图1 GO、磁性TiO2和磁性TiO2/GO的XRD光谱
对GO、磁性TiO2和磁性TiO2/GO进行SEM表征,见图2。

图2 GO、磁性TiO2和磁性TiO2/GO的SEM照片
由图2可见,GO具有薄、折叠而呈褶皱形貌特征〔13〕;纳米圆形颗粒物 Fe3O4附着于 TiO2表面。合成的磁性TiO2/GO依然可见表面有细小颗粒,但呈现为有利于吸附的沟壑状形貌。
图3为常温下测得的磁性TiO2/GO的氮气吸附等温线和脱附等温线。
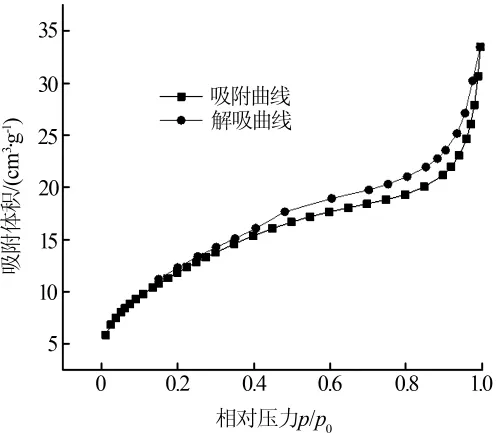
图3 磁性TiO2/GO的氮气吸附、脱附曲线
根据国际纯理论与应用化学联合会分类,磁性TiO2/GO氮气吸附-脱附等温线为典型的IUPACⅣ型曲线,并在 0.1<p/p0<1 范围内出现 H3 型滞后环〔14〕,表明磁性TiO2/GO为具有介孔结构的层状聚集物(孔径为3.324 nm)。相较于多孔和微孔结构,磁性TiO2/GO的介孔结构有助于提升光催化效果〔15〕。但对比合成前后材料的比表面积发现,合成后磁性TiO2/GO的比表面积为44.416 m2/g,反而低于GO的比表面积(103.825 m2/g),推测是由于GO负载磁性TiO2后,钛、铁等金属离子堆积导致材料比表面积减少。
2.2 U(Ⅵ)、Cd(Ⅱ)去除效能的影响因素分析
2.2.1 pH的影响
在 U(Ⅵ)、Cd(Ⅱ)单独存在或 U(Ⅵ)-Cd(Ⅱ)共存的初始质量浓度均为10 mg/L、磁性TiO2/GO投加量为15 mg、反应时间为120 min条件下,考察溶液初始 pH(3.0~7.0)对磁性 TiO2/GO 去除 U(Ⅵ)、Cd(Ⅱ)效果的影响,如图 4(a)所示。 可以发现,随着初始pH的升高,无论单组分体系还是二元体系,U(Ⅵ)去除率均随初始pH的升高而增加,并在初始pH为6以后基本不变;对于Cd(Ⅱ),2种体系中的去除率都是先上升而后在初始pH为6开始下降。以上现象主要归因于溶质与吸附剂的静电作用〔16〕,即初始pH较低时,溶液中的H+较多,磁性TiO2/GO表面的羧基、羟基官能团容易质子化,会与本身带正电的U(Ⅵ)、Cd(Ⅱ)产生静电排斥;随着初始pH的增加,磁性TiO2/GO的负电势增加,它与溶液中的U(Ⅵ)、Cd(Ⅱ)逐渐产生静电吸引〔17〕,因此去除率上升。初始pH>6,磁性TiO2/GO对U(Ⅵ)的去除率变化不大,依然保持较强的去除性能。因此,实验确定最佳初始pH为6。
经对比可知,不论单组分还是二元体系,磁性TiO2/GO对U(Ⅵ)的去除率始终高于Cd(Ⅱ)去除率。此外,pH为6时,单组分体系的U(Ⅵ)去除率为99.52%,二元体系的U(Ⅵ)去除率降至93.73%;单组分体系的 Cd(Ⅱ)去除率为 95.01%,二元体系的Cd(Ⅱ)去除率降为78.60%。表明二元体系中的U(Ⅵ)与 Cd(Ⅱ)存在竞争吸附,且相较于 Cd(Ⅱ),磁性TiO2/GO对U(Ⅵ)有更强的亲和力。

图4 去除U(Ⅵ)、Cd(Ⅱ)的影响因素分析
2.2.2 磁性TiO2/GO投加量的影响
在初始 pH 为 6、U(Ⅵ)、Cd(Ⅱ)单独存在或共存的初始质量浓度均为10 mg/L、反应时间为120 min条件下,考察磁性 TiO2/GO 投加量(2~20mg)对 U(Ⅵ)、Cd(Ⅱ)去除效果的影响,结果如图4(b)所示。随着磁性TiO2/GO投加量的增加,二元体系中的U(Ⅵ)、Cd(Ⅱ)去除率都迅速上升,随后缓慢增长,直到15 mg时去除率趋于稳定〔U(Ⅵ)去除率为93.87%,Cd(Ⅱ)去除率为73.75%〕。推测原因在于增加磁性TiO2/GO投加量可增加活性位点,从而显著提高U(Ⅵ)、Cd(Ⅱ)的去除率;随着投加量的进一步加大,磁性TiO2/GO之间发生碰撞团聚,活性基团利用率下降,去除率增速放缓,最终趋于稳定〔18〕。因此,磁性TiO2/GO最佳投加量应为15 mg。
单组分体系中U(Ⅵ)、Cd(Ⅱ)的变化趋势与二元体系相似,但前者在磁性TiO2/GO投加量为10 mg时即可使U(Ⅵ)去除达到平衡,低于二元体系相应的磁性TiO2/GO投加量(15 mg)。这主要是因为在二元体系中U(Ⅵ)和Cd(Ⅱ)之间存在吸附竞争,磁性TiO2/GO量少时活性位点不能同时满足两者的需求。
2.2.3 反应时间影响及其反应动力学分析
在 U(Ⅵ)、Cd(Ⅱ)单独存在或 U(Ⅵ)-Cd(Ⅱ)共存的初始质量浓度均为10 mg/L、pH为6、磁性TiO2/GO投加量为15 mg的条件下,考察不同反应时间(2~300 min)下磁性 TiO2/GO 对 U(Ⅵ)、Cd(Ⅱ)的去除效果,如图4(c)所示。在单组分及二元体系中,前 5 min磁性 TiO2/GO 对 U(Ⅵ)、Cd(Ⅱ)的去除率迅速升高,随后增速放缓,120 min后趋于平衡。初期磁性TiO2/GO活性结合位点较多,能快速吸附U(Ⅵ)、Cd(Ⅱ);但随着反应时间的增加,活性位点逐渐减少,U(Ⅵ)、Cd(Ⅱ)的浓度也降低,去除率增速减慢直至恒定。选取最佳反应时间为120 min。
经对比发现,单组分和二元体系中磁性TiO2/GO对U(Ⅵ)的去除率均高于Cd(Ⅱ),且在二元体系中差异更明显(二者去除率相差约16%);而2种体系中磁性TiO2/GO对U(Ⅵ)的去除率差距不大(约 5%)。
反应动力学模型〔18〕能描述去除过程。表1为磁性TiO2/GO去除U(Ⅵ)、Cd(Ⅱ)的动力学模型拟合参数。
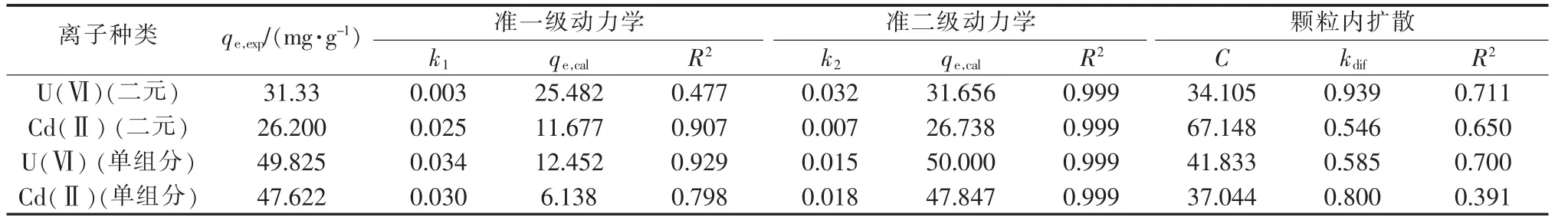
表1 U(Ⅵ)、Cd(Ⅱ)的动力学模型拟合参数
由表 1 可知,2 种体系中 U(Ⅵ)、Cd(Ⅱ)的准二级动力学方程拟合系数 R2均最高(0.999),且 qe.cal(理论平衡去除量)与 qe,exp(实际平衡去除量)数值基本接近。因此,该反应过程遵循准二级动力学模型,说明该过程以化学吸附为主。此外,准二级动力学模型拟合得到的去除速率常数k2能反映反应过程速度〔19〕。表 1 单组分体系中 U(Ⅵ)与 Cd(Ⅱ)的 k2数值基本相同,说明单独去除时两者去除速率差别不大;而二元体系 U(Ⅵ)的 k2(0.032)远大于 Cd(Ⅱ)的 k2(0.007),表明该体系中磁性 TiO2/GO对 U(Ⅵ)的去除速率远高于Cd(Ⅱ)。
综上,在 U(Ⅵ)-Cd(Ⅱ)共存二元体系中,U(Ⅵ)的去除率与去除速率均远大于Cd(Ⅱ);与单组分体系进行对比可发现,Cd(Ⅱ)对U(Ⅵ)的去除率影响不大。因此,磁性TiO2/GO对U(Ⅵ)的去除具有一定选择性。
2.3 U(Ⅵ)-Cd(Ⅱ)二元体系中 U(Ⅵ)的去除机理
2.3.1 磁性TiO2/GO的表面官能团分析
图5(a)为反应前后磁性TiO2/GO的FTIR谱图,可以发现,U(Ⅵ)-Cd(Ⅱ)共存二元体系中,磁性TiO2/GO在1 636 cm-1处的—COOH非对称伸缩振动峰偏移至1 624 cm-1,表明磁性TiO2/GO上的羧基官能团结构发生变化,其与U(Ⅵ)、Cd(Ⅱ)发生络合反应〔20〕。此外,在 901 cm-1处观察到线性〔O=U=O〕2+的振动带,证明铀酰离子与含氧基团发生结合〔21〕;而1 384 cm-1处出现尖锐的峰表示磁性TiO2/GO上的含氮官能团与铀酰离子发生了络合反应〔22〕。以上结果表明,磁性TiO2/GO对U(Ⅵ)或Cd(Ⅱ)的吸附可能归因于GO的羧基官能团和APTMS的氨基官能团,且氨基官能团对U(Ⅵ)具有更强的亲和力。Rui Hu等〔23〕研究证明吸附剂的氨基官能团能与铀酰离子形成具有较强键合作用的络合物,因此相较于Cd(Ⅱ)、Zn(Ⅱ)等重金属离子,其对 U(Ⅵ)更具选择性。这与本研究结果一致。
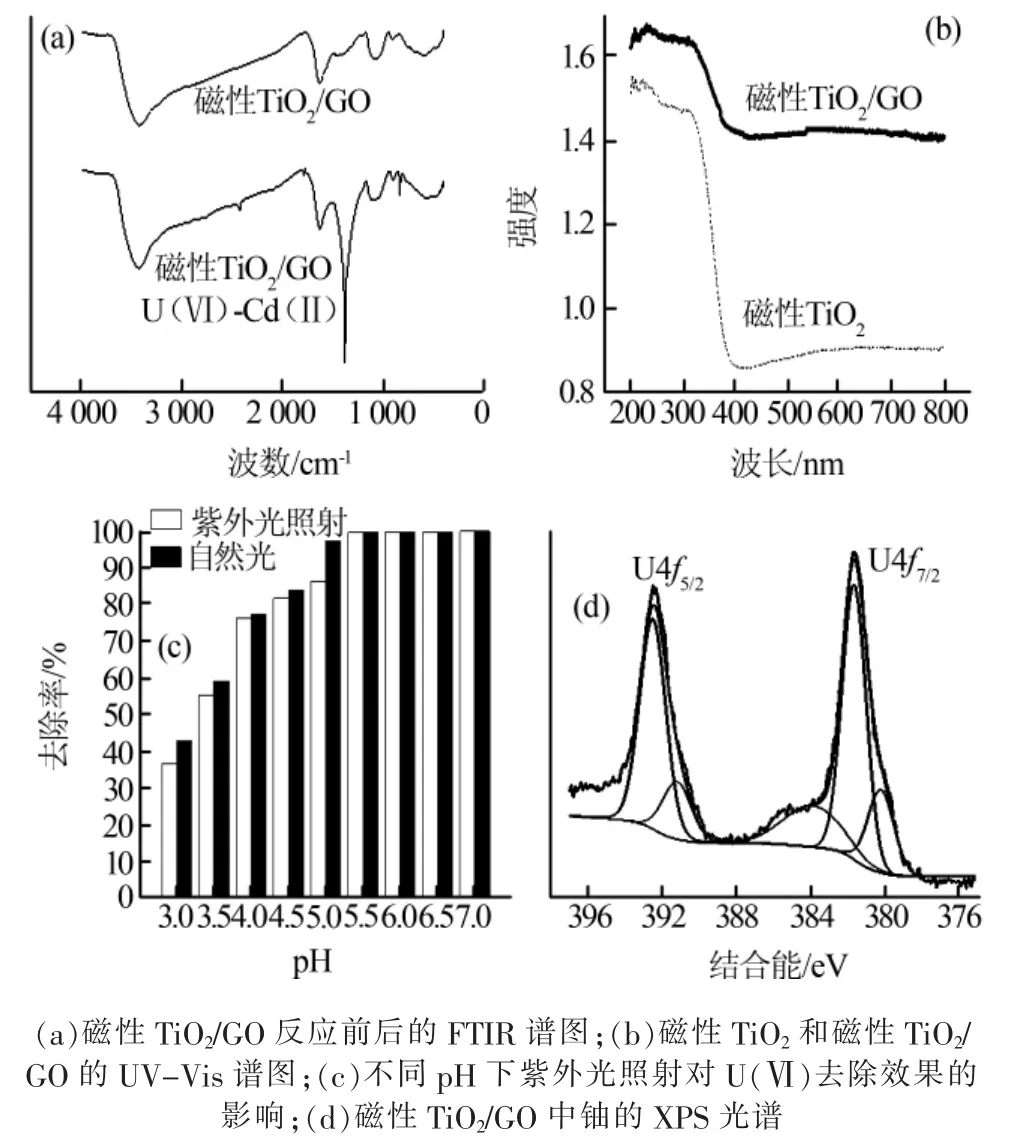
图5 U(Ⅵ)的去除机理分析
2.3.2 磁性TiO2/GO的光催化性能分析
图5(b)为磁性TiO2和磁性TiO2/GO的UV-Vis谱图。与磁性TiO2相比,磁性TiO2/GO在可见光(300~800 nm)范围内的光吸收带发生明显红移,表明磁性TiO2复合GO后吸光范围得到拓宽,特别是在可见光范围内具备较好的光催化能力。
为了探究这种光催化还原作用,进一步考察了光照条件对 U(Ⅵ)去除率的影响。在 U(Ⅵ)、Cd(Ⅱ)初始质量浓度均为10 mg/L、磁性TiO2/GO投加量为15 mg、反应时间为120 min,溶液初始pH在3.0~7.0条件下,光照对磁性TiO2/GO去除U(Ⅵ)效果的影响如图5(c)所示。在不同初始pH下,自然光和紫外光对磁性TiO2/GO去除U(Ⅵ)效果的影响差异不大,二者最佳去除率均能达到99.8%以上。
通过XPS分析自然光条件下磁性TiO2/GO对U(Ⅵ)的去除机理,如图 5(d)所示。U4f7/2、U4f5/2轨道分峰分别在392.55、381.86 eV处,代表存在U(Ⅵ)〔其结合能范围分别为(392.65±0.15) eV、(381.6±0.3) eV〕〔24〕。 U4f7/2轨道在结合能为 380.24 eV 处的分峰则证明 U(Ⅳ)存在〔(380.3±0.4)eV〕。且根据峰面积推测 U(Ⅵ)与 U(Ⅳ)的质量比约为 3∶1,说明U(Ⅵ)被部分还原为U(Ⅳ)沉淀。因此,在自然光条件下,磁性TiO2/GO对U(Ⅵ)有一定光催化还原能力。 此外,文献〔25〕表明 TiO2对 Cd(Ⅱ)不具有光催化还原作用。
综上,在 U(Ⅵ)-Cd(Ⅱ)共存二元体系中,磁性TiO2/GO在自然光下对U(Ⅵ)的光催化还原是其选择性去除U(Ⅵ)的重要原因。
3 结论
(1)FTIR表征结果证明磁性TiO2/GO材料制备成功;SEM、XRD及BET表征结果表明,磁性TiO2/GO为一种吸附性能优良的介孔片层聚合物。
(2)在 U(Ⅵ)-Cd(Ⅱ)共存二元体系中,pH为6、磁性 TiO2/GO投加量为 15 mg、反应时间为120 min时,磁性TiO2/GO对U(Ⅵ)的去除率最高,为93.72%。
(3)磁性 TiO2/GO 对 U(Ⅵ)、Cd(Ⅱ)主要以化学吸附为主;其可选择性去除U(Ⅵ)的原因在于磁性TiO2/GO的氨基官能团络合作用和光催化还原作用。
