微量金属元素在重建古湖泊氧化还原状态研究中的应用
2020-12-23高云佩
杨 存,高云佩
YANG Cun, GAO Yun-Pei
(中国科学技术大学地球和空间科学学院,合肥230026)
(School of Earth and Space Sciences, University of Science and Technology of China, Hefei 230026, China)
1 前言
湖泊沉积物是不同地质、气候、水文条件下各类碎屑、黏土、自生或生物成因矿物以及有机物质等的综合体[1]。湖泊沉积物通常具有沉积速率高、连续性好、分辨率高的特点[1-3],可以有效记录过去发生的气候事件和地质事件,反演古湖水的化学组成和氧化还原状态,是我们重建古气候、古环境的宝贵材料。
具有多价态的微量金属元素在不同氧化还原条件的水体中, 会表现出较大的地球化学行为差异, 因此具有重建古水体氧化还原状态的应用潜力。 微量金属元素指标已被广泛应用于海相沉积物,并成功反演了古海水氧化还原条件的变化[4-7];然而,截至目前,针对湖相沉积物中微量金属元素的研究报道和系统综述仍相对缺乏。其主要原因之一是湖相沉积物的元素含量及其分布状态相比海相沉积物,更易受到陆源碎屑的影响。鉴于此,本文将系统介绍不同微量金属元素在湖泊沉积物中的富集机制,阐述剔除外源组分和成岩作用的校正方法,探讨如何利用多重指标联合制约古水体氧化还原状态。
Tyson 和Pearson[8]按溶解氧含量将现代海水及湖水划分为:氧化水体([O2]> 2.0 mL/L)、次氧化水体(0.2 mL/L < [O2]< 2.0 mL/L)、缺氧水体([O2]<0.2 mL/L, [H2S]= 0 mL/L), 以及缺氧硫化水体([O2]= 0 mL/L, [H2S]> 0 mL/L)。湖泊沉积物中微量金属元素的来源主要有陆源碎屑输入、 化学沉积、生物沉积,以及特定环境下湖底热液沉积。 其中,只有特定化学沉积和生物沉积这些自生沉积组分的微量金属元素含量才能够反映古水体的氧化还原状态[5,9]。 因此,在利用微量金属元素重建古湖水氧化还原状态时, 需定量评估和校正陆源输入、早期成岩作用,以及热液等对湖泊沉积物元素组成的影响;同时,研究需结合多种地球化学手段,共同制约湖泊水体氧化还原状态的演化。
2 微量金属元素自生沉积富集机制
在重建古水体氧化还原状态时,自生沉积组分是良好的信息载体,因此理解不同微量金属元素的自生沉积机制尤为重要。 在众多微量金属元素中,U、Mo、V 主要以自生化学沉积形式在湖泊沉积物中富集,其在沉积物中的富集程度强烈受控于水体的氧化状态; 另外,U、Mo、V 在碎屑物质中的含量相对较少,其受陆源碎屑的影响较小,因此是重建古水体氧化还原状态的良好指标。 相比而言,虽然Cr 和Co 在沉积物中的自生富集机制也与水体氧化还原状态密切相关,但二者在陆源碎屑矿物中普遍含量较高, 因此当陆源碎屑组分所占比例较大时,沉积物中的Cr 和Co 不适合作为判别古水体氧化还原状态的单一指标。 除此以外,Ni,Cu,Zn,Cd主要以与有机质络合的形式发生沉积,属于自生生物沉积方式,在重建古水体氧化还原条件过程中也具有一定的指示意义。 我们将以上述微量元素为例,系统介绍其在不同氧化还原条件的水体中的自生沉积机制。
2.1 铀(U)
在氧化-次氧化水体中,U (+6)主要以 UO22+离子形式存在, 只有少数UO22+离子可以进入沉积物埋藏保存。 UO22+离子进入沉积物的方式主要有三种: 第一,UO22+离子容易进入碳酸盐矿物晶格发生共沉淀;第二,伴随Mn-Fe (氢)氧化物表面吸附,UO22+会被带入沉积物中埋藏;第三,UO22+离子也可与有机物质发生络合反应,并伴随有机物质沉降进入沉积物保存[10-13]。
在缺氧水体中,大量U (+6)将被还原为 U (+4)并形成不溶矿物(如沥青铀矿)直接进入沉积物中[12]。 U (+6)到 U (+4)的还原作用可通过生物途径[11]或非生物途径[14]。 其中,生物途径包括铁还原菌和硫酸盐还原菌代谢过程的酶催化作用[15,16];非生物途径则主要是通过硫化物、HS-、Fe2+, 以及 Fe 单质将 U (+6)还原成 U (+4)[14,15,17-19]。 总体而言,U 在还原水体中的沉积效率明显高于其在氧化水体中的沉积效率。
值得注意的是,当水体中[Ca2+]和[HCO3-]较高时,U (+6)会与之形成 Ca-铀酰-碳酸根化合物(包含 Ca2UO2(CO3)3(aq)、CaUO2(CO3)22-(aq),以及 UO2(CO3)34-(aq))。 Stetten 等[12]依据热力学平衡数据计算发现高[Ca2+]和高[HCO3-]会抑制Ca-铀酰-碳酸根中 U (+6)还原成 U (+4)。 此外,Ca-铀酰-碳酸根化合物的存在也会降低微生物对水体中U (+6)的还原效率[20]。 因此,当发现湖泊沉积物中有大量碳酸盐矿物存在时,应考虑[Ca2+]、[HCO3-],以及Ca-铀酰-碳酸根化合物对U 富集程度的影响[21]。
2.2 钼(Mo)
湖水中Mo 的主要来源是河流和地下水输入[22]。但对于现代湖泊, 大气Mo 沉降来源也不容忽视,尤其是当湖泊附近存在化石燃料燃烧或碱金属冶炼行为时[23]。 在氧化水体中,Mo 以最高价态(+6)的钼酸根离子(MoO42-)溶解在水中,少部分MoO42-可吸附于Mn-Fe(氢)氧化物或有机物质表面进入沉积物中[23-27]。在缺氧硫化水体中,当水体H2S 到达一定浓度时 ([H2S]aq > 11μM),MoO42-会与 H2S 反应形成硫代钼酸根(MoO4-xSx2-, x = 1~4)[13,28]。 早期观点认为 Mo (+6)被还原成 Mo (+4)后,最终以 MoS2形式保存在沉积物中[10]。 最新研究认为,MoS2可能并不是 Mo (+4)的最终保存形式[27]。 在形成MoO4-xSx2-后,将与 S8进一步反应生成 MoO(S4)S2-或MoS(S4)S2-的钼聚硫化物,在非晶质 FeS 的存在下,Mo (+4)最终以结构复杂的Mo-Fe-S 不溶化合物(如 FeMo0.6S2.8)保存在沉积物中[27]。 综上所述,在氧化水体中,少部分MoO42-离子可通过吸附途径进入沉积物;在缺氧硫化水体中,Mo 会以不溶硫化物的形式在沉积物中高度富集。
2.3 钒(V)
在氧化水体中,V (+5)形成 HVO42-、H2VO4-离子[5]。 与 UO22+和 MoO42-类似,少部分 HVO42-、H2VO4-离子也可以吸附于Mn-Fe(氢)氧化物表面进入沉积物[5,29]。在中度还原水体中,V (+5)将转化为 V (+4)并形成 (VO2+)、VO(OH)3-、VO(OH)2微粒[30]。 这些微粒可与有机物发生络合进入沉积物中[31]。 在缺氧硫化水体中,H2S 会将 V(+4)进一步还原为 V (+3),并形成 V2O3和 V(OH)3沉淀[32]。 因此,水体越还原,沉积物中将相对更加富集V[33]。
2.4 铬(Cr)
在氧化水体中,Cr (+6) 主要以铬酸根离子(CrO42-)形式存在,其中少数CrO42-可进入碳酸盐晶格进行共沉淀。 在缺氧水体中,大量Cr (+6)会被还原为 Cr (+3)并形成 Cr(OH)2+离子。 当 pH 约为7 时,Cr(OH)2+易与腐植酸和富里酸结合进行沉降,也可以吸附在Mn-Fe(氢)氧化物表面进行沉降[34];当 pH 更高时,Cr(OH)2+将进一步转变为 Cr(OH)3或Cr2O3不溶物沉积, 最终以有机络合物或氧化物形式在沉积物中埋藏保存[35-36]。 此外,陆源碎屑大量Cr (+3)输入(如铬铁矿、铁镁矿物、粘土矿物等)会干扰原生铬沉积信息,限制了其在古环境研究中的应用[37]。
2.5 钴(Co)
在氧化水体中,Co (+2)多以 Co2+离子形式存在,当其吸附于Mn-Fe(氢)氧化物表面进行沉降时,Co (+2)可被进一步氧化为 Co (+3)[38];除此以外,Co2+离子也可以与腐植酸或富里酸发生络合反应从而沉淀[39-40]。 在缺氧硫化水体中,Co2+离子会与H2S 反应形成不溶硫化物CoS, 并进一步参与形成FeS2固溶体[41]。 但是,与元素 Cr 相似,碎屑物质中往往具有高Co 含量, 因此极大限制了其在重建古水体氧化还原状态中的应用[5]。
2.6 镍(Ni)
在氧化水体中,Ni (+2)多以 Ni2+和 NiCl+离子形式存在。其中,Ni2+易形成有机金属配位体发生沉降[10,42]。少数 Ni (+2)可形成 NiCO3微粒并吸附于有机质表面发生沉降[10,26]。在缺氧硫化水体中,除有机质吸附络合外,Ni2+还会与H2S 反应生成NiS 不溶物,或进一步参与 FeS2固溶体的形成[41,43]。 通常,与有机质相关的自生沉积Ni 最终以Ni-卟啉的形式保存[42,44]。
2.7 铜(Cu)
在氧化水体中,Cu (+2)多以 Cu2+和 CuCl+离子形式存在。其中,Cu2+容易进入有机物形成有机金属配位体[10,26]。除此以外,部分 Cu2+也可以吸附于 Mn-Fe(氢)氧化物表面进行沉降[45]。 在缺氧硫化水体中,Cu (+2)会被还原成 Cu (+1),随后以 Cu2S 形式沉积;Cu2S 也可以参与 FeS2固溶体形成[41,43]。
2.8 锌(Zn)
在氧化水体中,Zn (+2)主要以 Zn2+和 ZnCl+形式存在[10],并且Zn2+易与腐植酸和富里酸发生络合,或吸附于 Mn-Fe(氢)氧化物表面进行沉积[10,26]。 在缺氧硫化水体中,Zn2+会形成独立的自生硫化物相,如闪锌矿([Zn, Fe]S)[41,43]。
2.9 镉(Cd)
在氧化水体中,Cd(+2)多以 Cd2+形式存在,Cd2+主要以有机络合物形式进入沉积物,基本不受Mn-Fe(氢)氧化物的吸附影响[46]。 在缺氧硫化水体中,Cd (+2)也可以形成独立的硫化物相(CdS)而发生沉积[41]。
一般情况下, 水体中 Ni、Cu、Zn、Cd 的自生沉积主要是以有机络合物的形式发生沉淀。在湖泊演化的过程中,底部水体持续缺氧将有利于有机物质的保存, 因此高 TOC 含量伴随高 Ni、Cu、Zn、Cd 含量可能指示缺氧古水体的存在。
3 Mn-Fe 循环模式与微量金属元素富集机制
元素Mn 和Fe 在沉积物中一般含量较高,属于主量元素的范畴, 并不是本文的重点研究对象。但是, 作为具有多价态的金属元素,Mn 和Fe 在水体和沉积物中的循环模式对上述微量金属元素的地球化学行为有显著影响,尤其当湖水存在季节性氧化还原状态的变化时[47,48]。
在表层氧化水体中,Mn 容易形成MnOOH (+3)和MnO2(+4)微粒,并快速沉降至深水及沉积物中[10](图 1)。 当锰(氢)氧化物微粒越过氧化还原界面后,部分微粒会进入沉积物中快速埋藏;而另一部分微粒会被还原至+2 价并以可溶性Mn2+或Mn-Cl+形式重新进入周围水体。 Mn2+和MnCl+可以向上覆氧化水体扩散[47,49],也可向下扩散至沉积物的孔隙水中(图 1)。 其中,Mn2+和 MnCl+向上扩散会导致MnOOH 和MnO2微粒在氧化水体中重新形成[50];而向下扩散至孔隙水中的Mn2+易与CO32-在微环境达到过饱和并析出 MnCO3沉淀[10,51-53], 部分 Mn2+和MnCl+也会与孔隙水中的硫化氢相结合, 最终以硫化物形式在沉积物中保存[54](图1)。
Fe 在水体中表现出与Mn 相近的地球化学性质。 在表层氧化水体中,Fe (+3)主要以 Fe3+离子或非晶质铁(氢)氧化物微粒形式存在,此外,Fe (+2)也可以进入粘土矿物晶格中并稳定存在(图1)。 当上述微粒跨越氧化还原界面后,部分非晶质铁(氢)氧化物微粒将被还原溶解形成Fe2+离子(图1)。 一部分Fe2+离子会向上扩散并被重新氧化为非晶质的铁(氢)氧化物微粒[47]。 另一部分Fe2+离子向下扩散可以形成 Fe-Mo-S 矿物(FeMo0.6S2.8)[55]或 Fe-硫化物(如 FeS、FeS2和 Fe3S4等)在沉积物中保存[54,56](图 1)。

图1 Mn-Fe在分层湖水中的循环模式图Fig .1 Conceptual model of Mn and Fe redox cycling in stratified lakes
Mn-Fe 的氧化还原循环对于微量金属元素在沉积物中的富集过程有显著的影响,其主要机理是Mn-Fe(氢)氧化物对特定离子的吸附、解吸附过程,其中受影响较大的离子包括 Ni2+、Cu2+、Zn2+、Co2+、MoO42-、Cr(OH)2+和 VO2+等。 以元素钼(Mo)为例,Mn-Fe(氢)氧化物微粒会吸附氧化水体中的MoO42-离子发生沉降。当Mn-Fe(氢)氧化物微粒越过氧化还原界面后,其会缓慢溶解并向周围环境释放MoO42-离子。 如果氧化还原界面位于沉积物深部, 则上述Mn-Fe 的氧化还原循环将大幅受限, 仅有少数MoO42-离子会进入孔隙水发生沉积;如果氧化还原界面位于沉积物浅部或接近沉积物的底部水体,高效的Mn-Fe 循环会不断将浅部水体的MoO42-离子转移并扩散至沉积物孔隙水中,MoO42-最终将以Mo-Fe-S 形式在沉积物中富集[6,31,57];而如果氧化还原界面位于水体中上部, 虽然水体中具有高效的Mn-Fe 的氧化还原循环,但被吸附的MoO42-离子多数会重新进入水体当中,只有少部分扩散至沉积物孔隙水中发生沉淀[58]。 综上所述,氧化还原界面的位置将调控Mn-Fe 的氧化还原循环, 进而影响特定离子的吸附、解吸附和沉淀过程。值得注意的是,Mn (+2)转变为 Mn (+4)的反应速率缓慢,因此其可穿越氧化还原界面进行价态转变(图1)。
4 陆源碎屑、 成岩作用和热液系统对湖泊沉积物中微量金属元素分布的影响
4.1 陆源碎屑的影响
陆源碎屑物质可以随河流运输进入湖泊中沉积,会直接影响沉积物中特定微量金属元素的分布和含量。在利用沉积物微量金属元素重建古水体信息时,需计算陆源碎屑比例并扣除其影响。 鉴于元素Al、Ti、Zr 等基本来源于碎屑物质,且在成岩过程中不易流失,因此沉积物中这些元素与特定微量金属元素含量的相关性是判断碎屑物质是否大量混入的有效方法[10,37,59]。 一般而言,若湖泊沉积物中特定微量金属元素含量与Al、Ti、Zr 含量呈现明显正相关关系,则受到陆源碎屑的影响较大;若特定微量金属元素含量与Al、Ti、Zr 含量呈现弱正相关关系,则该微量金属元素的含量可能是碎屑输入和自生成因的二端元混合,其自生成因含量应通过以下公式校正(以 Al、Ti 为例):
X自生= X样品- X碎屑,
其中 X碎屑= (X/Al)标准× Al样品,
或 X碎屑= (X/Ti)标准× Ti样品。
除此以外,Al 和Ti 也被用于判断特定微量金属元素在沉积物中的相对富集程度[10,46],一般用元素富集系数(EF)来指示:
EF元素X= (X/Al)样品/(X/Al)标准,
或 EF元素X= (X/Ti)样品/(X /Ti)标准。
公式中“标准”多采用大陆上地壳(UCC)、后太古宙澳大利亚平均页岩(PAAS)、或者全球平均页岩(AS)的值(表 1)[60-64]。 如果 EF元素X大于 1,则表明元素X 相对于标准沉积物富集,反之则为亏损。
值得注意的是, 利用Al 含量校正和计算微量金属元素的自生含量可能会受到“过剩铝”效应的影响[9]。 “过剩铝”是指湖水中少数溶解态铝吸附于有机质发生沉降进入沉积物, 因此用Al 含量评估碎屑影响可能会出现偏差[65,66]。 相比于 Al,元素 Ti基本不受有机质吸附影响[9]。此外,Perkins 等[67]通过汇总全球大量页岩数据,建立了各种微量金属元素与Al2O3的线性拟合, 作为判断元素自生富集的依据: 即当沉积样品中特定微量金属元素与Al2O3比值位于对应拟合线之上时,指示该微量金属元素相对富集。 Algeo 和Li[68]认为通过分析一套沉积物中氧化还原敏感元素之间的共变关系也可以大致确定碎屑物质的元素贡献:即两种氧化还原敏感元素在共变之前的初始值代表了在氧化条件下,这两种元素在碎屑物质中的含量。 相比于海相沉积,湖泊沉积的陆源碎屑物质组成在不同地域可能存在较大差异[69]。 因此在进行相关校正和计算时,要具体考虑上述校正标准 (UCC、PAAS 和 AS) 的可适用性。有研究采用湖泊邻近的黑色页岩地层单元的元素组成作为碎屑输入的校正标准[26];此外,通过测定输入河流的碎屑物质组成也是反推湖泊沉积物碎屑特征的有效手段[21]。
4.2 早期成岩作用的影响
当微量金属元素进入沉积物后,湖泊底部水体氧化还原状态的波动可能会导致沉积物中特定元素的再分配,这种早期成岩作用会一定程度影响微量金属元素在反演古环境中的应用。 例如,当底部水体由厌氧快速转变为有氧时,浅层沉积物中的U(+4)会被再次氧化为可溶性的U (+6)离子并重新返回水体, 该过程会改变元素U 记录的原始水体环境信息[15,51,70]。 底部氧化水体扩张通常与风力驱动的湖水混合、大规模浊流事件,以及底栖生物扰动有关; 而底部厌氧水体扩张通常与湖水富营养化、湖水分层,以及生态系统崩溃有关。值得注意的是, 微量金属元素在沉积物中的富集途径众多,包括形成金属硫化物、黄铁矿固溶体、不溶氧化物,以及吸附在有机物表面。 因此,不同微量金属元素在早期成岩过程中的再分配程度存在较大差异,高沉积速率和稳定的埋藏条件有利于金属微量元素记录原始的环境信息。

表1 大陆上地壳(UCC)[60]、后太古宙澳大利亚平均页岩(PAAS)[61,62],以及平均页岩(AS)[63,64]中特定元素丰度Table 1 Selected element abundances in Upper Continental Crust(UCC),Post-Archean Australian Shales(PAAS),and Average Shales(AS)
4.3 热液系统的影响
湖底热液和后期成岩作用中的热液交代能够改造沉积物中微量金属元素的绝对含量和分配模式,因此在实际研究中,需对热液系统影响做出判断。沉积物中的矿物共生组合(如低温矿物组合:辉锑矿、黄铜矿、方铅矿、闪锌矿、石英、高岭石和明矾石等)、矿物结构(如重结晶等)、构造特征(如通过充填和交代作用形成岩石蚀变和矿脉等)和特定矿物的稀土元素配分模式是评估热液系统影响的常用方法[71-73]。 例如,如果沉积物中存在燧石条带,热液活动可能导致其稀土元素配分模式出现明显的Eu正异常(Eu/Eu*= 3EuN/(2SmN+TbN))[36]、轻 REE 富集,以及 Y/Ho 比小于 32 等特征。
5 多重指标判别古湖泊水体氧化还原条件
5.1 微量金属元素富集与古氧化还原界面
在多数现代海水和湖水中,氧化还原界面通常位于水岩界面之下的沉积物中,还原带可根据氧化还原电势进一步分为:反硝化带、Mn (+4)还原带、Fe (+3)还原带、硫酸盐还原带、产甲烷带[74,75](图2)。而微量金属元素在上述不同还原带中的富集程度存在差异,因此,利用多种微量金属元素可以进一步制约古水体的还原程度。 一般来说,Cr、U 和V在厌氧反硝化带中更容易富集; 而 Ni、Co、Cu、Zn、Cd 和Mo 则在硫酸盐还原带中更容易富集。 因此,我们可以通过分析特定微量金属元素的富集组合特征来进一步限定古氧化还原界面的大致位置,反推特定还原带是否由沉积物转移至水体中。 例如,U 和V 的还原富集在反硝化带即可发生;而Mo 的还原富集则需要H2S 的存在,即发生在硫酸盐还原带附近。 因此,当沉积物中U 和V 富集而Mo 不富集时,其表明反硝化带接近水岩界面,而硫酸盐还原带可能仍处于沉积物内部,因此古水体硫化可能性较小;而当沉积物中同时富集U、V、Mo 时,则表明整个氧化还原界面在这一时期大幅上升,而硫酸盐还原带可能从沉积物转移至沉积物表层或湖泊水体中,底层湖水极有可能处于缺氧甚至缺氧硫化状态[76-78]。

图2 有氧水体沉积物中的氧化还原带[74-75]Fig. 2 Redox zone in sediments beneath oxic waters
湖泊沉积物中微量金属元素含量除了受古水体氧化还原条件影响外,水体本身的元素含量也是其重要影响因素之一。水体中特定元素含量能够直接影响该元素从水体进入沉积物的绝对通量。特定的地质事件可能会改变湖水中微量金属元素的初始浓度, 导致在较长一段时间该元素在沉积物中“失真”。 例如,当输入河流改道经过富Mo 矿床时,进入湖泊的可溶解态Mo 将急剧上升,并导致同时期湖泊沉积物中的Mo 含量增加。此时,利用Mo 含量判断古湖水的氧化还原条件将会带来错误的结论。这也强调了运用多重指标重建古水体环境信息的重要性。
5.2 微量金属元素-TOC 关系图与古氧化还原条件
Tribovillard 等[5]结合众多现代沉积物和沉积岩的微量金属元素数据,系统探讨了总有机碳(TOC)与 Ni、Cu、Mo、V、U 含量的关系(图 3)。 在氧化-次氧化水体中,沉积物 Ni、Cu、Mo、V 和 U 主要来源是碎屑输入,因此其含量与TOC 相关性较差;在缺氧水体中,元素U、V、Mo 可通过化学自生沉积方式发生沉淀, 也可吸附于有机质表面进行沉降。 因此,U、V、Mo 呈现中等程度富集并与TOC 呈现较为良好的正相关关系;而元素Ni、Cu 主要以有机金属络合物的形式沉降,并最终经有机质降解在孔隙水中形成铁-硫化物, 因此Ni 和Cu 在沉积物中呈现中度富集并与TOC 有显著正相关关系。 在缺氧硫化水体中,由于水体中溶解硫化氢的存在,大量的U、V、Mo 将快速形成金属硫化物并发生沉降, 最终在沉积物中高度富集, 其含量与TOC 呈现弱正相关关系;元素Ni、Cu 在缺氧硫化条件下的富集机制仍是以形成有机金属配位体为主, 因此,Ni、Cu 在沉积物中高度富集并与TOC 呈现良好的正相关关系。通过综合分析 U、V、Mo、Ni、Cu 的富集程度及其与总有机碳(TOC)的关系,可有效制约古水体的氧化还原状态(图3)。
Tribovillard 等[5]虽然阐述了元素富集在判别古氧化还原环境中的适用性,但却没有指出可用来区分不同沉积环境的具体元素富集值。 最近,Bennett和Canfield[79]对现代不同沉积环境(包括受限性永久硫化盆地、存在季节性或永久性最小氧气带的开放性大陆边缘环境和氧化海相环境)沉积物中的微量金属元素数据进行汇总分析,在置信区间内得到用于指示现代不同沉积环境的微量金属元素富集程度阈值,为判别古水体环境提供重要依据。文中,富集程度定义为微量金属元素浓度与Al 浓度之比(μg g-1/%)。 当 Mo 富集程度大于 5 μg g-1/%,V 富集程度大于 23 μg g-1/%且不超过 46 μg g-1/%时,指示硫化盆地沉积环境;当U 富集程度大于5 μg g-1/%,V 富集程度大于 46 μg g-1/%且 Mo 富集程度大于5 μg g-1/%时指示位于永久最小氧气带内的缺氧沉积环境;而当 U 富集程度大于 1 μg g-1/%、V 富集程度小于 23 μg g-1/%且 Mo 富集程度小于 5 μg g-1/%时, 指示位于永久最小氧气带下的氧化沉积环境;当 Re 富集程度小于 1.3 ng g-1/%且 Mo 小 于 0.4 μg g-1/%时可能指示正常的氧化环境。
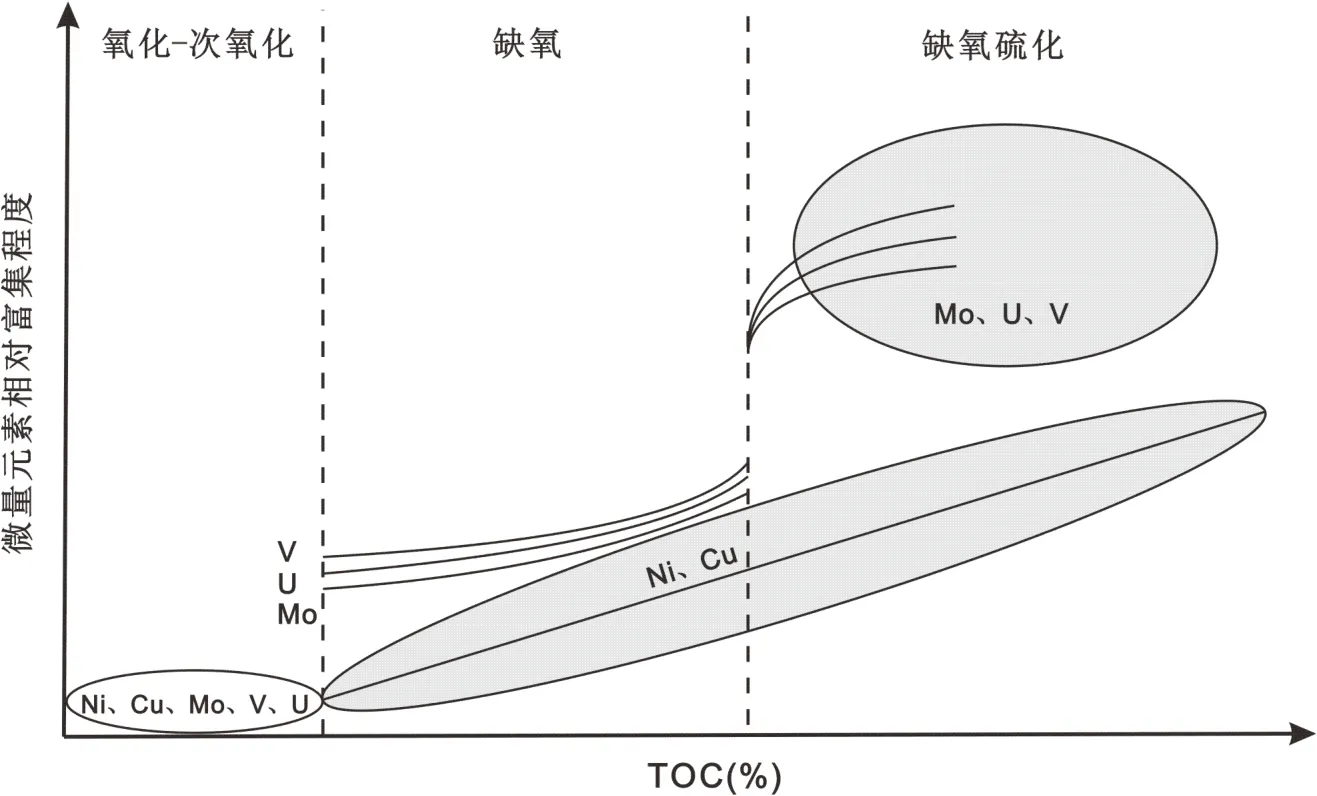
图3 沉积物中总有机碳(TOC)与Ni、Cu、Mo、V、U相对富集程度关系图(修改自Tribovillard等[5])。 箭头方向为增大。Fig. 3 Schematic diagram illustrating total organic carbon (TOC) versus relative enrichment of Ni, Cu, Mo, V, and U in sediments (modified from Tribovillard et al.[5]).The directions of arrows indicate increase.
5.3 元素比值判断古水体氧化还原状态
在实际应用中,沉积物中微量金属元素含量的比值也是判断沉积环境的有效指标,其主要原理是不同微量金属元素对外界氧化还原条件变化的敏感度不同,因此二者的富集程度将存在差异[80]。 元素含量比值可以给出判断古水体氧化还原条件的较为定量的标准。
5.3.1 Th /U 比值
Th 和U 同为锕系元素, 二者均易以不溶氧化物的形式赋存于陆源碎屑中。 在氧化水体中,碎屑物质中少部分 U (+4)会被氧化至 U (+6),并以可溶离子形式脱离碎屑组分[81];在还原水体中,U 将在沉积物中高度富集;而Th (+4)则在不同氧化还原环境下稳定存在于碎屑物质中,其富集程度不受水体氧化还原条件控制。 因此,沉积物Th/U 比值可作为反演沉积环境氧化还原的可靠指标[82,83]。 一般而言,Th/U 值范围在 0~2 指示缺氧环境;Th/U值大于8 则指示强氧化环境[82]。
5.3.2 V /Ni 比值
V 和Ni 的富集机制存在显著差异, 二者比值也经常用于判别水体的缺氧程度[84-86]。 在缺氧水体中,V 比Ni 更易在沉积物中富集,这主要是因为部分有机质被硫酸盐还原菌矿化,而Ni-卟啉会随有机质分解丢失;V2O3和V(OH)3可以在沉积物中稳定存在,其稳定性远大于Ni-卟啉。 Galarrag 等[84]根据经验指出,V/Ni 比值大于3 可能指示硫化沉积环境;V/Ni 比值范围在 1.9~3 指示次氧化-氧化的沉积环境; 而 V /Ni 比值小于 1.9 则指示氧化沉积环境。
5.3.3 V /Cr 比值
陆源碎屑矿物中的Cr(+3)是湖泊沉积物中Cr元素的主要来源, 而V 的富集机制主要受控于古水体的氧化还原状态。 因此V/Cr 比值可剔除陆源碎屑物质的影响, 有效指示古水体的氧化还原程度。 Krejci-Graf[87]指出,当 V/Cr > 2 时,代表古水体中可能含有溶解性H2S,即为缺氧硫化环境;当2 >V/Cr > 1 时, 古水体为较弱的还原环境; 当 V/Cr比值接近1 则指示O2-H2S 界面在沉积物内[81]。
5.3.4 Ce/Ce*
稀土元素主要以+3 价存在于不溶碎屑矿物晶格中,但在强氧化水体中,部分Ce (+3)将转化为Ce (+4)并以可溶性离子形式脱离碎屑物质。因此,碎屑沉积物中元素Ce 的实测值和理论值的比值可以用来指示古水体的氧化还原程度[88-90]。 通常定义Ce异常为 Ce/Ce*,Ce/Ce*= 2CeN/(LaN+PrN)[91,92], 式中“N”代表标准化丰度值;“Ce*”为理论含量。 当 Ce/Ce*比值大于 0.8 指示缺氧环境,比值小于 0.8 指示氧化-次氧化环境[88]。
值得注意的是,特定微量金属元素比值作为划分氧化和缺氧界限存在数值上的争议[80]。 例如,目前被广泛使用的比值判断标准之一是来源于Jones和Manning[81]在1994 年的工作。而对于美国东部泥盆纪页岩的研究[93,94]表明,使用 Jones 和 Manning[81]建立的判断氧化还原环境的比值标准和众多其他指标存在矛盾。 而Algeo 和Liu[80]的最新研究认为,Jones 和Manning[81]在使用黄铁矿化程度值(DOP)时存在概念偏差, 导致以此划分的判定氧化还原U/Th、V/Cr 和 Ni/Co 的数值不准确。 当然,这并不意味着元素比值这一方法不可靠,大量现代海洋和湖泊的数据积累是获取古环境判别值的有效手段[80,95]。此外,Algeo 和Liu[80]对金属元素比值指标与TOC进行相关性分析后发现: 在富含有机质的沉积物中,Ni/Co、U/Th 和 V/Cr 等指标在指示氧化还原环境时表现良好; 而在有机质匮乏的沉积物中,Ni/V和 (Cu+Mo)/Zn 等指标指示氧化还原环境时则更为精准。
6 结语
在使用微量金属元素重建湖泊水体氧化还原环境时,应综合考虑各个指标的限定条件和适用范围,并且注意湖泊之间的差异性。与此同时,多种微量金属元素协同制约古水体氧化还原状态比单一指标更加可靠。 通过结合沉积物的粒度分析、TOC分析、元素价态分析,以及同位素组成分析,可以更加准确制约古水体及沉积物的氧化还原条件。
